名校
解题方法
1 . 铜是重要的过渡元素,其单质及化合物具有广泛用途。回答下列问题:
(1)铜元素基态原子的价电子排布式为________ 。
(2)铜元素能形成多种配合物,如Cu2+与乙二胺(H2N-CH2-CH2-NH2)可形成如图所示配离子。
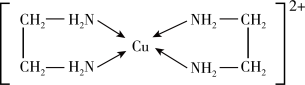
①Cu2+与乙二胺所形成的配离子内部粒子间的作用力类型有________ 。
A.配位键 B.极性键 C.离子键 D.非极性键 E.氢键 F.金属键
②乙二胺分子中氮原子的杂化轨道类型为________ ,C、N、H三种元素的电负性由大到小顺序是 ___ 。
③乙二胺和三甲胺 [N(CH3)3]均属于胺,乙二胺的沸点比三甲胺高很多,原因是________ 。
(3)Cu2+在水溶液中以[Cu(H2O)4]2+形式存在,向含Cu2+的溶液中加入足量氨水,可生成更稳定的[Cu(NH3)4]2+,其原因是______ 。
(4)Cu和S形成某种晶体的晶胞如图所示。
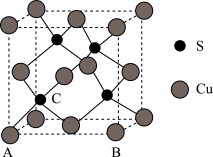
①该晶体的化学式为________ 。
②该晶胞原子坐标参数A为(0,0,0);B为(1,0,0)。则C原子的坐标参数为________
③已知该晶体的密度为 dg•cm-3,Cu2+和S2-的半径分别为apm和bpm,阿伏加 德罗常数值为NA。列式表示该晶体中原子的空间利用率________ 。
(1)铜元素基态原子的价电子排布式为
(2)铜元素能形成多种配合物,如Cu2+与乙二胺(H2N-CH2-CH2-NH2)可形成如图所示配离子。

①Cu2+与乙二胺所形成的配离子内部粒子间的作用力类型有
A.配位键 B.极性键 C.离子键 D.非极性键 E.氢键 F.金属键
②乙二胺分子中氮原子的杂化轨道类型为
③乙二胺和三甲胺 [N(CH3)3]均属于胺,乙二胺的沸点比三甲胺高很多,原因是
(3)Cu2+在水溶液中以[Cu(H2O)4]2+形式存在,向含Cu2+的溶液中加入足量氨水,可生成更稳定的[Cu(NH3)4]2+,其原因是
(4)Cu和S形成某种晶体的晶胞如图所示。

①该晶体的化学式为
②该晶胞原子坐标参数A为(0,0,0);B为(1,0,0)。则C原子的坐标参数为
③已知该晶体的密度为 dg•cm-3,Cu2+和S2-的半径分别为apm和bpm,阿伏加 德罗常数值为NA。列式表示该晶体中原子的空间利用率
您最近一年使用:0次
2020-09-01更新
|
807次组卷
|
4卷引用:陕西省西安中学2020届高三第二次模拟考试化学试题
解题方法
2 . 金属钛被誉为“二十一世纪金属”,有“生物金属,海洋金属,太空金属”的美称,具有广泛的应用前景。回答下列问题:
(1)钛在周期表中的位置___________ , 钛原子核外有___________ 种空间运动状态不同的电子,Ti2+电子占据的最高能层的电子排布式为___________ 。
(2)磷酸钛铝锂可用作锂离子电池的正极材料,PO 的空间构型是
的空间构型是___________ ,第一电离能介于Al、P之间的第三周期元素为___________ (填元素符号)。
(3)Ti(BH4)2是一种储氢材料,其中所含元素的电负性由小到大排列顺序为___________ ,B原子的杂化方式是___________ ,其中的BH 可由BH3和H-结合而成。BH
可由BH3和H-结合而成。BH 含有
含有___________ (填序号)
①σ键 ②π键 ③氢键 ④配位键 ⑤离子键
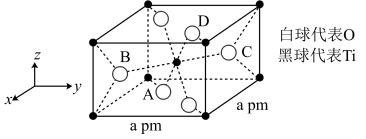
(4)TiO2的一种晶胞具有典型的四方晶系结构(如图所示),以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。晶胞中A、B的原子坐标为(0.31,0.31,0),(0.81,0.19,0.5)。已知晶胞含对称中心,则C、D原子坐标为___________ 、___________ 。该晶胞中B、C两个氧原子之间的核间距d=___________ pm。
(1)钛在周期表中的位置
(2)磷酸钛铝锂可用作锂离子电池的正极材料,PO
 的空间构型是
的空间构型是(3)Ti(BH4)2是一种储氢材料,其中所含元素的电负性由小到大排列顺序为
 可由BH3和H-结合而成。BH
可由BH3和H-结合而成。BH 含有
含有①σ键 ②π键 ③氢键 ④配位键 ⑤离子键
(4)TiO2的一种晶胞具有典型的四方晶系结构(如图所示),以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。晶胞中A、B的原子坐标为(0.31,0.31,0),(0.81,0.19,0.5)。已知晶胞含对称中心,则C、D原子坐标为

您最近一年使用:0次
2021-05-14更新
|
373次组卷
|
2卷引用:陕西省西安市长安区2021届高三5月第二次模拟考试理综化学试题
名校
解题方法
3 . LiFePO4、聚乙二醇、LiPF6、LiAsF6、LiCl等常用作锂离子聚合物电池的材料和载体。
回答下列问题:
(1)LiFePO4中Fe的价层电子排布式为___________ 。
(2)LiPF6、LiAsF6和LiCl中所含的四种非金属元素电负性由大到小的顺序为___________ 。
(3)含氧酸的通式可写为(HO)mROn,根据化学学科的规律下列几种酸中酸性与H3PO4相近的有________ 。
a.HClO b.HClO3 c.H2SO3 d.HNO2
(4)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸(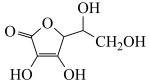 )常被用作碳包覆的碳源,其易溶于水的原因是
)常被用作碳包覆的碳源,其易溶于水的原因是____________________ ,该分子中碳原子的杂化方式为___________ 。
(5)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)
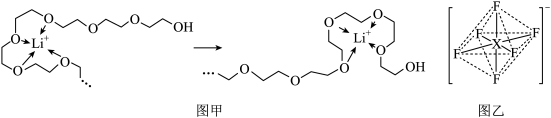
①从化学键角度看,Li+迁移过程发生___________ (填“物理变化”或“化学变化”)。
②相同条件,Li+在___________ (选填“LiPF6”或“LiAsF6”)中迁移较快,原因是___________ 。
(6)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl·3H2O属正交晶系(长方体形)晶胞参数为0.72mm、1.0nm、0.56nm。如图为沿x轴投影的晶胞中所有Cl原子的分布图和原子分数坐标。
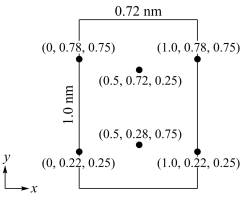
①该晶胞中Cl原子的数目为___________ 。
②LiCl·3H2O的摩尔质量为Mg·mol-1,设NA为阿伏加 德罗常数的值,则LiCl·3H20晶体的密度为___ g·cm-3(列出计算表达式)。
回答下列问题:
(1)LiFePO4中Fe的价层电子排布式为
(2)LiPF6、LiAsF6和LiCl中所含的四种非金属元素电负性由大到小的顺序为
(3)含氧酸的通式可写为(HO)mROn,根据化学学科的规律下列几种酸中酸性与H3PO4相近的有
a.HClO b.HClO3 c.H2SO3 d.HNO2
(4)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸(
 )常被用作碳包覆的碳源,其易溶于水的原因是
)常被用作碳包覆的碳源,其易溶于水的原因是(5)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)

①从化学键角度看,Li+迁移过程发生
②相同条件,Li+在
(6)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl·3H2O属正交晶系(长方体形)晶胞参数为0.72mm、1.0nm、0.56nm。如图为沿x轴投影的晶胞中所有Cl原子的分布图和原子分数坐标。

①该晶胞中Cl原子的数目为
②LiCl·3H2O的摩尔质量为Mg·mol-1,设NA为阿伏加 德罗常数的值,则LiCl·3H20晶体的密度为
您最近一年使用:0次
名校
解题方法
4 . 很多过渡金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Fe的基态原子价电子排布式为___________ 。
②Ti的基态原子共有___________ 种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由小到大的顺序是___________ (用元素符号表示)。
②CCl4和COCl2分子中所有原子均满足8电子构型,CCl4和COCl2分子中σ键的个数比为_______ ,COCl2分子的中心原子的杂化方式为_________ 。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,从微观角度解释NiO的熔点高于FeO的原因为___________ 。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
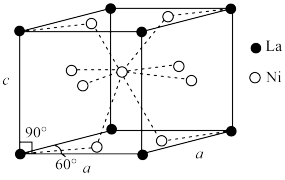
①该晶体的化学式为___________ 。
②已知该晶胞的摩尔质量为Mg·mol-1,密度为dg·cm-3.设NA为阿伏加德罗常数的值,则该晶胞的体积是___________ cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=500pm,c=400pm;标准状况下氢气的密度为9×10-5g·cm-3;储氢能力= 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为___________ 。(NA可近似取6×1023,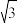 =1.7)
=1.7)
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Fe的基态原子价电子排布式为
②Ti的基态原子共有
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由小到大的顺序是
②CCl4和COCl2分子中所有原子均满足8电子构型,CCl4和COCl2分子中σ键的个数比为
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,从微观角度解释NiO的熔点高于FeO的原因为
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为
②已知该晶胞的摩尔质量为Mg·mol-1,密度为dg·cm-3.设NA为阿伏加德罗常数的值,则该晶胞的体积是
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=500pm,c=400pm;标准状况下氢气的密度为9×10-5g·cm-3;储氢能力=
 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为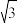 =1.7)
=1.7)
您最近一年使用:0次
2021-04-08更新
|
311次组卷
|
4卷引用:陕西省西安市长安区2021届高考第一次模拟考试理综化学试题
5 . Fe、Co、Ni、Cu均为第四周期元素,它们的化合物在生产、生活中有着广泛的应用。
(1)基态Fe原子的核外电子中,两种自旋状态的电子数之比为___________ 。在空气中FeO稳定性小于 ,从电子排布的角度分析,其主要原因是
,从电子排布的角度分析,其主要原因是___________ 。
(2) 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中,VSEPR模型为四面体的非金属原子共有
。该化合物分子中,VSEPR模型为四面体的非金属原子共有___________ 个;C、N、B的电负性由小到大的顺序为___________ 。
(3)基态 的核外电子排布式为
的核外电子排布式为___________ ; 常温下为无色液体,写出两种与CO互为等电子体离子的化学式
常温下为无色液体,写出两种与CO互为等电子体离子的化学式___________ 、___________ 。
(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为___________ ;该晶体的化学式为___________ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点、B点原子的分数坐标分别为 、
、 ,则c点原子的分数坐标为
,则c点原子的分数坐标为___________ ;晶胞中C、D间距离d=___________ pm。
(1)基态Fe原子的核外电子中,两种自旋状态的电子数之比为
 ,从电子排布的角度分析,其主要原因是
,从电子排布的角度分析,其主要原因是(2)
 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中,VSEPR模型为四面体的非金属原子共有
。该化合物分子中,VSEPR模型为四面体的非金属原子共有(3)基态
 的核外电子排布式为
的核外电子排布式为 常温下为无色液体,写出两种与CO互为等电子体离子的化学式
常温下为无色液体,写出两种与CO互为等电子体离子的化学式(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为
 、
、 ,则c点原子的分数坐标为
,则c点原子的分数坐标为
您最近一年使用:0次
6 . 氮的化合物在工业生产中有重要用途,请回答下列问题:
(1)[Ni(N2H4)2](N3)2是一种富氮含能材料。写出一种与N 互为等电子体的分子:
互为等电子体的分子:_______ (填化学式);实验数据表明键角:NH3>PH3>AsH3,分析原因是_______ 。
(2)氮与碳还能形成一种离子液体的正离子 ,为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5,不能被H原子替换,原因是
,为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5,不能被H原子替换,原因是_______ 。
(3)配合物顺铂[Pt(NH3)2Cl2]是临床使用的第一代铂类抗癌药物。顺铂的抗癌机理:在铜转运蛋白的作用下,顺铂进入人体细胞发生水解,生成的Pt(NH3)2(OH)Cl破坏DNA的结构,阻止癌细胞增殖。如:
①基态Cu原子价层电子的轨道表示式为_______ ,鸟嘌呤中氮原子的杂化方式为______ 。构成鸟嘌呤的元素电负性由大到小的顺序_______ 。
②在Pt(NH3)2Cl2中,配体与铂(Ⅱ)的结合能力:Cl-_______ NH3(填“>”或“<”)。
③顺铂和反铂互为同分异构体,两者的结构和性质如表。
请从分子结构角度解释顺铂在水中的溶解度大于反铂的原因是________ 。
④顺铂的发现与铂电极的使用有关。铂晶胞为正方体,边长为a nm,结构如图。铂晶体的摩尔体积Vm=_______ m3/mol(阿伏加德罗常数为NA)。(已知:单位物质的量的物质所具有的体积叫做摩尔体积)

(1)[Ni(N2H4)2](N3)2是一种富氮含能材料。写出一种与N
 互为等电子体的分子:
互为等电子体的分子:(2)氮与碳还能形成一种离子液体的正离子
 ,为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5,不能被H原子替换,原因是
,为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5,不能被H原子替换,原因是(3)配合物顺铂[Pt(NH3)2Cl2]是临床使用的第一代铂类抗癌药物。顺铂的抗癌机理:在铜转运蛋白的作用下,顺铂进入人体细胞发生水解,生成的Pt(NH3)2(OH)Cl破坏DNA的结构,阻止癌细胞增殖。如:

①基态Cu原子价层电子的轨道表示式为
②在Pt(NH3)2Cl2中,配体与铂(Ⅱ)的结合能力:Cl-
③顺铂和反铂互为同分异构体,两者的结构和性质如表。
| 顺铂 | 反铂 | |
| 结构 |  | 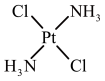 |
| 25℃时溶解度/g | 0.2577 | 0.0366 |
④顺铂的发现与铂电极的使用有关。铂晶胞为正方体,边长为a nm,结构如图。铂晶体的摩尔体积Vm=

您最近一年使用:0次
解题方法
7 . 近年来,我国半导体材料市场发展迅速,其中以氮化嫁、碳化硅、氧化锌、金刚石等为主的材料备受关注。回答下列问题:
(1)基态Ga原子的价电子轨道表示式为___________ ,基态N原子核外电子有___________ 种空间运动状态。Zn在元素周期表中位于___________ 区。
(2)C,N、O的第一电离能由大到小的顺序为___________ 。 的空间结构为
的空间结构为___________ 。
(3)SiC的立方晶胞结构如图1所示,已知;1号C原子的坐标参数为( ,
, ,
, ),晶胞参数为apm。则晶胞中2号C原子的坐标参数为
),晶胞参数为apm。则晶胞中2号C原子的坐标参数为___________ ,C和Si原子的最短距离为___________ pm。
①GaN晶体中N原子的杂化轨道类型为___________ 。
②GaN晶体的密度为___________ g/cm3(列出计算式,用含b、c、NA的代数式表示)。
(1)基态Ga原子的价电子轨道表示式为
(2)C,N、O的第一电离能由大到小的顺序为
 的空间结构为
的空间结构为(3)SiC的立方晶胞结构如图1所示,已知;1号C原子的坐标参数为(
 ,
, ,
, ),晶胞参数为apm。则晶胞中2号C原子的坐标参数为
),晶胞参数为apm。则晶胞中2号C原子的坐标参数为
①GaN晶体中N原子的杂化轨道类型为
②GaN晶体的密度为
您最近一年使用:0次
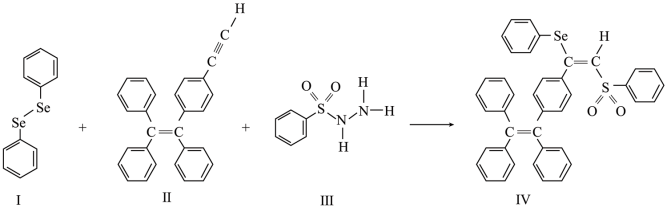
8 . 硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(AIE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子Ⅳ的合成路线如图:
回答下列问题:
(1)Se与S同族,基态硒原子价电子排布式为_____ 。
(2)H2Se的沸点低于H2O,其原因是_____ 。
(3)关于I~Ⅲ三种反应物,下列说法正确的有_____ (填字母)。
A.I中仅有σ键
B.I中的Se-Se键为非极性共价键
C.Ⅱ易溶于水
D.Ⅱ中碳原子的杂化轨道类型只有sp与sp2
E.I~Ⅲ含有的元素中,O电负性最大
(4)Ⅳ中具有孤对电子的原子有_____ (填元素符号)。
(5)硒的两种含氧酸的酸性强弱为H2SeO4_____ H2SeO3(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(Na2SeO4)可减轻重金属铊引起的中毒。SeO 的立体构型为
的立体构型为_____ 。
(6)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:
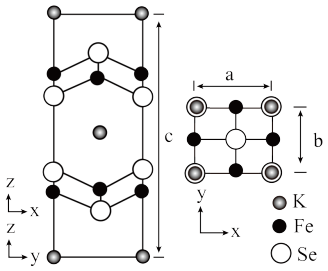
①该超导材料的最简化学式为_____ 。
②Fe原子的配位数为_____ 。
③该晶胞参数a=b=0.4nm、c=1.4nm。阿伏加德罗常数的值为NA,则该晶体的密度为_____ g•cm-3(列出计算式)。

回答下列问题:
(1)Se与S同族,基态硒原子价电子排布式为
(2)H2Se的沸点低于H2O,其原因是
(3)关于I~Ⅲ三种反应物,下列说法正确的有
A.I中仅有σ键
B.I中的Se-Se键为非极性共价键
C.Ⅱ易溶于水
D.Ⅱ中碳原子的杂化轨道类型只有sp与sp2
E.I~Ⅲ含有的元素中,O电负性最大
(4)Ⅳ中具有孤对电子的原子有
(5)硒的两种含氧酸的酸性强弱为H2SeO4
 的立体构型为
的立体构型为(6)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:

①该超导材料的最简化学式为
②Fe原子的配位数为
③该晶胞参数a=b=0.4nm、c=1.4nm。阿伏加德罗常数的值为NA,则该晶体的密度为
您最近一年使用:0次
名校
解题方法
9 . 纳米磷化钻常用于制作特种钻玻璃,制备磷化钻的常用流程如图:
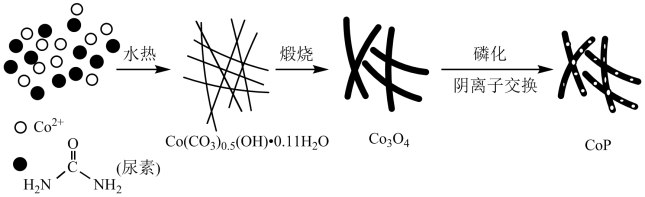
(1)基态P原子的电子排布式为___ 。P在元素周期表中位于___ 区。
(2) 中碳原子的杂化类型是
中碳原子的杂化类型是___ C、N、O三种元素的第一电离能由大到小的顺序是___ (用元素符号表示),电负性由大到小的顺序为___ 。
(3)CO32-中C的价层电子对数为___ ,其空间构型为___ 。
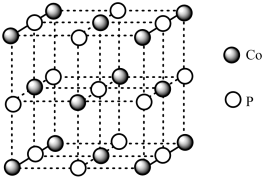
(4)磷化钴的晶胞结构如图所示,最近且相邻两个钴原子的距离为n pm。设NA为阿伏加 德罗常数的值, 则其晶胞密度为___ g.cm-3(列出计算式即可)。

(1)基态P原子的电子排布式为
(2)
 中碳原子的杂化类型是
中碳原子的杂化类型是(3)CO32-中C的价层电子对数为
(4)磷化钴的晶胞结构如图所示,最近且相邻两个钴原子的距离为n pm。设NA为阿伏加 德罗常数的值, 则其晶胞密度为

您最近一年使用:0次
2020-02-15更新
|
418次组卷
|
5卷引用:陕西省西安市周至县第五中学2020届高三第二次模拟考试化学试题
陕西省西安市周至县第五中学2020届高三第二次模拟考试化学试题河南天一大联考2020届高三下学期第一次模拟考试理综化学试题陕西省西安市庆华中学2020-2021学年高三上学期第二次月考化学试题湖南省怀化市中方一中2020届高三下学期第一次模拟测试理综化学试题(已下线)考点14 物质结构与性质(选考)-2020年高考化学命题预测与模拟试题分类精编
解题方法
10 . 磷酸氯喹在细胞水平上能有效抑制新型冠状病毒(SARS-CoV-2)的感染。磷酸氯喹的结构如图所示,据此回答下列问题。
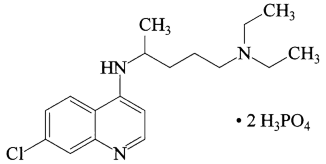
(1)基态P原子中,电子占据的最高能级符号为___ ,基态N原子核外有__ 种运动状态不同的电子。
(2)C、N、O三种元素电负性从大到小的顺序为___ ;第一电离能χ(P)__ χ(Cl)(填“>”或“<”)。
(3)磷酸氯喹中N原子的杂化方式为__ ,NH3是一种极易溶于水的气体,其沸点比AsH3的沸点高,其原因是___ 。
(4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体碳化硅类似,熔点如表所示,
①GaN、GaP、GaAs的熔点变化原因是___ 。
②砷化镓晶体中含有的化学键类型为___ (填选项字母)。
A.离子键 B.配位键 C.σ键 D.π键 E.极性键 F.非极性键
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置。称作原子分数坐标。如图为沿y轴投影的磷化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为(0.25,0.25,0.75),则原子2的原子分数坐标为___ ;若磷化镓的晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶胞中Ga和P原子的最近距离为___ pm(用代数式表示)。
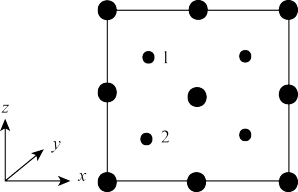

(1)基态P原子中,电子占据的最高能级符号为
(2)C、N、O三种元素电负性从大到小的顺序为
(3)磷酸氯喹中N原子的杂化方式为
(4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体碳化硅类似,熔点如表所示,
| GaN | GaP | GaAs | |
| 熔点/℃ | 1700 | 1480 | 1238 |
②砷化镓晶体中含有的化学键类型为
A.离子键 B.配位键 C.σ键 D.π键 E.极性键 F.非极性键
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置。称作原子分数坐标。如图为沿y轴投影的磷化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为(0.25,0.25,0.75),则原子2的原子分数坐标为

您最近一年使用:0次
2021-05-03更新
|
224次组卷
|
2卷引用:陕西省宝鸡市陈仓区2022届高三上学期第一次教学质量检测化学试题



