陕西省西安市长安区2021届高考第一次模拟考试理综化学试题
陕西
高三
一模
2021-04-08
666次
整体难度:
适中
考查范围:
常见无机物及其应用、有机化学基础、化学与STSE、化学反应原理、物质结构与性质、认识化学科学、化学实验基础
陕西省西安市长安区2021届高考第一次模拟考试理综化学试题
陕西
高三
一模
2021-04-08
666次
整体难度:
适中
考查范围:
常见无机物及其应用、有机化学基础、化学与STSE、化学反应原理、物质结构与性质、认识化学科学、化学实验基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
名校
解题方法
1. 化学与生活密切相关,下列叙述中正确的是
| A.自来水厂常用明矾作消毒杀菌剂 |
| B.侯氏制碱法的工艺过程中应用了物质溶解度的差异 |
| C.为测定“84消毒液”的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 |
| D.生产口罩的无纺布材料是聚丙烯产品,属于天然高分子材料 |
您最近一年使用:0次
2021-04-08更新
|
276次组卷
|
2卷引用:陕西省西安市长安区2021届高考第一次模拟考试理综化学试题
单选题
|
适中(0.65)
名校
2. 艾司洛尔是预防和治疗手术期心动过速或高血压的一种药物,其结构如图,下列有关该有机物说法错误的是
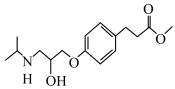

| A.分子式为C16H25NO4 |
| B.分子中含有1个手性碳原子(连接4个不同基团的碳原子称为手性碳原子) |
| C.一定条件下,能发生氧化、加成、取代和消去反应 |
| D.不能使酸性重铬酸钾溶液变色 |
您最近一年使用:0次
2021-04-08更新
|
285次组卷
|
4卷引用:陕西省西安市长安区2021届高考第一次模拟考试理综化学试题
单选题
|
适中(0.65)
名校
解题方法
3. 下列实验方案能实现相应实验目的或得出相应结论的是
| 选项 | 实验方案 | 实验目的或结论 |
| A | 向20%蔗糖溶液中加入少量稀H2SO4,加热;再加入银氨溶液,未出现银镜 | 蔗糖未水解 |
| B | 将NaOH的乙醇溶液加入溴乙烷中加热,将产生的气体直接通入溴水中,褪色 | 证明溴乙烷的消去反应有乙烯生成 |
| C | 用两支试管各取5mL0.1mol·L-1的KMnO4溶液,分别加入2mL0.1mol·L-1和0.2mol·L-1的草酸溶液,记录溶液褪色所需的时间 | 探究浓度对化学反应速率的影响 |
| D | 在相同温度下,向1mL0.2mol·L-1NaOH溶液中滴入2滴0.1mol·L-1MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol·L-1FeCl3溶液,又生成红褐色沉淀 | 溶解度:Mg(OH)2>Fe(OH)3 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-04-08更新
|
320次组卷
|
2卷引用:陕西省西安市长安区2021届高考第一次模拟考试理综化学试题
单选题
|
适中(0.65)
名校
4. 一种由短周期主族元素组成的化合物(如图所示),可用于制备各种高性能防腐蚀材料。其中W、X、Y、Z的原子序数依次增大且占据三个不同周期。下列说法不正确的是
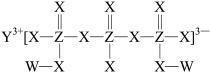
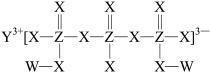
| A.简单离子半径:Z>X>Y |
| B.工业上电解熔融态X与Y组成的化合物制备单质Y |
| C.Z的最高价氧化物对应的水化物为强酸 |
| D.该化合物中Z不满足8电子稳定结构 |
您最近一年使用:0次
2021-04-08更新
|
311次组卷
|
2卷引用:陕西省西安市长安区2021届高考第一次模拟考试理综化学试题
5. 锌镉渣是生产立德粉(硫化锌和硫酸钡的混合物)的废渣,其主要成分为锌、镉、锰、铁及其氧化物等,如图所示为从锌镉渣中获得金属镉的工艺流程:
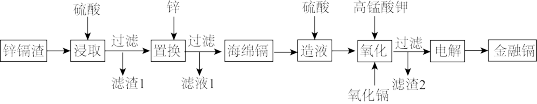
已知:镉(Cd)的金属活动性介于锌、铁之间。下列说法错误的是

已知:镉(Cd)的金属活动性介于锌、铁之间。下列说法错误的是
| A.“浸取”步骤所用的1L0.1mol/L的硫酸中,氧原子的数目大于0.4NA |
| B.“氧化”步骤的目的是将Fe2+氧化为Fe3+,同时将Mn2+氧化为MnO2除去 |
| C.“氧化”步骤加入氧化镉的目的是调pH,除去杂质元素 |
| D.“电解”步骤中,阴极生成11.2g金属镉时,阳极生成气体的体积为1.12L |
您最近一年使用:0次
2021-04-08更新
|
429次组卷
|
3卷引用:陕西省西安市长安区2021届高考第一次模拟考试理综化学试题
陕西省西安市长安区2021届高考第一次模拟考试理综化学试题(已下线)第一章能力提升检测卷-2022年高考化学一轮复习讲练测河南省濮阳市第一高级中学2022-2023学年高三上学期第三次质量检测考试化学试题
单选题
|
适中(0.65)
名校
解题方法
6. 电致变色器件可通过在膜材料内部Li+定向迁移,实现对器件的光透过率进行多级可逆性调节,其工作原理如图。已知:WO3和Li4Fe4[Fe(CN)6]3均为无色透明晶体,LiWO3和Fe4[Fe(CN)6]3均为蓝色晶体。下列有关说法错误的是
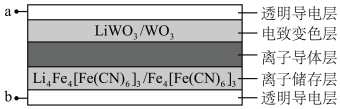

| A.该装置可用于汽车的玻璃变色调光 |
| B.切换电源正负极使得无色变为蓝色时,Li+通过离子导体层由电致变色层向离子储存层迁移 |
| C.当a接外接电源负极时,膜的透射率降低,可以有效阻挡阳光 |
| D.当b接外接电源负极时,离子储存层发生的反应为Fe4[Fe(CN)6]3+4Li++4e-=Li4Fe4[Fe(CN)6]3 |
您最近一年使用:0次
2021-04-08更新
|
253次组卷
|
2卷引用:陕西省西安市长安区2021届高考第一次模拟考试理综化学试题
单选题
|
适中(0.65)
名校
7. 在298K下,“H2A-HA--A2-”的水溶液体系中,H2A、HA-、A2-三种微粒的物质的量分数随溶液pH变化(仅用H2A和NaOH调节pH)的关系如图所示。下列说法正确的是
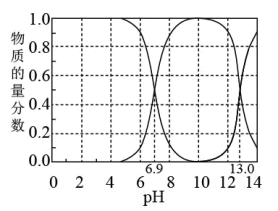

| A.Ka1(H2A)的数量级为10-6 |
| B.在pH=13.0的上述溶液中存在三个平衡 |
C.当体系呈中性时,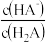 > >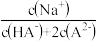 |
| D.NaHA溶液中,c(Na+)>c(HA-)>c(A2-)>c(H2A) |
您最近一年使用:0次
2021-04-08更新
|
220次组卷
|
4卷引用:陕西省西安市长安区2021届高考第一次模拟考试理综化学试题
二、解答题 添加题型下试题
8. 锌灰是热镀锌厂和电解锌厂在生产过程中产生的一种副产品,主要成分为ZnO、ZnCl2,还含有SiO2、CuO、PbO和FeO。工业上利用锌灰制ZnSO4·7H2O晶体,进而获取ZnO,并探索氢电极增压还原氧化锌电解法制锌的方法,工艺流程如图所示:
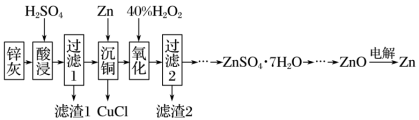
已知:Cu++Cl-=CuCl↓。回答下列问题:
(1)酸浸时,H2SO4应选用____ (填“浓硫酸”或“稀硫酸”)。
(2)滤渣1的主要成分有____ 。
(3)写出“沉铜”时的离子方程式:_____ 。
(4)“氧化”后,加入聚丙烯酰胺絮凝剂并加热搅拌,其目的是___ 。
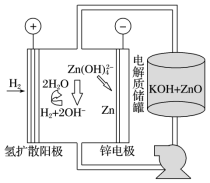
(5)氢电极增压还原氧化锌的装置如图所示,储罐内ZnO溶解后形成Zn(OH) 离子,每溶解1molZnO需消耗
离子,每溶解1molZnO需消耗___ molKOH。电解池中的总反应离子方程式为____ 。
(6)该工艺废水中含有Zn2+,排放前需处理。向废水中加入CH3COOH和CH3COONa组成的缓冲溶液调节pH,通入H2S发生反应:Zn2++H2S⇌ZnS(s)+2H+。处理后的废水中部分微粒浓度为
处理后的废水的pH=____ ,c(Zn2+)=____ 。[已知:Ksp(ZnS)=1.0×10-23,Ka1(H2S)=1.0×10-7,Ka2(H2S)=1.0×10-14,Ka(CH3COOH)=2.0×10-5]

已知:Cu++Cl-=CuCl↓。回答下列问题:
(1)酸浸时,H2SO4应选用
(2)滤渣1的主要成分有
(3)写出“沉铜”时的离子方程式:
(4)“氧化”后,加入聚丙烯酰胺絮凝剂并加热搅拌,其目的是
(5)氢电极增压还原氧化锌的装置如图所示,储罐内ZnO溶解后形成Zn(OH)
 离子,每溶解1molZnO需消耗
离子,每溶解1molZnO需消耗
(6)该工艺废水中含有Zn2+,排放前需处理。向废水中加入CH3COOH和CH3COONa组成的缓冲溶液调节pH,通入H2S发生反应:Zn2++H2S⇌ZnS(s)+2H+。处理后的废水中部分微粒浓度为
| 微粒 | H2S | CH3COOH | CH3COO- |
| 浓度/(mol·L-1) | 0.10 | 0.05 | 0.10 |
处理后的废水的pH=
您最近一年使用:0次
2021-04-08更新
|
413次组卷
|
7卷引用:陕西省西安市长安区2021届高考第一次模拟考试理综化学试题
解答题-实验探究题
|
适中(0.65)
9. 三氯乙醛(CCl3CHO)是生产农药、医药的重要中间体,实验室制备三氯乙醛的反应装置示意图(加热装置未画出)和有关数据如图:
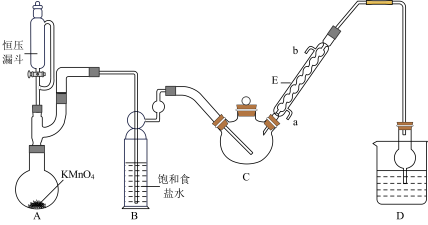
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
②反应过程中C2H5OH和HCl可能会生成副产物C2H5Cl,同时CCl3CHO(三氯乙醛)也能被次氯酸继续氧化生成CCl3COOH(三氯乙酸)
③相关物质的相对分子质量及部分物理性质:
(1)E的作用是__ ,A中所发生反应的离子方程式为____ 。
(2)写出三氯乙醛被次氯酸氧化生成三氯乙酸的化学方程式:____ 。
(3)该设计流程中存在一处缺陷是_______ ,导致引起的后果是____ 。
(4)反应结束后,有人提出先将C中的混合物冷却到室温,再用分液的方法分离出三氯乙酸。你认为此方案是否可行____ (填是或否),原因是____ 。
(5)测定产品纯度:称取产品4.6g配成待测溶液100.00mL,取待测液10.00mL于滴定瓶中,加入0.1000mol•L﹣1碘标准溶液25.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000mol•L﹣1Na2S2O3溶液滴定至终点。进行三次平行实验,测得平均消耗Na2S2O3溶液20.00mL。则产品的纯度为____ (计算结果保留四位有效数字)。滴定原理:CCl3CHO+OH﹣=CHCl3+HCOO-、HCOO-+I2=H++2I﹣+CO2、I2+2 =2I-+
=2I-+

①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
②反应过程中C2H5OH和HCl可能会生成副产物C2H5Cl,同时CCl3CHO(三氯乙醛)也能被次氯酸继续氧化生成CCl3COOH(三氯乙酸)
③相关物质的相对分子质量及部分物理性质:
| 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| C2H5OH | 46 | ﹣114.1 | 78.3 | 与水互溶 |
| CCl3CHO | 147.5 | ﹣57.5 | 97.8 | 可溶于水、乙醇 |
| CCl3COOH | 163.5 | 58 | 198 | 可溶于水、乙醇、三氯乙醛 |
| C2H5Cl | 64.5 | ﹣138.7 | 12.3 | 微溶于水,可溶于乙醇 |
(2)写出三氯乙醛被次氯酸氧化生成三氯乙酸的化学方程式:
(3)该设计流程中存在一处缺陷是
(4)反应结束后,有人提出先将C中的混合物冷却到室温,再用分液的方法分离出三氯乙酸。你认为此方案是否可行
(5)测定产品纯度:称取产品4.6g配成待测溶液100.00mL,取待测液10.00mL于滴定瓶中,加入0.1000mol•L﹣1碘标准溶液25.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000mol•L﹣1Na2S2O3溶液滴定至终点。进行三次平行实验,测得平均消耗Na2S2O3溶液20.00mL。则产品的纯度为
 =2I-+
=2I-+
您最近一年使用:0次
2021-04-08更新
|
335次组卷
|
2卷引用:陕西省西安市长安区2021届高考第一次模拟考试理综化学试题
10. 可逆反应2SO2(g)+O2(g)⇌2SO3(g)是硫酸工业中非常重要的一个反应,因该反应中使用催化剂而被命名为接触法制硫酸。
(1)使用V2O5催化该反应时,涉及催化剂V2O5的能量变化如图1所示:

则2SO2(g)+O2(g)⇌2SO3(g) ΔH3=___ 。
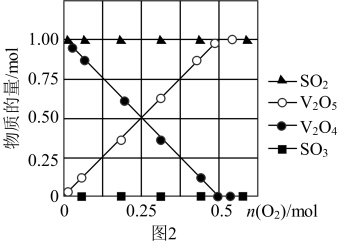
(2)向10L密闭容器中加入V2O4(s)、SO2(g)各1mol及一定量的O2,改变加入O2的量,在常温下反应一段时间后,测得容器中V2O4、V2O5、SO2和SO3的量随反应前加入O2的量的变化如图2所示,图中没有生成SO3的可能原因是___ 。
(3)向体积可变的密闭容器中加入V2O5(s)、SO2(g)各0.6mol、O2(g)0.3mol,此时容器的体积为10L,保持恒压的条件下分别在T1、T2、T3三种温度下进行反应,测得容器中SO2的转化率如图3所示。

①T3温度下反应速率最慢的原因是____ 。
②T2温度时,反应达平衡时容器的体积为_____ L,2SO2(g)+O2(g)⇌2SO3(g)的平衡常数K=_____ 。
③T2时使用V2O5进行反应:2SO2(g)+O2(g)⇌2SO3(g),反应达平衡后增大容器的体积同时再充入一定量的O2(g),在保证O2(g)的浓度不变,平衡___________ (填标号)
A.向正反应方向移动 B.不移动 C.向逆反应方向移动 D.无法确定
(4)近年来,地下水中的氮污染已成为世界性的环境问题。在金属Pt、Cu和依(Ir)的催化作用下,H2可高效转化酸性溶液中的硝态氮( ),其工作原理如图所示。
),其工作原理如图所示。

导电基体上的单原子铜表面发生反应的方程式为___________ 。
(1)使用V2O5催化该反应时,涉及催化剂V2O5的能量变化如图1所示:

则2SO2(g)+O2(g)⇌2SO3(g) ΔH3=
(2)向10L密闭容器中加入V2O4(s)、SO2(g)各1mol及一定量的O2,改变加入O2的量,在常温下反应一段时间后,测得容器中V2O4、V2O5、SO2和SO3的量随反应前加入O2的量的变化如图2所示,图中没有生成SO3的可能原因是

(3)向体积可变的密闭容器中加入V2O5(s)、SO2(g)各0.6mol、O2(g)0.3mol,此时容器的体积为10L,保持恒压的条件下分别在T1、T2、T3三种温度下进行反应,测得容器中SO2的转化率如图3所示。

①T3温度下反应速率最慢的原因是
②T2温度时,反应达平衡时容器的体积为
③T2时使用V2O5进行反应:2SO2(g)+O2(g)⇌2SO3(g),反应达平衡后增大容器的体积同时再充入一定量的O2(g),在保证O2(g)的浓度不变,平衡
A.向正反应方向移动 B.不移动 C.向逆反应方向移动 D.无法确定
(4)近年来,地下水中的氮污染已成为世界性的环境问题。在金属Pt、Cu和依(Ir)的催化作用下,H2可高效转化酸性溶液中的硝态氮(
 ),其工作原理如图所示。
),其工作原理如图所示。
导电基体上的单原子铜表面发生反应的方程式为
您最近一年使用:0次
2021-04-08更新
|
501次组卷
|
6卷引用:陕西省西安市长安区2021届高考第一次模拟考试理综化学试题
解答题-结构与性质
|
适中(0.65)
名校
解题方法
11. 很多过渡金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Fe的基态原子价电子排布式为___________ 。
②Ti的基态原子共有___________ 种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由小到大的顺序是___________ (用元素符号表示)。
②CCl4和COCl2分子中所有原子均满足8电子构型,CCl4和COCl2分子中σ键的个数比为_______ ,COCl2分子的中心原子的杂化方式为_________ 。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,从微观角度解释NiO的熔点高于FeO的原因为___________ 。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
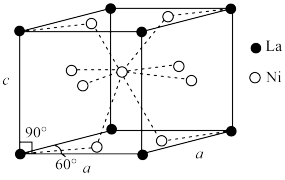
①该晶体的化学式为___________ 。
②已知该晶胞的摩尔质量为Mg·mol-1,密度为dg·cm-3.设NA为阿伏加德罗常数的值,则该晶胞的体积是___________ cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=500pm,c=400pm;标准状况下氢气的密度为9×10-5g·cm-3;储氢能力= 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为___________ 。(NA可近似取6×1023,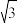 =1.7)
=1.7)
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Fe的基态原子价电子排布式为
②Ti的基态原子共有
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由小到大的顺序是
②CCl4和COCl2分子中所有原子均满足8电子构型,CCl4和COCl2分子中σ键的个数比为
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,从微观角度解释NiO的熔点高于FeO的原因为
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为
②已知该晶胞的摩尔质量为Mg·mol-1,密度为dg·cm-3.设NA为阿伏加德罗常数的值,则该晶胞的体积是
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=500pm,c=400pm;标准状况下氢气的密度为9×10-5g·cm-3;储氢能力=
 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为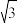 =1.7)
=1.7)
您最近一年使用:0次
2021-04-08更新
|
311次组卷
|
4卷引用:陕西省西安市长安区2021届高考第一次模拟考试理综化学试题
解答题-有机推断题
|
较难(0.4)
名校
12. 一种药物中间体(G)的一种合成路线如下
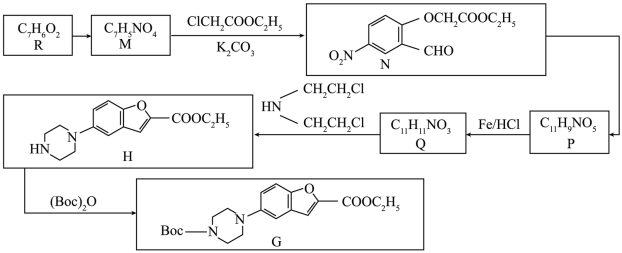
已知: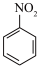

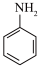
请回答下列问题:
(1)R的名称是___________ ;H中含氧官能团名称是___________ 。
(2)M→N的反应类型是___________ 。H分子式是___________ 。
(3)P的结构简式为___________ 。
(4)写出Q→H的化学方程式:___________ 。
(5)T是与R组成元素种类相同的芳香化合物,满足下列条件的T有___________ 种结构。
①相对分子质量比R多14;②能与金属Na反应放出氢气,但不与NaHCO3反应;③能发生银镜反应。
其中,在核磁共振氢谱上有5组峰且峰的面积比为1:1:2:2:2的结构简式为___________ 。(写出符合题意的一种即可)
(6)以1,5-戊二醇(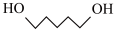 )和硝基苯为原料(其他无机试剂自选)合成
)和硝基苯为原料(其他无机试剂自选)合成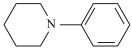 ,设计合成路线:
,设计合成路线:___________ 。

已知:



请回答下列问题:
(1)R的名称是
(2)M→N的反应类型是
(3)P的结构简式为
(4)写出Q→H的化学方程式:
(5)T是与R组成元素种类相同的芳香化合物,满足下列条件的T有
①相对分子质量比R多14;②能与金属Na反应放出氢气,但不与NaHCO3反应;③能发生银镜反应。
其中,在核磁共振氢谱上有5组峰且峰的面积比为1:1:2:2:2的结构简式为
(6)以1,5-戊二醇(
 )和硝基苯为原料(其他无机试剂自选)合成
)和硝基苯为原料(其他无机试剂自选)合成 ,设计合成路线:
,设计合成路线:
您最近一年使用:0次
2021-04-08更新
|
359次组卷
|
4卷引用:陕西省西安市长安区2021届高考第一次模拟考试理综化学试题
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、有机化学基础、化学与STSE、化学反应原理、物质结构与性质、认识化学科学、化学实验基础
试卷题型(共 12题)
题型
数量
单选题
7
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 次氯酸及其性质 明矾的净水作用及原理 常用合成高分子材料的化学成分 纯碱的生产 | |
| 2 | 0.65 | 苯的同系物使高锰酸钾褪色的机理 醇类的化学性质 酯的化学性质 多官能团有机物的结构与性质 | |
| 3 | 0.65 | 浓度对化学反应速率的影响 沉淀转化 溴乙烷的消去反应 蔗糖水解相关实验 | |
| 4 | 0.65 | 微粒半径大小的比较方法 根据原子结构进行元素种类推断 “位构性”关系理解及应用 | |
| 5 | 0.65 | 22.4L/mol适用条件 Fe2+的还原性 物质分离、提纯的常见化学方法 常见无机物的制备 | |
| 6 | 0.65 | 电解原理的理解及判断 电解池电解基本判断 电解池电极反应式及化学方程式的书写与判断 | |
| 7 | 0.65 | 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 盐类水解在解题方面的应用 弱电解质的电离平衡常数 | |
| 二、解答题 | |||
| 8 | 0.65 | 溶度积常数相关计算 电解池电极反应式及化学方程式的书写与判断 物质分离、提纯综合应用 物质制备的探究 | 工业流程题 |
| 9 | 0.65 | 氯气的实验室制法 常见有机物的制备 探究物质组成或测量物质的含量 物质制备的探究 | 实验探究题 |
| 10 | 0.4 | 盖斯定律与热化学方程式 等效平衡理论的综合应用 化学平衡常数的有关计算 与转化率变化有关图像的分析 | 原理综合题 |
| 11 | 0.65 | 元素性质与电负性的关系 利用杂化轨道理论判断化学键杂化类型 根据晶胞结构确定晶体化学式 晶胞的有关计算 | 结构与性质 |
| 12 | 0.4 | 同分异构体的数目的确定 逆合成分析法 根据题给物质选择合适合成路线 有机推断综合考查 | 有机推断题 |



