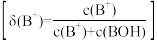在298K下,“H2A-HA--A2-”的水溶液体系中,H2A、HA-、A2-三种微粒的物质的量分数随溶液pH变化(仅用H2A和NaOH调节pH)的关系如图所示。下列说法正确的是
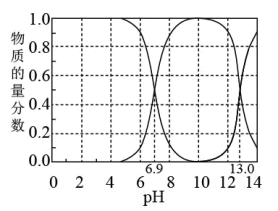

| A.Ka1(H2A)的数量级为10-6 |
| B.在pH=13.0的上述溶液中存在三个平衡 |
C.当体系呈中性时,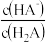 > >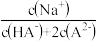 |
| D.NaHA溶液中,c(Na+)>c(HA-)>c(A2-)>c(H2A) |
更新时间:2021-04-08 08:57:15
|
相似题推荐
单选题
|
适中
(0.65)
解题方法
【推荐1】已知NaHC2O4溶液显弱酸性,向100 mL0.1mol/L的NaHC2O4溶液中分别加入下列物质,有关说法正确的是( )
| A.加入少量H2C2O4固体,促进水电离,溶液中c(H+)增大 |
| B.加入NaOH溶液至恰好完全反应,则溶液中:c(Na+)>c(C2O42-)>c(HC2O4-)>c(OH-) |
| C.加入氨水至中性,则溶液中:c(NH4+) + c(Na+)=2c(C2O42-) + c(HC2O4-) |
| D.加入0.01 mol Na2C2O4固体,则溶液中:3c(Na+)=2[c(H2C2O4) + c(HC2O4-) + c(C2O42-)] |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】在25 ℃条件下,下列说法正确的是
| A.100mL 0.1mol/LCH3COONa溶液中,c(Na+)+c(H+)=c(CH3COO- ) |
| B.向水中加入少量固体硫酸氢钠(不考虑温度变化),溶液中c(H+)增大,Kw不变 |
C.向0.1mol/L  溶液中加入少量的水,溶液中 溶液中加入少量的水,溶液中 减小 减小 |
D. 的HA溶液与 的HA溶液与 的NaOH溶液等体积混合,所得溶液pH一定等于7.0 的NaOH溶液等体积混合,所得溶液pH一定等于7.0 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】常温下,向20.00mL0.1000mol/L(NH4)2SO4溶液中逐滴加入0.2000mol/LNaOH溶液时,溶液的pH 与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。下列说法正确的是
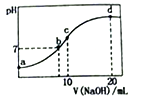

| A.点a所示溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+) |
| B.点b所示溶液中: c(NH4+)=c(Na+)> c(H+)= c(OH-) |
| C.点c所示溶液中:c(NH3·H2O) + c(OH-)= c(H+)+ c(SO42-) |
| D.点d所示溶液中: c(SO42-)> c(NH3·H2O)> c(OH-)> c(NH4+) |
您最近一年使用:0次
【推荐1】下列说法正确的是
| A.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
B.一定条件下反应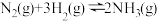 ,当 ,当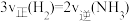 ,则反应达到平衡 ,则反应达到平衡 |
C.向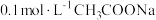 溶液中加入少量水,溶液中 溶液中加入少量水,溶液中 减小 减小 |
D.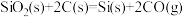 在常温下不能自发进行,则该反应的 在常温下不能自发进行,则该反应的 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】已知HF是一种弱酸,则等体积等浓度的KOH溶液和HF溶液混合后,混合液中有关离子的浓度应满足的关系是
| A.c(K+)> c(OH-) > c(F-)> c(H+) | B.c(K+)> c(F-)> c(H+) > c(OH-) |
| C.c(K+)> c(F-)> c(OH-) > c(H+) | D.c(K+)> c(H+) = c(OH-) > c(F-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】常温下,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中:Fe2+、NO 、SO 、SO 、Na+ 、Na+ |
B.c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、CO 、Cl- 、Cl- |
C.c(H+)/c(OH-)=1012的溶液中:NH 、Al3+、NO 、Al3+、NO 、Cl- 、Cl- |
D.由水电离的c(H+)=1×10-14mol/L的溶液中:Ca2+、K+、Cl-、HCO |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】等物质的量浓度、等体积的下列溶液中:①H2CO3;②Na2CO3;③NaHCO3;④NH4HCO3;⑤(NH4)2CO3,下列关系或者说法不正确的是
| A.③④⑤既能与盐酸反应,又能与NaOH溶液反应 |
| B.将溶液蒸干灼烧只有②能得到对应的固体物质 |
C.c( )的大小关系为④>③>⑤>②>① )的大小关系为④>③>⑤>②>① |
D.c( )的大小关系为②>⑤>③>④>① )的大小关系为②>⑤>③>④>① |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
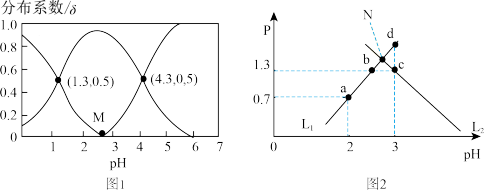
【推荐1】常温下,0.1mol·L-1H2R 溶液中H2R、HR-、R2-三者所占物质的量分数(分布系数δ )随pH变化的关系如图1所示,向0.1mol·L-1Na2R溶液中滴加稀盐酸,所得混合溶液的pH与P[P=lg 或lg
或lg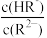 ]变化关系如图2所示。下列说法正确的是
]变化关系如图2所示。下列说法正确的是
 或lg
或lg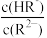 ]变化关系如图2所示。下列说法正确的是
]变化关系如图2所示。下列说法正确的是 
A.图1中M点即为图2中N点,反应H2R+R2- 2HR-的平衡常数K=100 2HR-的平衡常数K=100 |
| B.水的电离程度c=d>b> a |
| C.d点时,3c (HR-) -c (OH- ) <c (Cl-) -c (H+) |
D.曲线L1表示lg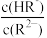 随pH的变化 随pH的变化 |
您最近一年使用:0次
单选题
|
适中
(0.65)
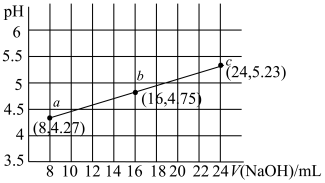
【推荐2】用强碱滴定某一元弱酸时,弱酸被强碱部分中和后得到“弱酸盐和弱酸”组成的缓冲溶液,其中存在 ,用
,用 的
的 溶液滴定
溶液滴定 浓度为
浓度为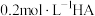 溶液,滴定过程中消耗
溶液,滴定过程中消耗 溶液的体积与混合溶液
溶液的体积与混合溶液 之间的关系如图所示(已知:
之间的关系如图所示(已知: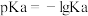 ,
,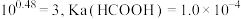 )。下列说法正确的是
)。下列说法正确的是
 ,用
,用 的
的 溶液滴定
溶液滴定 浓度为
浓度为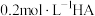 溶液,滴定过程中消耗
溶液,滴定过程中消耗 溶液的体积与混合溶液
溶液的体积与混合溶液 之间的关系如图所示(已知:
之间的关系如图所示(已知: ,
,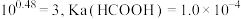 )。下列说法正确的是
)。下列说法正确的是
A. 的电离平衡常数 的电离平衡常数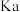 约为 约为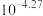 |
B.b点溶液中存在 |
C.c点溶液中离子浓度的大小关系为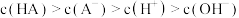 |
D.若将 改为等体积等浓度的 改为等体积等浓度的 ,则 ,则 随 随 溶液体积的变化曲线竖直上移 溶液体积的变化曲线竖直上移 |
您最近一年使用:0次

 、Cu2+、Cl-
、Cu2+、Cl- 、Fe3+、
、Fe3+、 、Cl-、Na+
、Cl-、Na+