1 . 钨(W)广泛用于国防军事、航空航天、信息制造等领域。实验室以硬质合金废料(含WC、Fe和少量C、Co)为原料制备炼钨中间体 ,并提取有价金属的一种工艺流程如图所示:
,并提取有价金属的一种工艺流程如图所示:
回答下列问题:
(1)“酸浸”的目的为___________ ;“沉铁”时调节pH的范围为___________ ;“还原”反应同时生成一种参与大气循环的气体,该离子方程式为___________ 。
(2)其他条件相同时,“焙烧”过程中 流速与钨氧化率的关系如图所示,其中
流速与钨氧化率的关系如图所示,其中 流速大于0.15 m3/h时钨氧化率降低的原因为
流速大于0.15 m3/h时钨氧化率降低的原因为___________ 。 ,其原因为
,其原因为___________ 。
(4)“酸浸”工序可用电解法代替。则进行电解时,WC进入___________ (填“阳极泥”或“阴极泥”)。
(5)尾气1与尾气3的反应是汽车尾气处理的原理之一,该反应的化学方程式为___________ 。
(6) 、
、 ,
, 、
、 ,NaOH,Co中,熔点主要取决于氢键的是
,NaOH,Co中,熔点主要取决于氢键的是___________ ;H、O、Cl、Co的电负性由大到小的顺序为___________ 。
 ,并提取有价金属的一种工艺流程如图所示:
,并提取有价金属的一种工艺流程如图所示: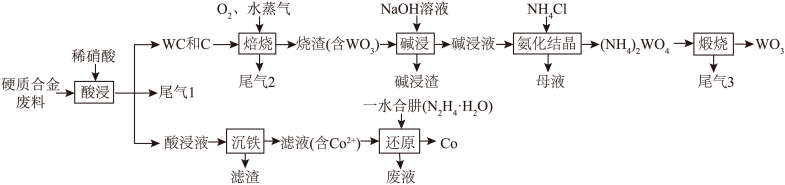
| 金属离子 |  |  |  |  |
| 开始沉定pH | 0.2 | 1.5 | 6.5 | 7.0 |
| 沉淀完全pH | 1.1 | 4.1 | 9.7 | 9.2 |
(1)“酸浸”的目的为
(2)其他条件相同时,“焙烧”过程中
 流速与钨氧化率的关系如图所示,其中
流速与钨氧化率的关系如图所示,其中 流速大于0.15 m3/h时钨氧化率降低的原因为
流速大于0.15 m3/h时钨氧化率降低的原因为
 ,其原因为
,其原因为(4)“酸浸”工序可用电解法代替。则进行电解时,WC进入
(5)尾气1与尾气3的反应是汽车尾气处理的原理之一,该反应的化学方程式为
(6)
 、
、 ,
, 、
、 ,NaOH,Co中,熔点主要取决于氢键的是
,NaOH,Co中,熔点主要取决于氢键的是
您最近一年使用:0次
名校
2 . 中国有广阔的海岸线,建设发展海洋经济、海水的综合利用大有可为。
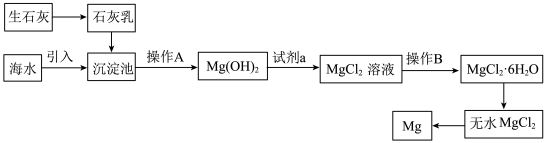
Ⅰ.目前世界上60%的镁是从海水中提取的,海水提镁的主要流程如下:__________ 。
(2)工业冶炼金属 的化学方程式为
的化学方程式为__________ 。
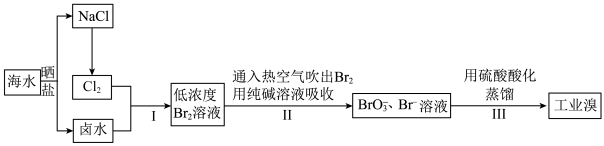
Ⅱ.空气吹出法工艺,是目前“海水提溴”的最主要方法之一,其工艺流程如下图所示,试回答下列问题: ”,这样进行转化的目的是
”,这样进行转化的目的是__________ 。
(4)步骤Ⅱ通入热空气或水蒸气吹出 ,利用了溴的__________(填序号)。
,利用了溴的__________(填序号)。
(5)写出步骤Ⅱ中涉及的离子反应__________ 。
Ⅲ.最近,科学家开发了一种用二氧化碳淡化海水的技术,其循环图如下: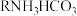 中H、C、N、O四种元素的电负性
中H、C、N、O四种元素的电负性由大到小 的顺序为__________ 。
Ⅰ.目前世界上60%的镁是从海水中提取的,海水提镁的主要流程如下:
(2)工业冶炼金属
 的化学方程式为
的化学方程式为Ⅱ.空气吹出法工艺,是目前“海水提溴”的最主要方法之一,其工艺流程如下图所示,试回答下列问题:
 ”,这样进行转化的目的是
”,这样进行转化的目的是(4)步骤Ⅱ通入热空气或水蒸气吹出
 ,利用了溴的__________(填序号)。
,利用了溴的__________(填序号)。| A.氧化性 | B.还原性 | C.挥发性 | D.腐蚀性 |
(5)写出步骤Ⅱ中涉及的离子反应
Ⅲ.最近,科学家开发了一种用二氧化碳淡化海水的技术,其循环图如下:

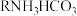 中H、C、N、O四种元素的电负性
中H、C、N、O四种元素的电负性
您最近一年使用:0次
名校
3 . 铬酸铅(PbCrO4)是黄色涂料“铬黄”的主要成分,实验室由某合金废料(主要成分为Fe、C、Cr2O3)制备PbCrO4的流程如图:
回答下列问题:
(1)基态82Pb2+的价层电子排布图为_______ 。
(2)“酸浸”时,加热可以加快反应速率,但温度不宜过高的原因是_______ (用化学方程式解释)。
(3)“滤渣2”中电负性最大的元素是_______ (填元素符号)。
(4)“氧化”时发生反应的离子方程式为_______ 。
(5)“调节pH=6”的目的是_______ 。
(6)二卤化铅(PbX2)是一类重要的含铅化合物,其熔点如下表所示:
①结合PbX2的熔点变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性_______ (填“增强”“不变”或“减弱”,后同)、共价性_______ 。
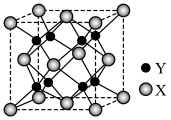
②PbF2的立方晶胞如图所示,其中X代表的离子是_______ (填离子符号);若该晶胞参数为anm,则正、负离子的最小核间距为_______ pm。
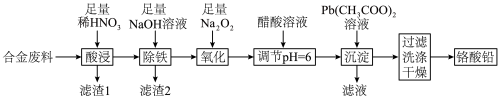
回答下列问题:
(1)基态82Pb2+的价层电子排布图为
(2)“酸浸”时,加热可以加快反应速率,但温度不宜过高的原因是
(3)“滤渣2”中电负性最大的元素是
(4)“氧化”时发生反应的离子方程式为
(5)“调节pH=6”的目的是
(6)二卤化铅(PbX2)是一类重要的含铅化合物,其熔点如下表所示:
| 二卤化铅 | PbF2 | PbCl2 | PbBr2 | PbI2 |
| 熔点/℃ | 824 | 501 | 373 | 402 |
②PbF2的立方晶胞如图所示,其中X代表的离子是
您最近一年使用:0次
2024-05-12更新
|
140次组卷
|
2卷引用:云南省昆明市云南师范大学附属中学2023-2024学年高三下学期适应性月考(九)理综试卷-高中化学
解题方法
4 . 以电解铝废渣(主要含 、
、 、
、 、
、 )为原料,制备电池级碳酸锂的工艺流程如图:
)为原料,制备电池级碳酸锂的工艺流程如图:

已知: 、
、 难溶于水,
难溶于水, 溶于水,
溶于水, 微溶于水,
微溶于水, 、
、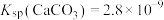 。
。
回答下列问题:
(1)基态Al原子核外电子有__________ 种不同的空间运动状态,Al原子的第一电离能低于Mg,原因是__________ 。
(2)电解氧化铝生成铝的化学方程式为__________ ,无碳电解铝技术是利用陶瓷材料替代碳作阳极,该技术的优点之一是__________ 。
(3)“气体1”是__________ (填化学式,下同),“滤渣1”的主要成分是__________ 。
(4)已知“碱解”同时生成白色沉淀,写出生成“气体2”的离子方程式:__________ 。
(5)“苛化”中存在如下反应: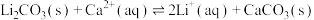 。通过计算解释生石灰能使
。通过计算解释生石灰能使 完全转化的原因:
完全转化的原因:__________ 。
(6)已知 可形成共价分子,
可形成共价分子, 为离子晶体,从电负性的角度解释其原因:
为离子晶体,从电负性的角度解释其原因:__________ 。
 、
、 、
、 、
、 )为原料,制备电池级碳酸锂的工艺流程如图:
)为原料,制备电池级碳酸锂的工艺流程如图:
已知:
 、
、 难溶于水,
难溶于水, 溶于水,
溶于水, 微溶于水,
微溶于水, 、
、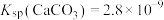 。
。回答下列问题:
(1)基态Al原子核外电子有
(2)电解氧化铝生成铝的化学方程式为
(3)“气体1”是
(4)已知“碱解”同时生成白色沉淀,写出生成“气体2”的离子方程式:
(5)“苛化”中存在如下反应:
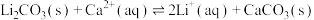 。通过计算解释生石灰能使
。通过计算解释生石灰能使 完全转化的原因:
完全转化的原因:(6)已知
 可形成共价分子,
可形成共价分子, 为离子晶体,从电负性的角度解释其原因:
为离子晶体,从电负性的角度解释其原因:
您最近一年使用:0次
5 . 一种从废钼钴催化剂中回收有价金属的工艺流程如图甲所示:
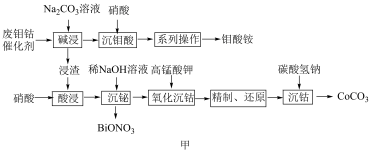
已知:I.废钼钴催化剂的主要成分如表。
II.“酸浸”所得溶液中主要含有H+、Bi3+、Co2+等阳离子。
回答下列问题:
(1)钼酸铵 中Mo元素的化合价为
中Mo元素的化合价为_______ ,其所含非金属元素的电负性由大到小排序为_______ 。
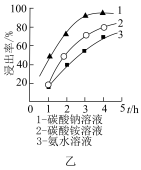
(2)“碱浸”时需在75℃条件下进行反应,且选择不同碱性试剂钼元素的浸出率随时间变化如图乙所示。则“碱浸”时的最佳条件为_______ 。
(3)“沉钼酸”时,一般控制反应温度为60℃,温度不宜太高的原因为_______ 。
(4)“沉铋”时,反应的离子方程式为_______ 。
(5)“氧化沉钴”时调节溶液 ,反应生成
,反应生成 和
和 ,其离子方程式为
,其离子方程式为_______ 。
(6)若通过该流程处理1kg废钼钴催化剂,得到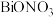 的质量为0.1435kg,则Bi元素的回收率最接近
的质量为0.1435kg,则Bi元素的回收率最接近_____ (填标号)(Bi元素的回收率 )。
)。
A.70% B.80% C.90%

已知:I.废钼钴催化剂的主要成分如表。
| 主要成分 |  |  |  |
| 质量分数 | 44.61% | 6.67% | 13.98% |
回答下列问题:
(1)钼酸铵
 中Mo元素的化合价为
中Mo元素的化合价为(2)“碱浸”时需在75℃条件下进行反应,且选择不同碱性试剂钼元素的浸出率随时间变化如图乙所示。则“碱浸”时的最佳条件为

(3)“沉钼酸”时,一般控制反应温度为60℃,温度不宜太高的原因为
(4)“沉铋”时,反应的离子方程式为
(5)“氧化沉钴”时调节溶液
 ,反应生成
,反应生成 和
和 ,其离子方程式为
,其离子方程式为(6)若通过该流程处理1kg废钼钴催化剂,得到
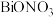 的质量为0.1435kg,则Bi元素的回收率最接近
的质量为0.1435kg,则Bi元素的回收率最接近 )。
)。A.70% B.80% C.90%
您最近一年使用:0次
6 . 铍的氧化物广泛应用于原子能、航天、电子、陶瓷等领域,是重要的战略物资。利用绿柱石(主要化学成分为(Be3Al2Si6O18,还含有一定量的FeO和Fe2O3)生产BeO的一种工艺流程如下。
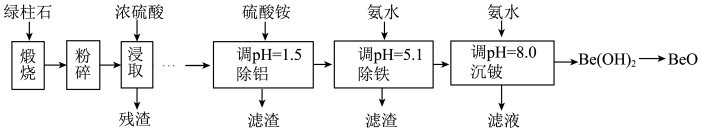
回答问题:
(1)Be3Al2Si6O18中Be的化合价为______ 。Si原子价层电子排布式为_______ 。元素Al与Si中,第一电离能较大的是_______ ,氮原子和氧原子电负性较大的是______ 。
(2)浓硫酸浸取后残渣主要成分是_______ (填化学式)。
(3)该流程中能循环使用的物质是______ (填化学式)。
(4)无水BeCl2可用作聚合反应的催化剂。BeO、Cl2与足量C在600~800℃制备BeCl2的化学方程式为______ 。
(5)沉铍时,将pH从8.0提高到9.0,则铍的损失降低至原来的______ %。

回答问题:
(1)Be3Al2Si6O18中Be的化合价为
(2)浓硫酸浸取后残渣主要成分是
(3)该流程中能循环使用的物质是
(4)无水BeCl2可用作聚合反应的催化剂。BeO、Cl2与足量C在600~800℃制备BeCl2的化学方程式为
(5)沉铍时,将pH从8.0提高到9.0,则铍的损失降低至原来的
您最近一年使用:0次
名校
解题方法
7 . 从废旧锂离子二次电池(主要成分为 ,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:
,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:

回答下列问题:
(1)“碱浸”的目的是_______ 。
(2)“酸浸”过程中 发生反应的离子方程式为:
发生反应的离子方程式为:_______ 。
(3)“萃取分离”中钴、锂萃取率与平衡pH关系如图所示,为使分离率最高,pH一般选择约在_______ 。

(4)若“沉锂”中 ,加入等体积等浓度
,加入等体积等浓度 溶液,此时实验所得沉锂率为
溶液,此时实验所得沉锂率为_______ 。(已知 的
的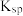 为
为 )
)
(5)化学电池在各行各业都得到了广泛应用,其发展对调整能源结构,实现低碳经济有着重要意义、通过下列反应可以制备某电池正极的活性物质 。
。
请回答下列问题:
①上述反应中涉及的N、O、P元素电负性由小到大的顺序是_______ 。
②基态 原子的价电子排布式为
原子的价电子排布式为_______ 。
③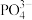 的立体构型为
的立体构型为_______ ,其中P原子的杂化方式是_______ 。
 ,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:
,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:
回答下列问题:
(1)“碱浸”的目的是
(2)“酸浸”过程中
 发生反应的离子方程式为:
发生反应的离子方程式为:(3)“萃取分离”中钴、锂萃取率与平衡pH关系如图所示,为使分离率最高,pH一般选择约在

(4)若“沉锂”中
 ,加入等体积等浓度
,加入等体积等浓度 溶液,此时实验所得沉锂率为
溶液,此时实验所得沉锂率为 的
的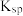 为
为 )
)(5)化学电池在各行各业都得到了广泛应用,其发展对调整能源结构,实现低碳经济有着重要意义、通过下列反应可以制备某电池正极的活性物质
 。
。
请回答下列问题:
①上述反应中涉及的N、O、P元素电负性由小到大的顺序是
②基态
 原子的价电子排布式为
原子的价电子排布式为③
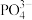 的立体构型为
的立体构型为
您最近一年使用:0次
名校
8 . 硼氢化钠(NaBH4)是有机合成中常用的还原剂。一种制备硼氢化钠的工艺如下(部分条件和产物省略):

已知: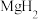 、
、 遇水蒸气剧烈反应并放出
遇水蒸气剧烈反应并放出 。
。
回答下列问题:
(1)下列硼原子电子排布图表示的状态中,能量最低和最高的分别为___________ 、___________ (填标号)。
A. B.
B.
C. D.
D.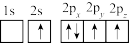
(2)难溶的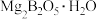 与浓氢氧化钠溶液反应的离子方程式为
与浓氢氧化钠溶液反应的离子方程式为___________ 。
(3)已知 溶于水能产生两种气体,其中一种气体能使品红溶液褪色,则灼烧
溶于水能产生两种气体,其中一种气体能使品红溶液褪色,则灼烧 时加入
时加入 的目的是
的目的是___________ 。
(4)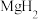 和
和 必须在干燥条件下合成
必须在干燥条件下合成 ,其原因是
,其原因是___________ ,二者反应生成 的化学方程式为
的化学方程式为___________ 。
(5) 的电子式为
的电子式为___________ 。其中三种元素的电负性由大到小的顺序是___________ 。其中 的立体构型为
的立体构型为___________ 。

已知:
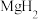 、
、 遇水蒸气剧烈反应并放出
遇水蒸气剧烈反应并放出 。
。回答下列问题:
(1)下列硼原子电子排布图表示的状态中,能量最低和最高的分别为
A.
 B.
B.
C.
 D.
D.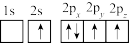
(2)难溶的
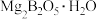 与浓氢氧化钠溶液反应的离子方程式为
与浓氢氧化钠溶液反应的离子方程式为(3)已知
 溶于水能产生两种气体,其中一种气体能使品红溶液褪色,则灼烧
溶于水能产生两种气体,其中一种气体能使品红溶液褪色,则灼烧 时加入
时加入 的目的是
的目的是(4)
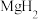 和
和 必须在干燥条件下合成
必须在干燥条件下合成 ,其原因是
,其原因是 的化学方程式为
的化学方程式为(5)
 的电子式为
的电子式为 的立体构型为
的立体构型为
您最近一年使用:0次
2022-01-28更新
|
131次组卷
|
2卷引用:四川省泸州市泸县第四中学2023-2024学年高二下学期开学化学试题



