名校
1 . 甲硫醇( )是重要的有机化工中间体,可用于合成维生素。通过
)是重要的有机化工中间体,可用于合成维生素。通过 和
和 合成
合成 的主要反应为:
的主要反应为:
I.
Ⅱ.
回答下列问题:
(1)计算反应 的
的
_______ kJ/mol。
(2) ℃时,向恒容密闭容器中充入一定量
℃时,向恒容密闭容器中充入一定量 和
和 发生反应,下列事实能说明反应达到平衡状态的是_______(填选项字母)。
发生反应,下列事实能说明反应达到平衡状态的是_______(填选项字母)。
(3) ℃时,向压强为
℃时,向压强为 的恒压密闭容器中按物质的量之比为1:2充入
的恒压密闭容器中按物质的量之比为1:2充入 和
和 发生反应,达到平衡时,
发生反应,达到平衡时, 的转化率为80%,
的转化率为80%, 的体积分数为5%。
的体积分数为5%。
①计算 的选择性为
的选择性为_______ ( 的选择性=
的选择性= )。
)。
②反应I的平衡常数 =
=_______ ( 是用分压表示的平衡常数,结果保留两位小数)。
是用分压表示的平衡常数,结果保留两位小数)。
(4)在 反应压力为0.7Mpa条件下,气体按90mL/min的速率通过催化剂表面发生反应,每分钟反应体系中
反应压力为0.7Mpa条件下,气体按90mL/min的速率通过催化剂表面发生反应,每分钟反应体系中 转化率、
转化率、 选择性随温度的变化如图甲所示,催化机理如图乙所示。
选择性随温度的变化如图甲所示,催化机理如图乙所示。 分压表示的反应速率为
分压表示的反应速率为_______ Mpa/min(结果保留两位有效数字)。
②当温度高于370℃时, 转化率随温度升高而降低的原因可能为
转化率随温度升高而降低的原因可能为_______ 。
③从电负性的角度描述ⅲ→i中脱水的过程:_______ 。
 )是重要的有机化工中间体,可用于合成维生素。通过
)是重要的有机化工中间体,可用于合成维生素。通过 和
和 合成
合成 的主要反应为:
的主要反应为:I.

Ⅱ.

回答下列问题:
(1)计算反应
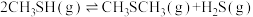 的
的
(2)
 ℃时,向恒容密闭容器中充入一定量
℃时,向恒容密闭容器中充入一定量 和
和 发生反应,下列事实能说明反应达到平衡状态的是_______(填选项字母)。
发生反应,下列事实能说明反应达到平衡状态的是_______(填选项字母)。| A.容器内气体密度不再发生变化 |
| B.混合气体的平均相对分子质量不再发生变化 |
C. 的体积分数不再发生变化 的体积分数不再发生变化 |
D. 和 和 的物质的量之比不再变化 的物质的量之比不再变化 |
(3)
 ℃时,向压强为
℃时,向压强为 的恒压密闭容器中按物质的量之比为1:2充入
的恒压密闭容器中按物质的量之比为1:2充入 和
和 发生反应,达到平衡时,
发生反应,达到平衡时, 的转化率为80%,
的转化率为80%, 的体积分数为5%。
的体积分数为5%。①计算
 的选择性为
的选择性为 的选择性=
的选择性= )。
)。②反应I的平衡常数
 =
= 是用分压表示的平衡常数,结果保留两位小数)。
是用分压表示的平衡常数,结果保留两位小数)。(4)在
 反应压力为0.7Mpa条件下,气体按90mL/min的速率通过催化剂表面发生反应,每分钟反应体系中
反应压力为0.7Mpa条件下,气体按90mL/min的速率通过催化剂表面发生反应,每分钟反应体系中 转化率、
转化率、 选择性随温度的变化如图甲所示,催化机理如图乙所示。
选择性随温度的变化如图甲所示,催化机理如图乙所示。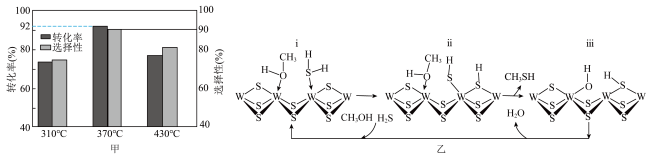
 分压表示的反应速率为
分压表示的反应速率为②当温度高于370℃时,
 转化率随温度升高而降低的原因可能为
转化率随温度升高而降低的原因可能为③从电负性的角度描述ⅲ→i中脱水的过程:
您最近一年使用:0次
解题方法
2 . 氢气是重要的资源,可通过多种途径制备得到。
(1)氨硼烷( )在催化剂的作用下与水反应释放
)在催化剂的作用下与水反应释放 并生成
并生成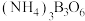 。
。
①氨硼烷分子中所有原子均达到稳定结构,其电子式为_______ 。
②已知 含有
含有 、
、 相间的六元环的结构(环上含有6个原子),
相间的六元环的结构(环上含有6个原子), 原子采取
原子采取 杂化,
杂化, 的结构式可表示为
的结构式可表示为_______ 。
(2) 的强碱溶液在
的强碱溶液在 改性的
改性的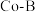 催化剂作用下与水反应生成
催化剂作用下与水反应生成 的部分反应机理如图所示。
的部分反应机理如图所示。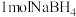 与
与 反应最多产生
反应最多产生 的物质的量为
的物质的量为_______ 。
②若用 代替
代替 ,步骤2中生成气体的化学式为
,步骤2中生成气体的化学式为_______ 。
(3)在密闭容器中,通过铁粉与 溶液反应可以制得
溶液反应可以制得 和
和 。活性
。活性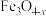 是
是 转化为
转化为 的催化剂,其可能反应机理如图所示:
的催化剂,其可能反应机理如图所示: 酸性强于
酸性强于 的原因是
的原因是_______ 。
②根据元素电负性的变化规律,图中所示的反应步骤Ⅰ可描述为_______ 。
(1)氨硼烷(
 )在催化剂的作用下与水反应释放
)在催化剂的作用下与水反应释放 并生成
并生成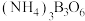 。
。①氨硼烷分子中所有原子均达到稳定结构,其电子式为
②已知
 含有
含有 、
、 相间的六元环的结构(环上含有6个原子),
相间的六元环的结构(环上含有6个原子), 原子采取
原子采取 杂化,
杂化, 的结构式可表示为
的结构式可表示为(2)
 的强碱溶液在
的强碱溶液在 改性的
改性的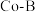 催化剂作用下与水反应生成
催化剂作用下与水反应生成 的部分反应机理如图所示。
的部分反应机理如图所示。
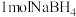 与
与 反应最多产生
反应最多产生 的物质的量为
的物质的量为②若用
 代替
代替 ,步骤2中生成气体的化学式为
,步骤2中生成气体的化学式为(3)在密闭容器中,通过铁粉与
 溶液反应可以制得
溶液反应可以制得 和
和 。活性
。活性 是
是 转化为
转化为 的催化剂,其可能反应机理如图所示:
的催化剂,其可能反应机理如图所示: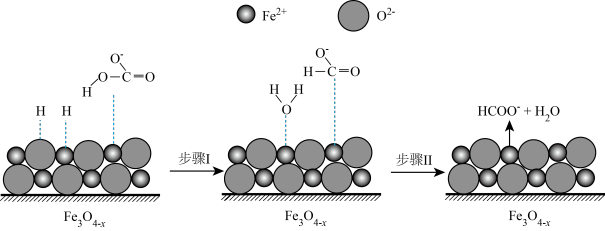
 酸性强于
酸性强于 的原因是
的原因是②根据元素电负性的变化规律,图中所示的反应步骤Ⅰ可描述为
您最近一年使用:0次
3 . 单团簇催化剂(SCCs)是指由多个金属原子组成的亚纳米小颗粒,对其结构、性能、应用的研究具有广阔的前景。
(1)某SCCs的结构如下:
反应i.2NO(g)+2H2(g) N2(g)+2H2O(g)
N2(g)+2H2O(g)  kJ·mol-1;
kJ·mol-1;
反应ii.2NO(g)+5H2(g) 2NH3(g)+2H2O(g)
2NH3(g)+2H2O(g)  kJ·mol-1。
kJ·mol-1。
则NH3(g)
 N2(g)+
N2(g)+ H2(g)
H2(g)  =
=________ kJ·mol-1。
(3)在 ℃、100 kPa反应条件下,向密闭容器中充入2 mol NO和6 mol H2发生上述反应i和ii,测得含氮元素物质占比[例如
℃、100 kPa反应条件下,向密闭容器中充入2 mol NO和6 mol H2发生上述反应i和ii,测得含氮元素物质占比[例如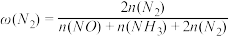 ×100%]与时间的关系如图所示。已知:反应ii为快反应,其平衡的建立可认为不受慢反应i的影响,即可认为反应ⅱ建立平衡后始终处于平衡状态。
×100%]与时间的关系如图所示。已知:反应ii为快反应,其平衡的建立可认为不受慢反应i的影响,即可认为反应ⅱ建立平衡后始终处于平衡状态。________ 、____ 。(填“ ”“
”“ ”或“
”或“ ”)
”)
②若选择对反应ii催化效果更好的催化剂,则A点可能移向________ (填“E”“E点上方”或“E点下方”)。
③已知C点、D点均为平衡点,则反应i的平衡常数 =
=____ kPa-1(列出计算式即可,平衡时分压代替平衡浓度)。
(1)某SCCs的结构如下:
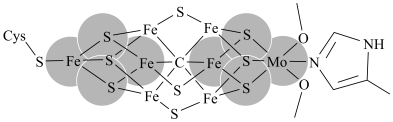
Cys的结构简式为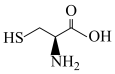 ,其组成元素中电负性从大到小依次是
,其组成元素中电负性从大到小依次是
反应i.2NO(g)+2H2(g)
 N2(g)+2H2O(g)
N2(g)+2H2O(g)  kJ·mol-1;
kJ·mol-1;反应ii.2NO(g)+5H2(g)
 2NH3(g)+2H2O(g)
2NH3(g)+2H2O(g)  kJ·mol-1。
kJ·mol-1。则NH3(g)

 N2(g)+
N2(g)+ H2(g)
H2(g)  =
=(3)在
 ℃、100 kPa反应条件下,向密闭容器中充入2 mol NO和6 mol H2发生上述反应i和ii,测得含氮元素物质占比[例如
℃、100 kPa反应条件下,向密闭容器中充入2 mol NO和6 mol H2发生上述反应i和ii,测得含氮元素物质占比[例如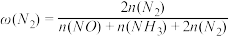 ×100%]与时间的关系如图所示。已知:反应ii为快反应,其平衡的建立可认为不受慢反应i的影响,即可认为反应ⅱ建立平衡后始终处于平衡状态。
×100%]与时间的关系如图所示。已知:反应ii为快反应,其平衡的建立可认为不受慢反应i的影响,即可认为反应ⅱ建立平衡后始终处于平衡状态。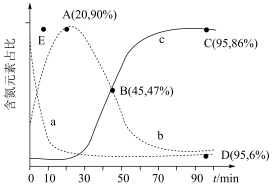
 ”“
”“ ”或“
”或“ ”)
”)②若选择对反应ii催化效果更好的催化剂,则A点可能移向
③已知C点、D点均为平衡点,则反应i的平衡常数
 =
=
您最近一年使用:0次
名校
4 . 钠、镁、铝、铜及其化合物在生活中具有重要作用。回答下列问题:
(1)基态 的价层轨道表示式为
的价层轨道表示式为________ 。
(2)Na、Mg、Al的第一电离能从小到大的顺序为_______ (填元素符号)。
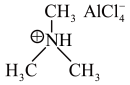
(3)铝离子电池一般采用离子液体作为电解质,某含铝离子液体的结构如图:_______ ;传统的有机溶剂大多易挥发,而离子液体相对难挥发,原因是________ 。
(4)几种氧化物的化学键中离子键成分的百分数和氧化物的熔点如下表:
离子键成分的百分数:MgO高于 ,其原因是
,其原因是_______ 。
(5)氮、铜形成的某一种化合物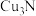 ,为立方晶系晶体,晶胞中氮原子只有一种位置,沿体对角线投影如图甲所示。
,为立方晶系晶体,晶胞中氮原子只有一种位置,沿体对角线投影如图甲所示。___ 个,请在图乙中画出该晶胞的结构示意图____ (○为N,●为Cu)已知晶胞中最近的两个Cu原子间距离为a pm,则晶体的密度为_____  (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
(1)基态
 的价层轨道表示式为
的价层轨道表示式为(2)Na、Mg、Al的第一电离能从小到大的顺序为
(3)铝离子电池一般采用离子液体作为电解质,某含铝离子液体的结构如图:
(4)几种氧化物的化学键中离子键成分的百分数和氧化物的熔点如下表:
| 氧化物 |  | MgO |  |
| 离子键的百分数/% | 62 | 50 | 41 |
| 熔点/℃ | 1132 | 2852 | 2054 |
 ,其原因是
,其原因是(5)氮、铜形成的某一种化合物
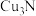 ,为立方晶系晶体,晶胞中氮原子只有一种位置,沿体对角线投影如图甲所示。
,为立方晶系晶体,晶胞中氮原子只有一种位置,沿体对角线投影如图甲所示。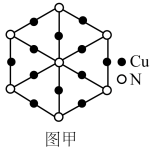
 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
5 . 氢能是一种绿色能源,研发新型制氢技术具有重要意义。
(1)甘油 、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
反应I: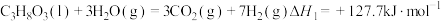
反应Ⅱ: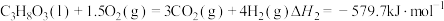
①
___________ 。
②除 外,可能还会产生
外,可能还会产生 等副产物,为了提高原子利用率,最需要抑制
等副产物,为了提高原子利用率,最需要抑制 的生成,原因是
的生成,原因是___________ 。
(2)“表面改性铝粉分解水制氢”因 储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响
储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响 还原活性的主要因素,工业上常用
还原活性的主要因素,工业上常用 溶液或锡酸钠
溶液或锡酸钠 溶液作为
溶液作为 粉的改性试剂。已知:
粉的改性试剂。已知: 。
。
①利用 溶液改性
溶液改性 粉的原理可用化学方程式表示为
粉的原理可用化学方程式表示为___________ 。
② 下,向两份质量和粒径均相同的
下,向两份质量和粒径均相同的 粉中,分别加入等体积
粉中,分别加入等体积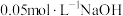 溶液和
溶液和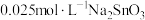 溶液来改性
溶液来改性 粉,氢气产率随时间的变化关系如图1所示。
粉,氢气产率随时间的变化关系如图1所示。 溶液改性效果明显优于
溶液改性效果明显优于 溶液的可能原因是
溶液的可能原因是___________ 。 溶液浓度的变化关系如图2所示。当
溶液浓度的变化关系如图2所示。当 溶液浓度为
溶液浓度为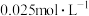 时,氢气产率接近
时,氢气产率接近 。但
。但 溶液过大或过小会大大降低氢气产率,其可能原因分别是
溶液过大或过小会大大降低氢气产率,其可能原因分别是___________ 。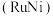 催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与
催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与 原子相连的3个
原子相连的3个 原子分别用
原子分别用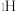 、
、 和
和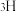 标记)。根据元素电负性的变化规律推测题图的虚线框内微粒
标记)。根据元素电负性的变化规律推测题图的虚线框内微粒 和
和 的化学式分别为
的化学式分别为___________ ;步骤Ⅱ可描述为___________ 。
(1)甘油
 、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:反应I:
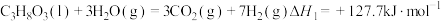
反应Ⅱ:
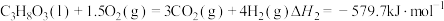
①

②除
 外,可能还会产生
外,可能还会产生 等副产物,为了提高原子利用率,最需要抑制
等副产物,为了提高原子利用率,最需要抑制 的生成,原因是
的生成,原因是(2)“表面改性铝粉分解水制氢”因
 储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响
储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响 还原活性的主要因素,工业上常用
还原活性的主要因素,工业上常用 溶液或锡酸钠
溶液或锡酸钠 溶液作为
溶液作为 粉的改性试剂。已知:
粉的改性试剂。已知: 。
。①利用
 溶液改性
溶液改性 粉的原理可用化学方程式表示为
粉的原理可用化学方程式表示为②
 下,向两份质量和粒径均相同的
下,向两份质量和粒径均相同的 粉中,分别加入等体积
粉中,分别加入等体积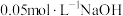 溶液和
溶液和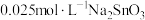 溶液来改性
溶液来改性 粉,氢气产率随时间的变化关系如图1所示。
粉,氢气产率随时间的变化关系如图1所示。 溶液改性效果明显优于
溶液改性效果明显优于 溶液的可能原因是
溶液的可能原因是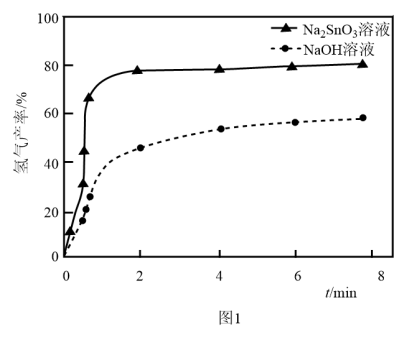
 溶液浓度的变化关系如图2所示。当
溶液浓度的变化关系如图2所示。当 溶液浓度为
溶液浓度为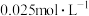 时,氢气产率接近
时,氢气产率接近 。但
。但 溶液过大或过小会大大降低氢气产率,其可能原因分别是
溶液过大或过小会大大降低氢气产率,其可能原因分别是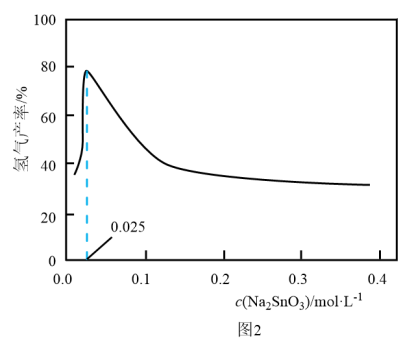
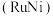 催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与
催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与 原子相连的3个
原子相连的3个 原子分别用
原子分别用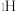 、
、 和
和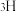 标记)。根据元素电负性的变化规律推测题图的虚线框内微粒
标记)。根据元素电负性的变化规律推测题图的虚线框内微粒 和
和 的化学式分别为
的化学式分别为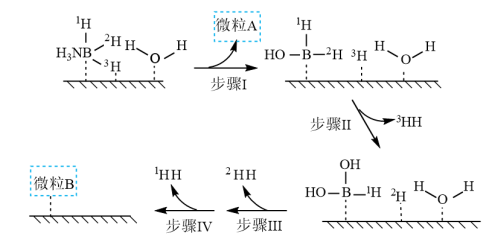
您最近一年使用:0次
名校
6 . 请回答以下问题:
(1)载人航天器中,通过以下两个反应实现氧的循环:
Ⅰ.
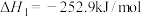
Ⅱ.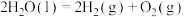
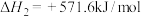
写出甲烷与氧气反应生成二氧化碳和液态水的热化学方程式_______ 。
(2)在 分子中,与N原子相连的H呈正电性
分子中,与N原子相连的H呈正电性 ,与B原子相连的H呈负电性
,与B原子相连的H呈负电性 ,这三种元素电负性从大到小的顺序是
,这三种元素电负性从大到小的顺序是_______ 。(用元素符号作答)
(3) 的
的 溶液中水电离出
溶液中水电离出 的物质的量为
的物质的量为_______ mol。
(4)下图为相互串联的三个装置,试回答:
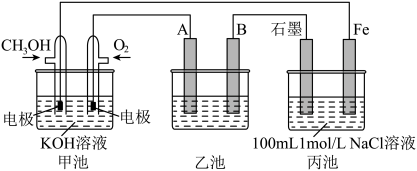
①写出甲池负极的电极反应式:_______ 。
②若利用乙池在铁片上镀银,则B是_______ (填电极材料)。
③向丙池溶液中滴加几滴酚酞试液,电极_______ (填“石墨”或“Fe”)周围先出现红色,该电极的电极反应式为:_______ ;电解中,若丙池仅产生两种气体,要使丙池溶液恢复原浓度,可向溶液中加入_______ 。(填化学式)
(1)载人航天器中,通过以下两个反应实现氧的循环:
Ⅰ.

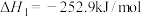
Ⅱ.
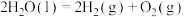
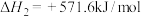
写出甲烷与氧气反应生成二氧化碳和液态水的热化学方程式
(2)在
 分子中,与N原子相连的H呈正电性
分子中,与N原子相连的H呈正电性 ,与B原子相连的H呈负电性
,与B原子相连的H呈负电性 ,这三种元素电负性从大到小的顺序是
,这三种元素电负性从大到小的顺序是(3)
 的
的 溶液中水电离出
溶液中水电离出 的物质的量为
的物质的量为(4)下图为相互串联的三个装置,试回答:

①写出甲池负极的电极反应式:
②若利用乙池在铁片上镀银,则B是
③向丙池溶液中滴加几滴酚酞试液,电极
您最近一年使用:0次
名校
解题方法
7 . 钛被视为继铁、铝之后的第三金属,也有人说“21世纪将是钛的世纪”,钛和钛的化合物在航天、化工、建筑、医疗中都有着广泛的用途。回答下列问题:
(1)基态钛原子核外有___________ 种能量不同的电子,其价电子排布式为___________ ;
(2)钛与卤素形成的化合物TiX4熔点如下表:
它们熔点差异的原因_____________________ ;
(3)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①Ti(BH4)3中所含元素电负性由小到大的顺序为___________ ;
②TiCl4的空间结构为___________ ;
③LiBH4由Li+和BH 构成,BH
构成,BH 中B原子的杂化类型是
中B原子的杂化类型是___________ ;
④LiBH4不存在___________ (填序号)。
A.离子键 B.共价键 C.金属键 D.配位键 E.氢键
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,已知该晶体的晶胞参数为423.5 pm。用Al掺杂TiN后晶胞参数不变,其晶胞结构如图所示,距离Ti最近的Al有___________ 个,掺杂Al后的晶体密度是TiN晶体密度的___________ 倍(保留三位小数)。
(1)基态钛原子核外有
(2)钛与卤素形成的化合物TiX4熔点如下表:
| TiX4 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点℃ | 377 | -24 | 38.3 | 153 |
(3)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①Ti(BH4)3中所含元素电负性由小到大的顺序为
②TiCl4的空间结构为
③LiBH4由Li+和BH
 构成,BH
构成,BH 中B原子的杂化类型是
中B原子的杂化类型是④LiBH4不存在
A.离子键 B.共价键 C.金属键 D.配位键 E.氢键
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,已知该晶体的晶胞参数为423.5 pm。用Al掺杂TiN后晶胞参数不变,其晶胞结构如图所示,距离Ti最近的Al有

您最近一年使用:0次
2024-01-08更新
|
90次组卷
|
2卷引用:内蒙古师范大学锦山实验中学2023-2024学年高二下学期一调考试化学试题



