名校
1 . 中国有广阔的海岸线,建设发展海洋经济、海水的综合利用大有可为。
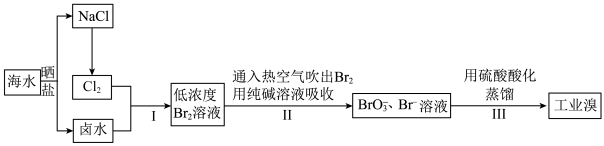
Ⅰ.目前世界上60%的镁是从海水中提取的,海水提镁的主要流程如下:__________ 。
(2)工业冶炼金属 的化学方程式为
的化学方程式为__________ 。
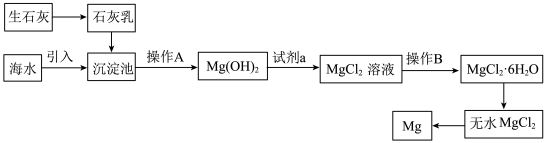
Ⅱ.空气吹出法工艺,是目前“海水提溴”的最主要方法之一,其工艺流程如下图所示,试回答下列问题: ”,这样进行转化的目的是
”,这样进行转化的目的是__________ 。
(4)步骤Ⅱ通入热空气或水蒸气吹出 ,利用了溴的__________(填序号)。
,利用了溴的__________(填序号)。
(5)写出步骤Ⅱ中涉及的离子反应__________ 。
Ⅲ.最近,科学家开发了一种用二氧化碳淡化海水的技术,其循环图如下: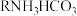 中H、C、N、O四种元素的电负性
中H、C、N、O四种元素的电负性由大到小 的顺序为__________ 。
Ⅰ.目前世界上60%的镁是从海水中提取的,海水提镁的主要流程如下:
(2)工业冶炼金属
 的化学方程式为
的化学方程式为Ⅱ.空气吹出法工艺,是目前“海水提溴”的最主要方法之一,其工艺流程如下图所示,试回答下列问题:
 ”,这样进行转化的目的是
”,这样进行转化的目的是(4)步骤Ⅱ通入热空气或水蒸气吹出
 ,利用了溴的__________(填序号)。
,利用了溴的__________(填序号)。| A.氧化性 | B.还原性 | C.挥发性 | D.腐蚀性 |
(5)写出步骤Ⅱ中涉及的离子反应
Ⅲ.最近,科学家开发了一种用二氧化碳淡化海水的技术,其循环图如下:

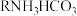 中H、C、N、O四种元素的电负性
中H、C、N、O四种元素的电负性
您最近一年使用:0次
2 . 下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。___________ 。
(2)元素h的基态原子电子排布式为___________ 。
(3)元素i在周期表中处于___________ 区。元素e的最高价氧化物对应水化物的浓溶液,与i的单质反应的离子方程式为___________ 。
(4)下列有关说法正确的是___________(填选项字母)。
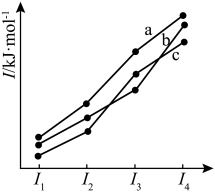
(5)如图三条曲线表示C、Si、P三种元素第一电离能(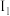 )至第四电离能(I4)的变化趋势。其中,曲线a表示的元素是
)至第四电离能(I4)的变化趋势。其中,曲线a表示的元素是___________ 。
(6)经研究,发现可能存在的第119号元素。有关第119号元素的预测正确的是___________。

(2)元素h的基态原子电子排布式为
(3)元素i在周期表中处于
(4)下列有关说法正确的是___________(填选项字母)。
A.第一电离能: | B.电负性: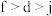 |
C.气态氢化物的稳定性: | D.含氧酸的酸性: |
(5)如图三条曲线表示C、Si、P三种元素第一电离能(
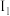 )至第四电离能(I4)的变化趋势。其中,曲线a表示的元素是
)至第四电离能(I4)的变化趋势。其中,曲线a表示的元素是
(6)经研究,发现可能存在的第119号元素。有关第119号元素的预测正确的是___________。
| A.在化合物中显+1价 | B.单质具有强氧化性 |
| C.最高价氧化物对应的水化物为弱碱 | D.单质能与冷水剧烈反应 |
您最近一年使用:0次
名校
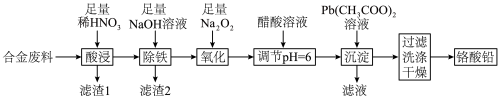
3 . 铬酸铅(PbCrO4)是黄色涂料“铬黄”的主要成分,实验室由某合金废料(主要成分为Fe、C、Cr2O3)制备PbCrO4的流程如图:
回答下列问题:
(1)基态82Pb2+的价层电子排布图为_______ 。
(2)“酸浸”时,加热可以加快反应速率,但温度不宜过高的原因是_______ (用化学方程式解释)。
(3)“滤渣2”中电负性最大的元素是_______ (填元素符号)。
(4)“氧化”时发生反应的离子方程式为_______ 。
(5)“调节pH=6”的目的是_______ 。
(6)二卤化铅(PbX2)是一类重要的含铅化合物,其熔点如下表所示:
①结合PbX2的熔点变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性_______ (填“增强”“不变”或“减弱”,后同)、共价性_______ 。
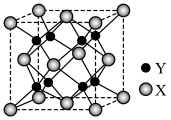
②PbF2的立方晶胞如图所示,其中X代表的离子是_______ (填离子符号);若该晶胞参数为anm,则正、负离子的最小核间距为_______ pm。
回答下列问题:
(1)基态82Pb2+的价层电子排布图为
(2)“酸浸”时,加热可以加快反应速率,但温度不宜过高的原因是
(3)“滤渣2”中电负性最大的元素是
(4)“氧化”时发生反应的离子方程式为
(5)“调节pH=6”的目的是
(6)二卤化铅(PbX2)是一类重要的含铅化合物,其熔点如下表所示:
| 二卤化铅 | PbF2 | PbCl2 | PbBr2 | PbI2 |
| 熔点/℃ | 824 | 501 | 373 | 402 |
②PbF2的立方晶胞如图所示,其中X代表的离子是
您最近一年使用:0次
2024-05-12更新
|
124次组卷
|
2卷引用:云南省昆明市云南师范大学附属中学2023-2024学年高三下学期适应性月考(九)理综试卷-高中化学
名校
解题方法
4 . 我国可燃冰资源一直被视为能源领域的宝藏,可燃冰被寄予厚望成为替代传统石油和天然气的清洁能源。回答下列问题:
(1)一定条件下, 、
、 都能与
都能与 形成笼状结构(如图所示)的水合物晶体,其相关参数见下表。
形成笼状结构(如图所示)的水合物晶体,其相关参数见下表。 与
与 形成的水合物晶体俗称“可燃冰”。
形成的水合物晶体俗称“可燃冰”。
 和
和 所含的三种元素电负性从大到小的顺序为
所含的三种元素电负性从大到小的顺序为___________ ;碳原子的最高能级的符号是___________ ,其电子云形状是___________ 。
(2) 分子的空间结构为
分子的空间结构为___________ 。相同条件下 与
与 在水中的溶解度较大的是
在水中的溶解度较大的是 ,理由是
,理由是___________ 。
(3)“可燃冰”中分子间存在的两种作用力是___________ 。
(4)下列关于 和
和 的说法正确的是___________(填标号)。
的说法正确的是___________(填标号)。
(5)为开采深海海底的“可燃冰”,有科学家提出用 置换
置换 的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是
的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是___________ 。
(1)一定条件下,
 、
、 都能与
都能与 形成笼状结构(如图所示)的水合物晶体,其相关参数见下表。
形成笼状结构(如图所示)的水合物晶体,其相关参数见下表。 与
与 形成的水合物晶体俗称“可燃冰”。
形成的水合物晶体俗称“可燃冰”。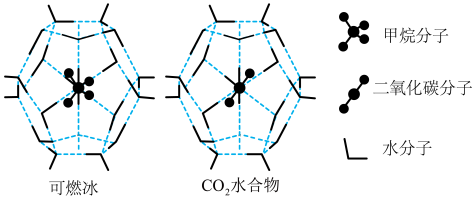
| 参数分子 | 分子直径/nm | 分子与 的结合能E/(kJ·mol 的结合能E/(kJ·mol ) ) |
 | 0.436 | 16.40 |
 | 0.512 | 29.91 |
 和
和 所含的三种元素电负性从大到小的顺序为
所含的三种元素电负性从大到小的顺序为(2)
 分子的空间结构为
分子的空间结构为 与
与 在水中的溶解度较大的是
在水中的溶解度较大的是 ,理由是
,理由是(3)“可燃冰”中分子间存在的两种作用力是
(4)下列关于
 和
和 的说法正确的是___________(填标号)。
的说法正确的是___________(填标号)。A. 分子中含有2个σ键和2个π键 分子中含有2个σ键和2个π键 |
B. 分子中含有极性共价键,是极性分子 分子中含有极性共价键,是极性分子 |
C.因为碳氢键键能小于碳氧键,所以 的熔点低于 的熔点低于 |
D. 和 和 分子中碳原子的杂化类型分别是 分子中碳原子的杂化类型分别是 和sp 和sp |
(5)为开采深海海底的“可燃冰”,有科学家提出用
 置换
置换 的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是
的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是
您最近一年使用:0次
名校
5 . 2023年诺贝尔化学奖授予蒙吉·G·巴文迪等三位科学家,以表彰他们在发现和合成量子点方面所作出的贡献,碳量子点是一类具有显著荧光性能的零维碳纳米材料,其结构如图所示。回答下列问题:_______ 区,图中C的杂化方式为_______ 。
(2)碳量子点结构包含的元素中电负性由大到小排列为:_______ 。
(3)碳量子点水溶性_______ (选填“>”“<”“=”)石墨水溶性,理由是:_______ 。
(4)高压合成金刚石的原料是廉价的石墨,用高压釜持续施加高温高压并加入金属镍等金属催化剂,石墨可转化为金刚石。基态镍原子核外电子的空间运动状态有_______ 种,比较二者C-C共价键的键长:石墨_______ 金刚石(选填“>”“<”“=”)。
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,其中一种结构为立方氮化硼(如图),类似于金刚石。_______ ,则立方氮化硼晶体密度为_______ g·cm-3(列出计算式,阿伏加德罗常数的值为NA)。

(2)碳量子点结构包含的元素中电负性由大到小排列为:
(3)碳量子点水溶性
(4)高压合成金刚石的原料是廉价的石墨,用高压釜持续施加高温高压并加入金属镍等金属催化剂,石墨可转化为金刚石。基态镍原子核外电子的空间运动状态有
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,其中一种结构为立方氮化硼(如图),类似于金刚石。
您最近一年使用:0次
解题方法
6 . 硼单质及其化合物有重要的应用。阅读下列材料,回答问题:
硼晶体熔点为2076℃。乙硼烷(B2H6)具有还原性,易水解生成 (一元弱酸);乙硼烷可与
(一元弱酸);乙硼烷可与 反应生成氨硼烷(
反应生成氨硼烷( ,其在一定条件下可以脱氢,最终得到氮化硼;乙硼烷也可与NaH反应生成
,其在一定条件下可以脱氢,最终得到氮化硼;乙硼烷也可与NaH反应生成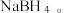
(1)下列说法正确的是_______(填字母)。
(2)根据对角线规则,B的一些化学性质与元素_______ 的相似;B 的空间结构是
的空间结构是_______ 。
(3)硼酸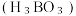 是一种片层状结构的白色晶体(如图),有油腻感,可做润滑剂。
是一种片层状结构的白色晶体(如图),有油腻感,可做润滑剂。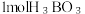 晶体中含有
晶体中含有_______ mol氢键;加热时,硼酸在水中溶解度增大,从结构角度分析,可能的原因为_______ 。
② 与NaOH溶液反应可以制备硼砂
与NaOH溶液反应可以制备硼砂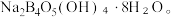 常温下,
常温下, 可以水解生成等物质的量浓度的
可以水解生成等物质的量浓度的 和
和 该水解反应的离子方程式为
该水解反应的离子方程式为_______ 。
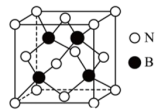
(4)氮化硼(BN)晶体有多种相结构。一种立方BN晶体与金刚石结构相似,其晶胞结构如图: 则晶胞中含有BN的个数为
则晶胞中含有BN的个数为_______ (列出计算式,阿伏加德罗常数的数值为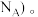
硼晶体熔点为2076℃。乙硼烷(B2H6)具有还原性,易水解生成
 (一元弱酸);乙硼烷可与
(一元弱酸);乙硼烷可与 反应生成氨硼烷(
反应生成氨硼烷( ,其在一定条件下可以脱氢,最终得到氮化硼;乙硼烷也可与NaH反应生成
,其在一定条件下可以脱氢,最终得到氮化硼;乙硼烷也可与NaH反应生成
(1)下列说法正确的是_______(填字母)。
| A.元素的电负性大小顺序是O>N>B>H |
B.乙硼烷水解方程式为 |
| C.氨硼烷分子中N提供孤电子对,B提供空轨道形成配位键 |
D.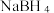 晶体中存在的相互作用有离子键、共价键、氢键 晶体中存在的相互作用有离子键、共价键、氢键 |
 的空间结构是
的空间结构是(3)硼酸
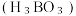 是一种片层状结构的白色晶体(如图),有油腻感,可做润滑剂。
是一种片层状结构的白色晶体(如图),有油腻感,可做润滑剂。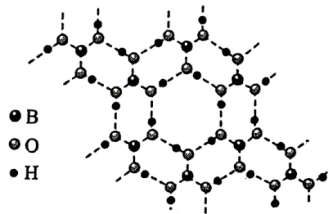
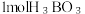 晶体中含有
晶体中含有②
 与NaOH溶液反应可以制备硼砂
与NaOH溶液反应可以制备硼砂 常温下,
常温下, 可以水解生成等物质的量浓度的
可以水解生成等物质的量浓度的 和
和 该水解反应的离子方程式为
该水解反应的离子方程式为(4)氮化硼(BN)晶体有多种相结构。一种立方BN晶体与金刚石结构相似,其晶胞结构如图:
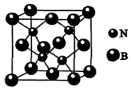
 则晶胞中含有BN的个数为
则晶胞中含有BN的个数为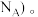
您最近一年使用:0次
7 . 2017年5月海底天然气水合物(俗称可燃冰)试采成功,这是我国能源开发的一次历史性突破。一定条件下,CH4和CO2都能与H2O形成如图所示的笼状结构(表面的小球是水分子,内部的大球是CH4分子或CO2分子;“可燃冰”是CH4与H2O形成的水合物),其相关参数见下表。
(1)CH4和CO2所含的三种元素电负性从大到小的顺序为___________ ;碳原子的最高能级的符号是___________ ,其电子云形状是___________ 。
(2) 分子中碳原子的杂化轨道类型为
分子中碳原子的杂化轨道类型为___________ ,分子的空间结构为___________ 。
(3)为开采海底的“可燃冰”,有科学家提出用 置换
置换 的设想。已知图中笼状结构的空腔直径为
的设想。已知图中笼状结构的空腔直径为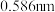 ,根据上述图表,从物质结构及性质的角度分析,该设想的依据是
,根据上述图表,从物质结构及性质的角度分析,该设想的依据是___________ 。
(4)“可燃冰”中分子间存在的作用力是氢键和___________ ,上图中最小的环中连接的原子总数是___________ 。
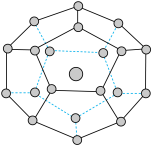
| 参数分子 | 分子直径/nm | 分子与H2O的结合能E(kJ·mol-1) |
| CH4 | 0.436 | 16.40 |
| CO2 | 0.512 | 29.91 |
(1)CH4和CO2所含的三种元素电负性从大到小的顺序为
(2)
 分子中碳原子的杂化轨道类型为
分子中碳原子的杂化轨道类型为(3)为开采海底的“可燃冰”,有科学家提出用
 置换
置换 的设想。已知图中笼状结构的空腔直径为
的设想。已知图中笼状结构的空腔直径为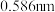 ,根据上述图表,从物质结构及性质的角度分析,该设想的依据是
,根据上述图表,从物质结构及性质的角度分析,该设想的依据是(4)“可燃冰”中分子间存在的作用力是氢键和
您最近一年使用:0次
名校
解题方法
8 . I.回答下列问题:
(1)下列原子或离子的核外电子排布正确的是___________ ,违反能量最低原理的是___________ ,违反洪特规则的是___________ ,违反泡利不相容原理的是___________ 。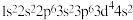 ⑤K:
⑤K: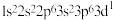 ⑥Mg:
⑥Mg:
(2)《中华本草》等中医典籍中,记载了炉甘石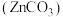 入药,可用于治疗皮肤炎症或表面创伤。Zn、C、O电负性由大至小的顺序是
入药,可用于治疗皮肤炎症或表面创伤。Zn、C、O电负性由大至小的顺序是___________ ,其阴离子的空间结构为___________ ,Zn位于元素周期表的___________ 区。
(3)基态锰原子有___________ 种空间运动状态的电子,锰有多种化合价,在+2、+3、+4、+5和+6中,最稳定的化合价是___________ 。
(4) 已知无水 固态时具有链状结构
固态时具有链状结构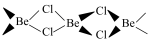 ,在二聚体分子(
,在二聚体分子(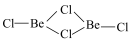 ),其中铍原子的杂化类型为
),其中铍原子的杂化类型为___________ 。
(1)下列原子或离子的核外电子排布正确的是
① :
: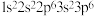 ②
② :
: ③P:
③P: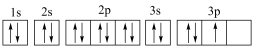
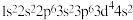 ⑤K:
⑤K: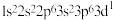 ⑥Mg:
⑥Mg:
⑦C: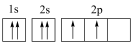
(2)《中华本草》等中医典籍中,记载了炉甘石
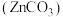 入药,可用于治疗皮肤炎症或表面创伤。Zn、C、O电负性由大至小的顺序是
入药,可用于治疗皮肤炎症或表面创伤。Zn、C、O电负性由大至小的顺序是(3)基态锰原子有
(4) 已知无水
 固态时具有链状结构
固态时具有链状结构 ,在二聚体分子(
,在二聚体分子( ),其中铍原子的杂化类型为
),其中铍原子的杂化类型为
您最近一年使用:0次
名校
解题方法
9 . 2020年2月15日,由国家科研攻关组的主要成员单位的专家组共同研判磷酸氯喹在细胞水平上能有效抑制新型冠状病毒(2019-nCoV)的感染。
(1)已知磷酸氯喹的结构如图所示,则一个磷酸氯喹分子中含___________ 个 杂化的碳原子;分子中N原子的杂化方式为
杂化的碳原子;分子中N原子的杂化方式为___________ ;基态磷原子核外电子的空间运动状态有___________ 种。
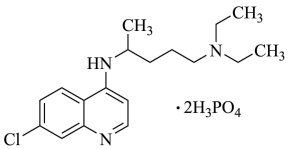
(2) 与金刚石均为碳的单质,从结构与性质之间的关系解释
与金刚石均为碳的单质,从结构与性质之间的关系解释 的熔点远低于金刚石的原因是
的熔点远低于金刚石的原因是___________ 。
(3)气态 通常以二聚体
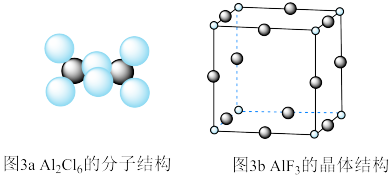
通常以二聚体 的形式存在,其空间结构如图3a所示,二聚体中Al的轨道杂化类型为
的形式存在,其空间结构如图3a所示,二聚体中Al的轨道杂化类型为___________ 。 结构属立方晶系,晶胞如图3b所示,
结构属立方晶系,晶胞如图3b所示, 的配位数为
的配位数为___________ 。若晶胞参数为apm,晶体密度ρ=___________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
(4)吡啶(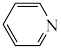 )分子中氮原子电子云密度越大,碱性越强。下列物质的碱性由强到弱的排序是
)分子中氮原子电子云密度越大,碱性越强。下列物质的碱性由强到弱的排序是___________ (填代号)。
a.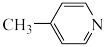 b.
b.  c.
c. 
(1)已知磷酸氯喹的结构如图所示,则一个磷酸氯喹分子中含
 杂化的碳原子;分子中N原子的杂化方式为
杂化的碳原子;分子中N原子的杂化方式为
(2)
 与金刚石均为碳的单质,从结构与性质之间的关系解释
与金刚石均为碳的单质,从结构与性质之间的关系解释 的熔点远低于金刚石的原因是
的熔点远低于金刚石的原因是(3)气态
 通常以二聚体
通常以二聚体 的形式存在,其空间结构如图3a所示,二聚体中Al的轨道杂化类型为
的形式存在,其空间结构如图3a所示,二聚体中Al的轨道杂化类型为 结构属立方晶系,晶胞如图3b所示,
结构属立方晶系,晶胞如图3b所示, 的配位数为
的配位数为 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
(4)吡啶(
 )分子中氮原子电子云密度越大,碱性越强。下列物质的碱性由强到弱的排序是
)分子中氮原子电子云密度越大,碱性越强。下列物质的碱性由强到弱的排序是a.
 b.
b.  c.
c. 
您最近一年使用:0次
名校
解题方法
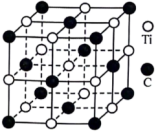
10 . 钛被誉为太空金属和亲生物金属,拥有卓越的金属特性。它在特定温度下能与多种物质发生反应,在生产和日常生活中都能找到它的踪影。______ ,基态Ti原子的价电子占据原子轨道数目是______ 。
(2) 熔点是
熔点是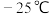 ,沸点136.4℃,可溶于苯或
,沸点136.4℃,可溶于苯或 ,该晶体属于
,该晶体属于______ 晶体; 的制备是以单质Ti和
的制备是以单质Ti和 通过化合反应制得,已知,每转移0.2mol电子放出40.2kJ热量(恢复至室温),请写出该反应的热化学方程式
通过化合反应制得,已知,每转移0.2mol电子放出40.2kJ热量(恢复至室温),请写出该反应的热化学方程式______ ;以 为原料制备
为原料制备 的原理为
的原理为______ (用化学方程式表示)。
(3)已知TiC在碳化物中硬度最大,工业上一般在真空和高温 条件下用C还原
条件下用C还原 制取
制取 。该反应中涉及的元素按电负性由大到小的顺序排列为
。该反应中涉及的元素按电负性由大到小的顺序排列为______ 。
(4)利用钛粉和碳粉反应可生成碳化钛,它在刀具制造领域有重要应用。在该晶体中Ti原子周围紧邻的Ti原子数目为______ 个;设 为阿伏加德罗常数的值,若晶胞边长为
为阿伏加德罗常数的值,若晶胞边长为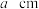 ,则晶体的密度为
,则晶体的密度为______  。(写出表达式)
。(写出表达式)
(2)
 熔点是
熔点是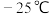 ,沸点136.4℃,可溶于苯或
,沸点136.4℃,可溶于苯或 ,该晶体属于
,该晶体属于 的制备是以单质Ti和
的制备是以单质Ti和 通过化合反应制得,已知,每转移0.2mol电子放出40.2kJ热量(恢复至室温),请写出该反应的热化学方程式
通过化合反应制得,已知,每转移0.2mol电子放出40.2kJ热量(恢复至室温),请写出该反应的热化学方程式 为原料制备
为原料制备 的原理为
的原理为(3)已知TiC在碳化物中硬度最大,工业上一般在真空和高温
 条件下用C还原
条件下用C还原 制取
制取 。该反应中涉及的元素按电负性由大到小的顺序排列为
。该反应中涉及的元素按电负性由大到小的顺序排列为(4)利用钛粉和碳粉反应可生成碳化钛,它在刀具制造领域有重要应用。在该晶体中Ti原子周围紧邻的Ti原子数目为
 为阿伏加德罗常数的值,若晶胞边长为
为阿伏加德罗常数的值,若晶胞边长为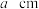 ,则晶体的密度为
,则晶体的密度为 。(写出表达式)
。(写出表达式)
您最近一年使用:0次



