名校
1 . 下列关于物质结构与性质的说法,不正确的是
A. 中的 中的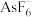 离子的空间结构为正八面体形 离子的空间结构为正八面体形 |
| B.C、H、O三种元素的电负性由小到大的顺序为H<C<O |
C.HClO、 、 、 的中心原子价层电子对数不完全相同 的中心原子价层电子对数不完全相同 |
| D.第四周期元素中,Ga的第一电离能低于Zn |
您最近一年使用:0次
2024-02-17更新
|
252次组卷
|
4卷引用:陕西省西安市西北工业大学附属中学2023-2024学年高二上学期期末质量检化学试题
陕西省西安市西北工业大学附属中学2023-2024学年高二上学期期末质量检化学试题(已下线)2.2.2 杂化轨道理论(提高)名校期末好题汇编-分子结构与性质(选择题)(已下线)清单02 分子结构与性质(考点清单)(讲+练)-2023-2024学年高二化学下学期期末考点大串讲(人教版2019)
名校
解题方法
2 . 已知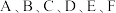 是原子序数依次增大的前四周期元素。其中
是原子序数依次增大的前四周期元素。其中 是宇宙中含量最多的元素;
是宇宙中含量最多的元素; 元素原子最高能级的不同轨道都有电子,并且自旋方向相同;
元素原子最高能级的不同轨道都有电子,并且自旋方向相同; 元素原子的价层电子排布式为
元素原子的价层电子排布式为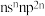 ;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;
;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子; 与
与 的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。下列说法正确的是
的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。下列说法正确的是
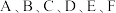 是原子序数依次增大的前四周期元素。其中
是原子序数依次增大的前四周期元素。其中 是宇宙中含量最多的元素;
是宇宙中含量最多的元素; 元素原子最高能级的不同轨道都有电子,并且自旋方向相同;
元素原子最高能级的不同轨道都有电子,并且自旋方向相同; 元素原子的价层电子排布式为
元素原子的价层电子排布式为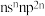 ;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;
;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子; 与
与 的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。下列说法正确的是
的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。下列说法正确的是A.A、B、C三种元素的电负性: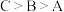 |
B.B、C、D、E四种元素的第一电离能: |
C.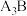 的稳定性大于 的稳定性大于 |
D. 的常见离子的核外电子排布图为 的常见离子的核外电子排布图为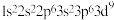 |
您最近一年使用:0次
2023-09-17更新
|
212次组卷
|
2卷引用:陕西省榆林市第十中学2023-2024学年高二下学期第一次质量检测化学试题
3 . X、Y、Z、Q、R是元素周期表前四周期元素,且原子序数依次增大;X原子核外有6种不同运动状态的电子;Y原子的最外层电子数比次外层电子数多3个;基态Z原子的 能级成对电子数的对数与未成对电子数相等;Q电子总数是最外层电子数的3倍;R是用量最大、使用最广泛的金属。下列说法正确的是
能级成对电子数的对数与未成对电子数相等;Q电子总数是最外层电子数的3倍;R是用量最大、使用最广泛的金属。下列说法正确的是
 能级成对电子数的对数与未成对电子数相等;Q电子总数是最外层电子数的3倍;R是用量最大、使用最广泛的金属。下列说法正确的是
能级成对电子数的对数与未成对电子数相等;Q电子总数是最外层电子数的3倍;R是用量最大、使用最广泛的金属。下列说法正确的是A.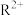 的价电子排布式为 的价电子排布式为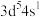 | B.电负性:X>Y>Z |
| C.最简单氢化物的稳定性:Y>Q | D.X的氢化物中只含有σ键 |
您最近一年使用:0次
名校
解题方法
4 . 下列性质的比较正确的是
| A.单质的熔点:Li>Na>K> Rb | B.电负性: P>N>O>C |
| C.第一电离能: Na<Mg<Al<Si | D.微粒半径: Li+<O2-<F-<Na+ |
您最近一年使用:0次
2022-10-13更新
|
410次组卷
|
3卷引用:陕西省渭南市华州区咸林中学2023-2024学年高二下学期期中考试化学试题
名校
解题方法
5 . 下列说法不正确的是
| A.电负性:N> P>Li |
B.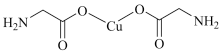 中σ键和 中σ键和 键比例为7:1 键比例为7:1 |
C.N2与 互为等电子体, 互为等电子体, 中含有的 中含有的 键数目为 键数目为 |
D.C 中的所有原子均共面 中的所有原子均共面 |
您最近一年使用:0次
2023-04-08更新
|
251次组卷
|
3卷引用:陕西省西安市西北工业大学附属中学2023-2024学年高二上学期期末质量检化学试题
名校
解题方法
6 . 铜是人类最早使用的金属之一,铜的使用对早期人类文明的进步影响深远。回答下列问题:
(1)基态Cu2+的价电子排布式为___________ 。
(2)已知铜的某种配合物A的结构如图所示:
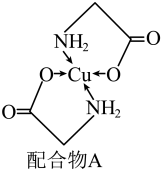
①A中所含的三种元素C、N、O的电负性由大到小的顺序为___________ 。
②配合物中氮原子的杂化轨道类型为___________ 。
③配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,CO2是___________ (填“极性”或“非极性”)分子。
(3)铜盐是自然界中重要的盐,CuSO4中SO 的立体构型为
的立体构型为___________ ;Cu(NO3)2中的化学键类型为___________ 。
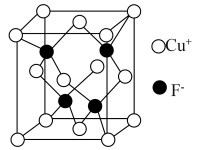
(4)CuF的晶胞结构如图所示。在CuF晶体中距离Cu+最近的F-有___________ 个。已知CuF的密度为7.1g/cm3,则CuF的晶胞参数a=___________ nm(列出计算式)。
(1)基态Cu2+的价电子排布式为
(2)已知铜的某种配合物A的结构如图所示:

①A中所含的三种元素C、N、O的电负性由大到小的顺序为
②配合物中氮原子的杂化轨道类型为
③配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,CO2是
(3)铜盐是自然界中重要的盐,CuSO4中SO
 的立体构型为
的立体构型为(4)CuF的晶胞结构如图所示。在CuF晶体中距离Cu+最近的F-有

您最近一年使用:0次
2023-12-31更新
|
144次组卷
|
2卷引用:2024届陕西省西安市第一中学高三上学期12月月考理综试卷
解题方法
7 . 1869年门捷列夫编排的元素周期表为我们学习化学提供了理论依据。H、Li、Na、K位于周期表中ⅠA族。下列说法正确的是
| A.元素周期表的每个周期都是从ns能级开始,以mp能级结束 |
B.电负性大小: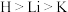 |
C.第一电离能: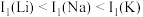 |
D.碱性强弱: |
您最近一年使用:0次
8 . Fe、Co、Ni、Cu均为第四周期元素,它们的化合物在生产、生活中有着广泛的应用。
(1)基态Fe原子的核外电子中,两种自旋状态的电子数之比为___________ 。在空气中FeO稳定性小于 ,从电子排布的角度分析,其主要原因是
,从电子排布的角度分析,其主要原因是___________ 。
(2) 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中,VSEPR模型为四面体的非金属原子共有
。该化合物分子中,VSEPR模型为四面体的非金属原子共有___________ 个;C、N、B的电负性由小到大的顺序为___________ 。
(3)基态 的核外电子排布式为
的核外电子排布式为___________ ; 常温下为无色液体,写出两种与CO互为等电子体离子的化学式
常温下为无色液体,写出两种与CO互为等电子体离子的化学式___________ 、___________ 。
(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为___________ ;该晶体的化学式为___________ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点、B点原子的分数坐标分别为 、
、 ,则c点原子的分数坐标为
,则c点原子的分数坐标为___________ ;晶胞中C、D间距离d=___________ pm。
(1)基态Fe原子的核外电子中,两种自旋状态的电子数之比为
 ,从电子排布的角度分析,其主要原因是
,从电子排布的角度分析,其主要原因是(2)
 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中,VSEPR模型为四面体的非金属原子共有
。该化合物分子中,VSEPR模型为四面体的非金属原子共有(3)基态
 的核外电子排布式为
的核外电子排布式为 常温下为无色液体,写出两种与CO互为等电子体离子的化学式
常温下为无色液体,写出两种与CO互为等电子体离子的化学式(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为
 、
、 ,则c点原子的分数坐标为
,则c点原子的分数坐标为
您最近一年使用:0次
解题方法
9 . 近年来,我国半导体材料市场发展迅速,其中以氮化嫁、碳化硅、氧化锌、金刚石等为主的材料备受关注。回答下列问题:
(1)基态Ga原子的价电子轨道表示式为___________ ,基态N原子核外电子有___________ 种空间运动状态。Zn在元素周期表中位于___________ 区。
(2)C,N、O的第一电离能由大到小的顺序为___________ 。 的空间结构为
的空间结构为___________ 。
(3)SiC的立方晶胞结构如图1所示,已知;1号C原子的坐标参数为( ,
, ,
, ),晶胞参数为apm。则晶胞中2号C原子的坐标参数为
),晶胞参数为apm。则晶胞中2号C原子的坐标参数为___________ ,C和Si原子的最短距离为___________ pm。
①GaN晶体中N原子的杂化轨道类型为___________ 。
②GaN晶体的密度为___________ g/cm3(列出计算式,用含b、c、NA的代数式表示)。
(1)基态Ga原子的价电子轨道表示式为
(2)C,N、O的第一电离能由大到小的顺序为
 的空间结构为
的空间结构为(3)SiC的立方晶胞结构如图1所示,已知;1号C原子的坐标参数为(
 ,
, ,
, ),晶胞参数为apm。则晶胞中2号C原子的坐标参数为
),晶胞参数为apm。则晶胞中2号C原子的坐标参数为
①GaN晶体中N原子的杂化轨道类型为
②GaN晶体的密度为
您最近一年使用:0次
名校
10 . 下面关于四种短周期元素的原子比较正确的是
①基态原子的电子排布式: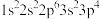 ;②3p轨道半充满的原子;③原子核外有4种不同能量的电子,且只有一个单电子;④s能级电子总数等于p能级电子总数的p区原子
;②3p轨道半充满的原子;③原子核外有4种不同能量的电子,且只有一个单电子;④s能级电子总数等于p能级电子总数的p区原子
①基态原子的电子排布式:
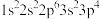 ;②3p轨道半充满的原子;③原子核外有4种不同能量的电子,且只有一个单电子;④s能级电子总数等于p能级电子总数的p区原子
;②3p轨道半充满的原子;③原子核外有4种不同能量的电子,且只有一个单电子;④s能级电子总数等于p能级电子总数的p区原子| A.最高正化合价:④=①>②>③ | B.原子半径:③>②>①>④ |
| C.电负性;③>②>①>④ | D.第一电离能:④>①>②>③。 |
您最近一年使用:0次
2024-04-11更新
|
205次组卷
|
2卷引用:陕西省西安市铁一中学2023-2024学年高二下学期第一次月考化学试题



