名校
解题方法
1 . 下列有关物质结构与性质的比较正确的是
A.分子的极性: | B.酸性: |
C.键角: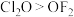 | D.基态原子未成对电子数:Mn>Cr |
您最近一年使用:0次
2023-12-16更新
|
596次组卷
|
5卷引用:陕西省西安市西北工业大学附属中学2023-2024学年高二上学期期末质量检化学试题
解题方法
2 . 食用碱是人们生活中常用的食品疏松剂和肉类嫩化剂,其成分为纯碱 和小苏打
和小苏打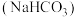 。下列说法正确的是
。下列说法正确的是
 和小苏打
和小苏打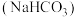 。下列说法正确的是
。下列说法正确的是A.离子半径: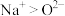 | B.电负性: |
C.非金属性: | D.第一电离能: |
您最近一年使用:0次
2023-12-01更新
|
550次组卷
|
5卷引用:陕西省西安市2023-2024学年高二上学期期末考试化学试题
名校
解题方法
3 . 短周期主族元素X、Y、Z、W、M、N的原子序数依次增大,X核外电子只有1种运动状态,Y、W的 轨道均含有2个未成对电子,M是短周期原子半径最大的元素,N的氢氧化物具有两性,下列说法不正确的是
轨道均含有2个未成对电子,M是短周期原子半径最大的元素,N的氢氧化物具有两性,下列说法不正确的是
 轨道均含有2个未成对电子,M是短周期原子半径最大的元素,N的氢氧化物具有两性,下列说法不正确的是
轨道均含有2个未成对电子,M是短周期原子半径最大的元素,N的氢氧化物具有两性,下列说法不正确的是A.第一电离能: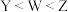 |
| B.Y的氢化物沸点不一定低于W的氢化物 |
C.电负性: |
| D.M在不同条件下与氧气反应的产物阴阳离子个数比不同 |
您最近一年使用:0次
2023-01-19更新
|
566次组卷
|
4卷引用:陕西省宝鸡市渭滨区2023-2024学年高二上学期期末考试化学试题
名校
4 . 下列对有关事实的解释错误的是
| 选项事实 | 解释 | |
| A | 酸性:CF3COOH>CH3COOH | F电负性更大使羟基极性变强 |
| B | 金刚石的熔点高于单晶硅 | 金刚石的C-C比单晶硅的Si-Si键能大 |
| C | 稳定性:H2O>H2S | H-O键的键能比H-S键的键能大 |
| D | SiO2的熔点比干冰高 | SiO2比CO2相对分子质量大,分子间作用力大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-03-26更新
|
348次组卷
|
2卷引用:陕西省汉中市洋县中学2023-2024学年高二下学期期中考试化学试题
名校
5 . 现有四种元素,其中两种元素基态原子的电子排布式如下:①1s22s22p63s23p2②1s22s22p63s23p3,另两种元素的价电子排布式为③2s22p3④2s22p4,则下列有关比较中正确的是
| A.原子半径:①>②>④>③ | B.第一电离能:④>③>②>① |
| C.电负性: ④>③>②>① | D.最高正化合价:④>③=②>① |
您最近一年使用:0次
2024-04-08更新
|
272次组卷
|
2卷引用:陕西省宝鸡市金台区2023-2024学年高二上学期期末检测化学试题
6 . 下列关于分子的结构和性质的描述中,正确的是
| A.对羟基苯甲酸的熔点比邻羟基苯甲酸的熔点低 |
| B.氨分子间有氢键,故气态氨分子的热稳定性比水蒸气的高 |
| C.碘易溶于浓碘化钾溶液,甲烷难溶于水都可用“相似相溶”原理解释 |
| D.氟的电负性大于氯的电负性,导致三氟乙酸的酸性大于三氯乙酸的酸性 |
您最近一年使用:0次
名校
解题方法
7 . 对Na、Mg、Al的有关性质的叙述中,正确的是
| A.金属性:Na<Mg<Al | B.电负性:Na<Mg<Al |
| C.第一电离能:Na<Mg<Al | D.还原性:Mg<Al<Na |
您最近一年使用:0次
2022-01-26更新
|
566次组卷
|
5卷引用:陕西省咸阳市武功县普集高级中学2023-2024学年高二下学期3月第一次月考化学试题
名校
解题方法
8 . 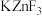 被认为是良好的光学基质材料,可由
被认为是良好的光学基质材料,可由 、
、 、
、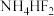 制备。回答下列问题:
制备。回答下列问题:
(1)基态Zn原子的价电子轨道表达式为___________ ;基态N原子中未成对电子数为___________ 。
(2)O的第一电离能小于N的第一电离能的原因是___________ ;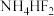 的组成元素中电负性由大到小的顺序为
的组成元素中电负性由大到小的顺序为___________ (用元素符号表示)。
(3) 中阴离子的空间构型为
中阴离子的空间构型为___________ ;其中C原子的杂化方式为___________ 。
(4) 具有金红石型四方结构,
具有金红石型四方结构,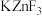 具有钙钛矿型立方结构,两种晶体的晶胞结构如图所示:
具有钙钛矿型立方结构,两种晶体的晶胞结构如图所示:
① 和
和 晶体中,Zn的配位数之比为
晶体中,Zn的配位数之比为___________ 。
②若 表示阿伏加德罗常数的值,则
表示阿伏加德罗常数的值,则 晶体的密度为
晶体的密度为___________  (用含a、c、
(用含a、c、 的代数式表示)。
的代数式表示)。
 被认为是良好的光学基质材料,可由
被认为是良好的光学基质材料,可由 、
、 、
、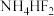 制备。回答下列问题:
制备。回答下列问题:(1)基态Zn原子的价电子轨道表达式为
(2)O的第一电离能小于N的第一电离能的原因是
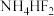 的组成元素中电负性由大到小的顺序为
的组成元素中电负性由大到小的顺序为(3)
 中阴离子的空间构型为
中阴离子的空间构型为(4)
 具有金红石型四方结构,
具有金红石型四方结构,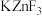 具有钙钛矿型立方结构,两种晶体的晶胞结构如图所示:
具有钙钛矿型立方结构,两种晶体的晶胞结构如图所示:
①
 和
和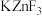 晶体中,Zn的配位数之比为
晶体中,Zn的配位数之比为②若
 表示阿伏加德罗常数的值,则
表示阿伏加德罗常数的值,则 晶体的密度为
晶体的密度为 (用含a、c、
(用含a、c、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2024-01-08更新
|
234次组卷
|
2卷引用:2024届陕西省商洛市高三上学期尖子生学情诊断考试理综试题
9 . X、Y、Z、Q、R是元素周期表前四周期元素,且原子序数依次增大;X原子核外有6种不同运动状态的电子;Y原子的最外层电子数比次外层电子数多3个;基态Z原子的 能级成对电子数的对数与未成对电子数相等;Q电子总数是最外层电子数的3倍;R是用量最大、使用最广泛的金属。下列说法正确的是
能级成对电子数的对数与未成对电子数相等;Q电子总数是最外层电子数的3倍;R是用量最大、使用最广泛的金属。下列说法正确的是
 能级成对电子数的对数与未成对电子数相等;Q电子总数是最外层电子数的3倍;R是用量最大、使用最广泛的金属。下列说法正确的是
能级成对电子数的对数与未成对电子数相等;Q电子总数是最外层电子数的3倍;R是用量最大、使用最广泛的金属。下列说法正确的是A.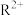 的价电子排布式为 的价电子排布式为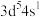 | B.电负性:X>Y>Z |
| C.最简单氢化物的稳定性:Y>Q | D.X的氢化物中只含有σ键 |
您最近一年使用:0次
名校
解题方法
10 . 下列说法不正确的是
| A.电负性:N> P>Li |
B.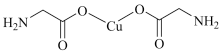 中σ键和 中σ键和 键比例为7:1 键比例为7:1 |
C.N2与 互为等电子体, 互为等电子体, 中含有的 中含有的 键数目为 键数目为 |
D.C 中的所有原子均共面 中的所有原子均共面 |
您最近一年使用:0次
2023-04-08更新
|
245次组卷
|
3卷引用:陕西省西安市西北工业大学附属中学2023-2024学年高二上学期期末质量检化学试题



