解题方法
1 . 回答下列问题:
(1)麻醉剂的发现和使用是人类医学史上一项了不起的成就。一种常用麻醉剂氯仿常因保存不慎而被氧化,产生剧毒光气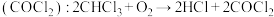 ,光气
,光气 分子的立体构型是
分子的立体构型是________ 形。
(2)某有机物的结构简式为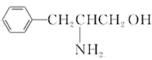 。该有机物分子是
。该有机物分子是____________ (填“极性”或“非极性”)分子,该有机物分子中采取 杂化的原子对应元素的电负性由大到小的顺序为
杂化的原子对应元素的电负性由大到小的顺序为____________ 。
(3)乙二胺 分子中氮原子杂化类型为
分子中氮原子杂化类型为_________________ 。
(4)叠氮化合物是一类重要的化合物,其中氢叠氮酸( )是一种弱酸,其分子结构可表示为
)是一种弱酸,其分子结构可表示为 ,肼
,肼 被亚硝酸氧化时便可得到氢叠氮酸
被亚硝酸氧化时便可得到氢叠氮酸 ,发生的反应为
,发生的反应为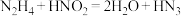 。
。 的酸性和醋酸相近,可微弱电离出
的酸性和醋酸相近,可微弱电离出 和
和 。
。
①叠氮酸根能与许多金属离子等形成配合物,如 ,根据价层电子对互斥理论判断
,根据价层电子对互斥理论判断 的空间构型为
的空间构型为________________ 。
②下列有关说法正确的是_____________ (填序号)。
A. 中含有5个
中含有5个 键
键
B. 中的三个氮原子均采用
中的三个氮原子均采用 杂化
杂化
C. 、
、 、
、 、
、 都是极性分子
都是极性分子
D.肼 的沸点高达
的沸点高达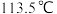 ,说明肼分子间可形成氢键
,说明肼分子间可形成氢键
(1)麻醉剂的发现和使用是人类医学史上一项了不起的成就。一种常用麻醉剂氯仿常因保存不慎而被氧化,产生剧毒光气
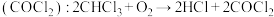 ,光气
,光气 分子的立体构型是
分子的立体构型是(2)某有机物的结构简式为
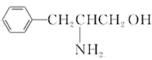 。该有机物分子是
。该有机物分子是 杂化的原子对应元素的电负性由大到小的顺序为
杂化的原子对应元素的电负性由大到小的顺序为(3)乙二胺
 分子中氮原子杂化类型为
分子中氮原子杂化类型为(4)叠氮化合物是一类重要的化合物,其中氢叠氮酸(
 )是一种弱酸,其分子结构可表示为
)是一种弱酸,其分子结构可表示为 ,肼
,肼 被亚硝酸氧化时便可得到氢叠氮酸
被亚硝酸氧化时便可得到氢叠氮酸 ,发生的反应为
,发生的反应为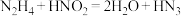 。
。 的酸性和醋酸相近,可微弱电离出
的酸性和醋酸相近,可微弱电离出 和
和 。
。①叠氮酸根能与许多金属离子等形成配合物,如
 ,根据价层电子对互斥理论判断
,根据价层电子对互斥理论判断 的空间构型为
的空间构型为②下列有关说法正确的是
A.
 中含有5个
中含有5个 键
键B.
 中的三个氮原子均采用
中的三个氮原子均采用 杂化
杂化C.
 、
、 、
、 、
、 都是极性分子
都是极性分子D.肼
 的沸点高达
的沸点高达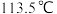 ,说明肼分子间可形成氢键
,说明肼分子间可形成氢键
您最近一年使用:0次
2024-03-27更新
|
58次组卷
|
2卷引用:陕西省韩城市象山中学2023-2024学年高二下学期第一次月考化学试题
名校
解题方法
2 . 铜是人类最早使用的金属之一,铜的使用对早期人类文明的进步影响深远。回答下列问题:
(1)基态Cu2+的价电子排布式为___________ 。
(2)已知铜的某种配合物A的结构如图所示:
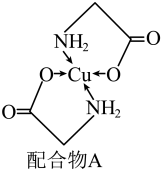
①A中所含的三种元素C、N、O的电负性由大到小的顺序为___________ 。
②配合物中氮原子的杂化轨道类型为___________ 。
③配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,CO2是___________ (填“极性”或“非极性”)分子。
(3)铜盐是自然界中重要的盐,CuSO4中SO 的立体构型为
的立体构型为___________ ;Cu(NO3)2中的化学键类型为___________ 。
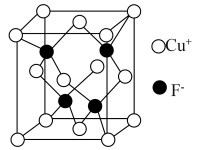
(4)CuF的晶胞结构如图所示。在CuF晶体中距离Cu+最近的F-有___________ 个。已知CuF的密度为7.1g/cm3,则CuF的晶胞参数a=___________ nm(列出计算式)。
(1)基态Cu2+的价电子排布式为
(2)已知铜的某种配合物A的结构如图所示:

①A中所含的三种元素C、N、O的电负性由大到小的顺序为
②配合物中氮原子的杂化轨道类型为
③配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,CO2是
(3)铜盐是自然界中重要的盐,CuSO4中SO
 的立体构型为
的立体构型为(4)CuF的晶胞结构如图所示。在CuF晶体中距离Cu+最近的F-有

您最近一年使用:0次
2023-12-31更新
|
144次组卷
|
2卷引用:2024届陕西省西安市第一中学高三上学期12月月考理综试卷
解题方法
3 . 将氟气通入氢氧化钠溶液中,可得OF2.OF2是一种无色、几乎无味的剧毒气体,主要用于氧化氟化反应、火箭工程助燃剂等。请回答下列问题:
(1)OF2中O的化合价为_______ ,OF2中O原子的杂化轨道类型是_______ ,OF2分子的空间构型为_______ 。
(2)与H2O分子相比,OF2分子的键角更_______ (填“大”或“小”)。
(3)与H2O分子相比,OF2分子的极性更_______ (填“大” 或“小”),原因是_______ ;
(4)OF2 在常温下就能与干燥空气反应生成二氧化氮和无色气体氟化氮,该反应的化学方程式为(已知反应中N2与O2的物质的量之比为4:1)_______ 。
(1)OF2中O的化合价为
(2)与H2O分子相比,OF2分子的键角更
(3)与H2O分子相比,OF2分子的极性更
(4)OF2 在常温下就能与干燥空气反应生成二氧化氮和无色气体氟化氮,该反应的化学方程式为(已知反应中N2与O2的物质的量之比为4:1)
您最近一年使用:0次
2023-11-22更新
|
350次组卷
|
2卷引用:陕西省榆林市第十中学2023-2024学年高二下学期第一次质量检测化学试题
名校
解题方法
4 . 已知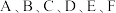 是原子序数依次增大的前四周期元素。其中
是原子序数依次增大的前四周期元素。其中 是宇宙中含量最多的元素;
是宇宙中含量最多的元素; 元素原子最高能级的不同轨道都有电子,并且自旋方向相同;
元素原子最高能级的不同轨道都有电子,并且自旋方向相同; 元素原子的价层电子排布式为
元素原子的价层电子排布式为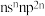 ;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;
;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子; 与
与 的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。下列说法正确的是
的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。下列说法正确的是
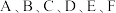 是原子序数依次增大的前四周期元素。其中
是原子序数依次增大的前四周期元素。其中 是宇宙中含量最多的元素;
是宇宙中含量最多的元素; 元素原子最高能级的不同轨道都有电子,并且自旋方向相同;
元素原子最高能级的不同轨道都有电子,并且自旋方向相同; 元素原子的价层电子排布式为
元素原子的价层电子排布式为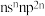 ;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;
;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子; 与
与 的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。下列说法正确的是
的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。下列说法正确的是A.A、B、C三种元素的电负性: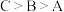 |
B.B、C、D、E四种元素的第一电离能: |
C.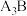 的稳定性大于 的稳定性大于 |
D. 的常见离子的核外电子排布图为 的常见离子的核外电子排布图为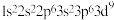 |
您最近一年使用:0次
2023-09-17更新
|
212次组卷
|
2卷引用:陕西省榆林市第十中学2023-2024学年高二下学期第一次质量检测化学试题
名校
解题方法
5 . 对Na、Mg、Al的有关性质的叙述中,正确的是
| A.金属性:Na<Mg<Al | B.电负性:Na<Mg<Al |
| C.第一电离能:Na<Mg<Al | D.还原性:Mg<Al<Na |
您最近一年使用:0次
2022-01-26更新
|
581次组卷
|
5卷引用:陕西省咸阳市武功县普集高级中学2023-2024学年高二下学期3月第一次月考化学试题
名校
解题方法
6 . X、Y、Z、W四种元素为短周期元素,它们在元素周期表中的相对位置如图所示,已知W的最高正价与最低负价代数和为6,下列说法正确的是
| X | Y | |
| Z | W |
| A.单质的沸点:Y>Z | B.元素电负性:W>Z |
| C.元素第一电离能:Y>X | D.简单氢化物的稳定性:Z>Y |
您最近一年使用:0次
2021-08-03更新
|
174次组卷
|
4卷引用:陕西省渭南市华州区咸林中学2023-2024学年高二下学期第一次月考化学试题
陕西省渭南市华州区咸林中学2023-2024学年高二下学期第一次月考化学试题四川省南充市阆中中学校2023-2024学年高二下学期3月月考化学试卷重庆市第八中学校 2020-2021学年高二下学期第一次月考化学试题(已下线)第1.2.2讲 元素周期律-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)
解题方法
7 . 超分子化学已逐渐扩展到化学的各个分支,还扩展到生命科学和物理学等领域。由Mo将2个C60分子、2个p-甲酸丁酯吡啶及2个CO分子利用配位键自组装的超分子结构如图所示。___________ ;核外未成对电子数是___________ 个。
(2)该超分子中存在的化学键类型有___________ 。
A σ键Bπ键C离子键D氢键
(3)该超分子中配体CO提供孤电子对的原子是___________ (填元素符号),p-甲酸丁酯吡啶配体中C原子的杂化方式有___________ 。
(4)从电负性角度解释CF3COOH的酸性强于CH3COOH的原因___________ 。
(5)C60与金刚石互为同素异形体,从结构与性质之间的关系解释C60的熔点远低于金刚石的原因是___________ 。
(6)已知:某晶胞中各原子的相对位置可用如图所示的原子坐标表示,其中所有顶点原子坐标均为(0,0,0)。___________ 。已知该晶体的密度是ρg·cm-3,Mo的摩尔质量是M g·mol-1,阿伏伽德罗常数是NA,晶体中距离最近的Mo原子核之间的距离为___________ pm。

(2)该超分子中存在的化学键类型有
A σ键Bπ键C离子键D氢键
(3)该超分子中配体CO提供孤电子对的原子是
(4)从电负性角度解释CF3COOH的酸性强于CH3COOH的原因
(5)C60与金刚石互为同素异形体,从结构与性质之间的关系解释C60的熔点远低于金刚石的原因是
(6)已知:某晶胞中各原子的相对位置可用如图所示的原子坐标表示,其中所有顶点原子坐标均为(0,0,0)。

您最近一年使用:0次
2019-04-23更新
|
5695次组卷
|
3卷引用:陕西省西安市选课分科摸底考2023-2024学年高二下学期4月月考化学试题



