名校
解题方法
1 . 卤化金能与亚乙基硫脲形成盐,结构如下图所示。其中X代表卤素原子,W元素丰度最大的一种核素原子核内无中子,M、Y、Z的原子半径依次减小,且M的最高正价与最低负价代数和为4。下列说法不正确 的是
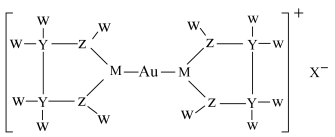

A.简单氢化物的键角: |
| B.M最外层电子有6种空间运动状态 |
| C.该盐中Y、Z、M均达到8电子稳定结构 |
D.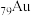 在元素周期表的位置为第六周期第ⅠB族 在元素周期表的位置为第六周期第ⅠB族 |
您最近一年使用:0次
名校
解题方法
2 . 化合物A是含有草酸根( )的铜配合物(结构如下图),可加热分解制备Cu纳米颗粒。请回答以下相关问题:
)的铜配合物(结构如下图),可加热分解制备Cu纳米颗粒。请回答以下相关问题:
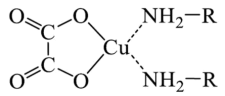
(1)草酸根中C原子的杂化方式为_______ 。
(2)上述的C、H、O、N四种元素中,第一电离能由小到大的顺序为_______ (用元素符号回答,下同),其中,第一电离能最大的元素的原子的价层电子的轨道表达式(电子排布图)为_______ ,该元素第一电离能较大的原因是_______ 。
(3)该配合物加热会生成一种气体,该气体与N2O是等电子体,其分子构型为_______ 。
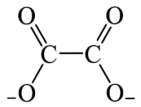
(4)草酸根( )的结构如下图所示,其中σ键和π键的比例为
)的结构如下图所示,其中σ键和π键的比例为_______ 。
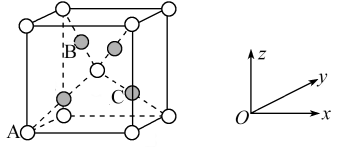
(5)在一定温度加热配合物会生成Cu2O,其中基态Cu+的价层电子排布式为_______ 。Cu2O的晶胞如下图所示,若A原子的坐标参数为(0,0,0),C原子的坐标参数为( ,
, ,
, ),则B原子的坐标参数为
),则B原子的坐标参数为_______ 。若最近的两个O2-的距离为anm,阿伏加德罗常数为NA,则该晶体的密度为_______ g·cm-3。
 )的铜配合物(结构如下图),可加热分解制备Cu纳米颗粒。请回答以下相关问题:
)的铜配合物(结构如下图),可加热分解制备Cu纳米颗粒。请回答以下相关问题:
(1)草酸根中C原子的杂化方式为
(2)上述的C、H、O、N四种元素中,第一电离能由小到大的顺序为
(3)该配合物加热会生成一种气体,该气体与N2O是等电子体,其分子构型为
(4)草酸根(
 )的结构如下图所示,其中σ键和π键的比例为
)的结构如下图所示,其中σ键和π键的比例为
(5)在一定温度加热配合物会生成Cu2O,其中基态Cu+的价层电子排布式为
 ,
, ,
, ),则B原子的坐标参数为
),则B原子的坐标参数为
您最近一年使用:0次
名校
3 . 下列叙述中正确的是
| A.NH3、CO、CO2都是极性分子 | B.CH4、CCl4均为含极性键的非极性分子 |
| C.CS2、H2O、C2H2都是直线型分子 | D.HF、HCl、HBr、HI的稳定性依次增强 |
您最近一年使用:0次
2023-01-20更新
|
234次组卷
|
2卷引用:重庆市西南大学附属中学校2022-2023学年高二上学期开学定时训练化学试题(广延班)
名校
解题方法
4 . 砷化镓(GaAs)是优良的半导体材料,可用于制作太阳能电池。 是合成GaAs的原料之一,其中Ga与Al同族,As与N同族。下列叙述正确的是
是合成GaAs的原料之一,其中Ga与Al同族,As与N同族。下列叙述正确的是
 是合成GaAs的原料之一,其中Ga与Al同族,As与N同族。下列叙述正确的是
是合成GaAs的原料之一,其中Ga与Al同族,As与N同族。下列叙述正确的是A.电负性: | B. 中含有 中含有 键 键 |
C. 分子为平面三角形 分子为平面三角形 | D.基态Ga和As原子的未成对电子数相同 |
您最近一年使用:0次
2022-12-22更新
|
1106次组卷
|
5卷引用:重庆市南开中学校2022-2023学年高二下学期开学考试化学试题
重庆市南开中学校2022-2023学年高二下学期开学考试化学试题广东省广州市2023届高三年级调研测试化学试题广东省广州市2022-2023学年高三上学期12月调研考试化学试题湖北省2022-2023学年高三上学期期末考试化学试题(已下线)回归教材重难点12 原子、分子和晶体结构再归纳-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)
名校
解题方法
5 . Ⅰ、由CO2、甲醇为原料合成绿色化学品碳酸二甲酯(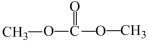 )的过程如图,请回答下列问题:
)的过程如图,请回答下列问题:
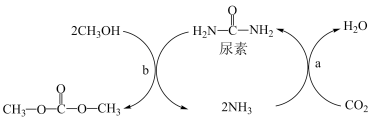
(1)下列说法不正确的是___________ (填字母)。
A.上述过程a中,从反应物到产物,C和N元素的杂化方式均保持不变
B.NH3极易溶解在水中,只因氨分子与水分子间形成了氢键
C.尿素的沸点比碳酸二甲酯的高,主要原因为前者能形成分子间氢键,而后者不能形成分子间氢键
Ⅱ、硫元素在化合物中常表现出多种化合价,它的许多化合物在研究和生产中有许多重要用途。回答下列问题:
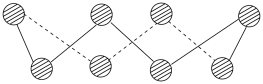
(2)S单质的常见形式为S8,其环状结构如图所示,S原子的杂化轨道类型是___________ 。
(3) 的电子式是
的电子式是___________ ,依据 理论推测
理论推测 的空间构型为
的空间构型为___________ ,常温下 是气体而
是气体而 是液体的原因是
是液体的原因是___________ 。
(4) 的键角
的键角___________  的键角(填“大于”或“小于”),理由是
的键角(填“大于”或“小于”),理由是___________ 。
(5) 在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方
在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方 晶体结构如图所示。
晶体结构如图所示。
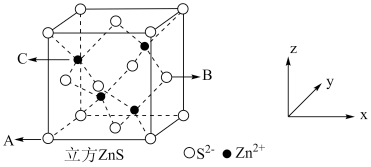
①已知A、B点的原子坐标分别为 和
和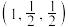 ,则C点的原子坐标为
,则C点的原子坐标为___________ ;
②若晶胞棱长为 ,密度为
,密度为___________  (
( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
 )的过程如图,请回答下列问题:
)的过程如图,请回答下列问题:
(1)下列说法不正确的是
A.上述过程a中,从反应物到产物,C和N元素的杂化方式均保持不变
B.NH3极易溶解在水中,只因氨分子与水分子间形成了氢键
C.尿素的沸点比碳酸二甲酯的高,主要原因为前者能形成分子间氢键,而后者不能形成分子间氢键
Ⅱ、硫元素在化合物中常表现出多种化合价,它的许多化合物在研究和生产中有许多重要用途。回答下列问题:
(2)S单质的常见形式为S8,其环状结构如图所示,S原子的杂化轨道类型是

(3)
 的电子式是
的电子式是 理论推测
理论推测 的空间构型为
的空间构型为 是气体而
是气体而 是液体的原因是
是液体的原因是(4)
 的键角
的键角 的键角(填“大于”或“小于”),理由是
的键角(填“大于”或“小于”),理由是(5)
 在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方
在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方 晶体结构如图所示。
晶体结构如图所示。
①已知A、B点的原子坐标分别为
 和
和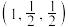 ,则C点的原子坐标为
,则C点的原子坐标为②若晶胞棱长为
 ,密度为
,密度为 (
( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
您最近一年使用:0次
2022-09-05更新
|
353次组卷
|
6卷引用:重庆市育才中学校2023届高三上学期开学测试化学试题
名校
6 . 在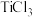 的饱和溶液中通入
的饱和溶液中通入 至饱和,再加入乙醚生成绿色晶体,如果不加入乙醚,直接通入
至饱和,再加入乙醚生成绿色晶体,如果不加入乙醚,直接通入 得到的是紫色晶体,已知两种晶体分子式均为
得到的是紫色晶体,已知两种晶体分子式均为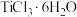 ,配位数都是6的配合物,分别取
,配位数都是6的配合物,分别取 两种晶体在水溶液中用过量
两种晶体在水溶液中用过量 处理,绿色晶体得到的白色沉淀质量为紫色晶体得到沉淀质量的
处理,绿色晶体得到的白色沉淀质量为紫色晶体得到沉淀质量的 ,则下列有关说祛不正确的是
,则下列有关说祛不正确的是
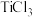 的饱和溶液中通入
的饱和溶液中通入 至饱和,再加入乙醚生成绿色晶体,如果不加入乙醚,直接通入
至饱和,再加入乙醚生成绿色晶体,如果不加入乙醚,直接通入 得到的是紫色晶体,已知两种晶体分子式均为
得到的是紫色晶体,已知两种晶体分子式均为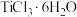 ,配位数都是6的配合物,分别取
,配位数都是6的配合物,分别取 两种晶体在水溶液中用过量
两种晶体在水溶液中用过量 处理,绿色晶体得到的白色沉淀质量为紫色晶体得到沉淀质量的
处理,绿色晶体得到的白色沉淀质量为紫色晶体得到沉淀质量的 ,则下列有关说祛不正确的是
,则下列有关说祛不正确的是| A.该绿色晶体配体是氯离子和水,它们物质的量之比为1∶5 |
B.绿色晶体配合物的化学式为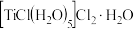 |
C. 紫色晶体中包含的 紫色晶体中包含的 键个数为 键个数为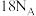 |
D. 紫色晶体在水溶液中与过量 紫色晶体在水溶液中与过量 作用最多可得到 作用最多可得到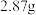 沉淀 沉淀 |
您最近一年使用:0次
2022-09-05更新
|
454次组卷
|
5卷引用:重庆市育才中学校2023届高三上学期开学测试化学试题
名校
解题方法
7 . 下列说法正确的是
A. 的 的 模型为四面体形,属于极性分子 模型为四面体形,属于极性分子 |
B. 中σ键类型为“头碰头”形式形成的 中σ键类型为“头碰头”形式形成的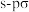 键和 键和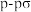 键 键 |
C. 的空间构型为正四面体形,键角是 的空间构型为正四面体形,键角是 |
D.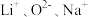 的离子半径依次增大 的离子半径依次增大 |
您最近一年使用:0次
2022-09-05更新
|
277次组卷
|
4卷引用:重庆市育才中学校2023届高三上学期开学测试化学试题
名校
8 .  是阿伏加德罗常数的值,下列说法正确的是
是阿伏加德罗常数的值,下列说法正确的是
 是阿伏加德罗常数的值,下列说法正确的是
是阿伏加德罗常数的值,下列说法正确的是A. 的盐酸含有阴离子总数为 的盐酸含有阴离子总数为 |
B. 中 中 杂化的原子数为2 杂化的原子数为2 |
C.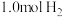 和 和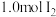 在密闭容器中充分反应后其分子总数小于2 在密闭容器中充分反应后其分子总数小于2 |
D.1mol重水比1mol水多 个质子 个质子 |
您最近一年使用:0次
2022-08-26更新
|
314次组卷
|
3卷引用:重庆八中2022-2023学年高三上学期入学考试化学试题
解题方法
9 . 2021年我国科学家在高效且稳定的全无机CsPbX3(X=Cl,Br,I)太阳能电池研究领域取得进展。
(1)写出基态Pb原子的外围电子排布图______ ,基态Cs原子核外共有______ 种不同运动状态的电子。
(2)I-可与I2形成 ,
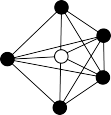
, 中心原于的价层电子对数为
中心原于的价层电子对数为______ ,已知其VSEPR模型为三角双锥形(如图),则 的立体构型名称为
的立体构型名称为_______ 。
(3)化合物PCl5,、PBr5固态时均为离子晶体,其组成分别为[PCl4]+[PCl6]-、[PBr4]+Br-,分析PBr5中不存在类似[PCl6]-结构的原因:___________ 。
(4)卤素还可与金属形成丰富多彩的配合物,如与Pt(II)形成Pt(NH3)2Cl2.Pt(NH3)2Cl2有两种同分异构体(如图),其中顺铂是1969年发现的第一种具有抗癌活性的金属配合物,其配体为___________ ,推测在水中的溶解度顺铂___________ 反铂(填“>”或“<”)。

(5)CsPbI3晶体具有钙钛矿型的立方结构(如图),晶体中Cs+的配位数为___________ ,已知该晶体的密度为dg/cm3,阿伏加德罗常数值为NA,则晶胞参数a为___________ nm。
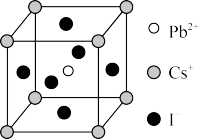
(6)CsPbI3晶胞结构的另一种表示中Cs+处于体心位置,则Pb2+处于______ 位置,I-处于______ 位置。
(1)写出基态Pb原子的外围电子排布图
(2)I-可与I2形成
 ,
, 中心原于的价层电子对数为
中心原于的价层电子对数为 的立体构型名称为
的立体构型名称为
(3)化合物PCl5,、PBr5固态时均为离子晶体,其组成分别为[PCl4]+[PCl6]-、[PBr4]+Br-,分析PBr5中不存在类似[PCl6]-结构的原因:
(4)卤素还可与金属形成丰富多彩的配合物,如与Pt(II)形成Pt(NH3)2Cl2.Pt(NH3)2Cl2有两种同分异构体(如图),其中顺铂是1969年发现的第一种具有抗癌活性的金属配合物,其配体为

(5)CsPbI3晶体具有钙钛矿型的立方结构(如图),晶体中Cs+的配位数为

(6)CsPbI3晶胞结构的另一种表示中Cs+处于体心位置,则Pb2+处于
您最近一年使用:0次
名校
解题方法
10 . 二茂铁(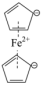 )分子式为
)分子式为 ,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
(1)Fe在周期表中的___________ 区,受热后Fe的1个4s电子会跃迁至4p轨道,写出Fe的该激发态电子排布式:[Ar]___________ 。
(2)铁系元素能与CO形成Fe(CO)5、Ni(CO)5等金属羰基化合物,已知室温下Fe(CO)5为浅黄色液体,沸点为103℃,则Fe(CO)5中含有的化学键类型包括___________ ,1mol Fe(CO)5分子中含有___________ mol σ键。
A.离子键B.极性共价键C.配位键D.金属键
(3)二茂铁的衍生物可和H3O+等微粒产生静电作用,H、O和C的电负性由大到小的顺序为___________ ;H3O+中氧原子的杂化方式为___________ ,H3O+空间构型为___________ 。
(4)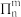 表示处于同一平面上的n个原子共用m个电子形成的大Π键,当
表示处于同一平面上的n个原子共用m个电子形成的大Π键,当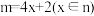 时,
时,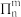 较稳定(又叫4x+2规则)。已知C5H5Θ中所有碳原子均共平面,写出C5H5Θ(
较稳定(又叫4x+2规则)。已知C5H5Θ中所有碳原子均共平面,写出C5H5Θ( )的大Π键:
)的大Π键:___________ 。
(5)T-碳是碳的一种同素异形体,其晶体结构可以看成是金刚石晶体(如图甲)中每个碳原子被一个由四个碳原子组成的正四面体结构单元( )所取代(如图乙)。
)所取代(如图乙)。
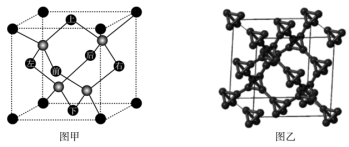
一个T-碳晶胞中含有___________ 个碳原子,已知T-碳的密度约为金刚石的一半。则T-碳晶胞的边长和金刚石晶胞的边长之比为___________ 。
 )分子式为
)分子式为 ,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。(1)Fe在周期表中的
(2)铁系元素能与CO形成Fe(CO)5、Ni(CO)5等金属羰基化合物,已知室温下Fe(CO)5为浅黄色液体,沸点为103℃,则Fe(CO)5中含有的化学键类型包括
A.离子键B.极性共价键C.配位键D.金属键
(3)二茂铁的衍生物可和H3O+等微粒产生静电作用,H、O和C的电负性由大到小的顺序为
(4)
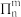 表示处于同一平面上的n个原子共用m个电子形成的大Π键,当
表示处于同一平面上的n个原子共用m个电子形成的大Π键,当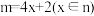 时,
时,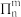 较稳定(又叫4x+2规则)。已知C5H5Θ中所有碳原子均共平面,写出C5H5Θ(
较稳定(又叫4x+2规则)。已知C5H5Θ中所有碳原子均共平面,写出C5H5Θ( )的大Π键:
)的大Π键:(5)T-碳是碳的一种同素异形体,其晶体结构可以看成是金刚石晶体(如图甲)中每个碳原子被一个由四个碳原子组成的正四面体结构单元(
 )所取代(如图乙)。
)所取代(如图乙)。
一个T-碳晶胞中含有
您最近一年使用:0次



