解题方法
1 . 硫代硫酸钠(Na2S2O3)是常见的分析试剂和还原剂,常温下为无色晶体,易溶于水,遇酸反应。某学习小组在实验室制备Na2S2O3并探究其性质。回答下列问题:
实验I:利用高温加热绿矾(FeSO4•7H2O)生成的SO2气体制备Na2S2O3的实验装置如图所示。

已知:i.2FeSO4•7H2O Fe2O3+SO2↑+SO3↑+14H2O↑;
Fe2O3+SO2↑+SO3↑+14H2O↑;
ii.2Na2S+2Na2CO3+4SO2+H2O=3Na2S2O3+2NaHCO3;
iii.Na2S和Na2CO3的混合溶液用煮沸过的蒸馏水配制。

(1)依据FeSO4•7H2O的结构示意图
①比较键角H2O_____ SO (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②FeSO4•7H2O晶体中含有的化学键为_____ (填标号)。
a.离子键 b.共价键 c.氢键 d.配位键
(2)实验过程的操作步骤包括:
a.检查装置气密性,加入药品
b.在m处连接盛有NaOH溶液的容器,关闭活塞K3,打开活塞K1、K2通入一段时间N2
c.打开活塞K1、K2,关闭活塞K3,通入一段时间N2
d.C装置溶液pH约为8时停止加热
e.关闭活塞K1、K2,打开活塞K3,加热绿矾
f.将锥形瓶中溶液进行一系列操作,得到纯净的Na2S2O3晶体
①以上步骤按先后顺序的正确排序为a→______ →f(填标号)。
②B装置中使用冰水浴的作用是_____ 。
③C装置溶液pH约为8时停止加热的原因是_____ 。
实验Ⅱ:探究Na2S2O3的性质
小组同学查阅资料获得信息:Na2S2O3中硫元素的化合价分别为-2价和+6价。
实验步骤:用实验I获得的Na2S2O3晶体配制0.2mol/LNa2S2O3溶液,取出4mL,向溶液中加入1mL饱和氯水(pH=2.4),溶液立即出现浑浊,对溶液出现浑浊的原因提出假设。
假设1:氯水中Cl2氧化了Na2S2O3中的-2价硫生成S单质
假设2:Na2S2O3在酸性(H+)条件下反应生成S单质
(3)实验验证:a、b试管均盛有4mL0.2mol/LNa2S2O3溶液,操作如图所示。

①向试管b中滴加的试剂应为______ 。
②依据现象分析,出现浑浊的主要原因是_____ (用离子方程式表示)。
实验I:利用高温加热绿矾(FeSO4•7H2O)生成的SO2气体制备Na2S2O3的实验装置如图所示。

已知:i.2FeSO4•7H2O
 Fe2O3+SO2↑+SO3↑+14H2O↑;
Fe2O3+SO2↑+SO3↑+14H2O↑;ii.2Na2S+2Na2CO3+4SO2+H2O=3Na2S2O3+2NaHCO3;
iii.Na2S和Na2CO3的混合溶液用煮沸过的蒸馏水配制。

(1)依据FeSO4•7H2O的结构示意图
①比较键角H2O
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②FeSO4•7H2O晶体中含有的化学键为
a.离子键 b.共价键 c.氢键 d.配位键
(2)实验过程的操作步骤包括:
a.检查装置气密性,加入药品
b.在m处连接盛有NaOH溶液的容器,关闭活塞K3,打开活塞K1、K2通入一段时间N2
c.打开活塞K1、K2,关闭活塞K3,通入一段时间N2
d.C装置溶液pH约为8时停止加热
e.关闭活塞K1、K2,打开活塞K3,加热绿矾
f.将锥形瓶中溶液进行一系列操作,得到纯净的Na2S2O3晶体
①以上步骤按先后顺序的正确排序为a→
②B装置中使用冰水浴的作用是
③C装置溶液pH约为8时停止加热的原因是
实验Ⅱ:探究Na2S2O3的性质
小组同学查阅资料获得信息:Na2S2O3中硫元素的化合价分别为-2价和+6价。
实验步骤:用实验I获得的Na2S2O3晶体配制0.2mol/LNa2S2O3溶液,取出4mL,向溶液中加入1mL饱和氯水(pH=2.4),溶液立即出现浑浊,对溶液出现浑浊的原因提出假设。
假设1:氯水中Cl2氧化了Na2S2O3中的-2价硫生成S单质
假设2:Na2S2O3在酸性(H+)条件下反应生成S单质
(3)实验验证:a、b试管均盛有4mL0.2mol/LNa2S2O3溶液,操作如图所示。

①向试管b中滴加的试剂应为
②依据现象分析,出现浑浊的主要原因是
您最近一年使用:0次
真题
名校
2 . 科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是
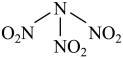

| A.分子中N、O间形成的共价键是非极性键 |
| B.分子中四个氮原子共平面 |
| C.该物质既有氧化性又有还原性 |
D.15.2g该物资含有6.02× 个原子 个原子 |
您最近一年使用:0次
2019-01-30更新
|
1467次组卷
|
38卷引用:2011年普通高等学校招生全国统一考试化学卷(安徽)
2011年普通高等学校招生全国统一考试化学卷(安徽)(已下线)2012届湖北省襄阳五中高三上学期期中考试化学试卷(已下线)2013届江西省九江市第一中学高三入学考试化学试卷(已下线)2015届江西省南昌市三校高三上第一次联考化学试卷2020高三总复习二轮复习——物质结构与性质复习卷山东省滕州市第一中学2020届高三3月线上模拟考试化学试题(已下线)上海市奉贤区2013年高考二模化学试题(已下线)2011-2012学年浙江省杭州十四中高二上学期期末化学试卷(已下线)2011-2012学年江苏省重点中学高二5月质量检测化学试卷(已下线)2011-2012学年福建省三明一中高二下学期第一次月考化学试卷(已下线)2012-2013学年四川省成都七中高二10月阶段性考试化学试卷(已下线)2012--2013学年新疆乌鲁木齐市一中高二下学期期中考试化学试卷(特长班)(已下线)2012-2013学年四川省昭觉中学高二10月月考化学试卷(已下线)2012-2013学年江苏省启东中学高二下学期期中考试化学试卷(已下线)2013-2014甘肃省兰州一中下学期期中考试高二化学试卷(已下线)2013-2014甘肃省兰州一中下学期期中考试高二化学试卷(已下线)2013届新疆乌鲁木齐市一中高二下学期特长班期中考试化学试卷2014-2015宁夏银川市唐徕回民中学高二下学期3月月考化学试卷2014-2015福建省长泰县第一中学高二下学期期中化学试卷(A)2016-2017学年安徽省六安市第一中学高二下学期第一次阶段检测化学试卷甘肃省兰州第一中学2016-2017学年高一下学期期中考试化学试题河北省唐山市曹妃甸区第一中学2016-2017学年高二下学期期末考试化学试题河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第二章 综合检测2安徽省定远重点中学2017-2018学年高一下学期第一次月考化学试题福建省长汀一中2017-2018学年高二实验班下学期第一次月考化学试题【全国百强校】黑龙江省实验中学2017-2018学年高二下学期期中考试(理)化学试题贵州省六盘水盘县四中2017-2018学年高二下学期期末考试化学试题(已下线)2019年3月10日 《每日一题》人教选修3-每周一测上海市交通大学附属中学2018-2019学年高一下学期期中考试化学试题山西省平遥中学校2018-2019学年高二下学期第二次月考化学试题(已下线)上海交大附中2018-2019学年高一下学期期中化学试题云南省金平县第一中学2019-2020学年高二上学期期末考试化学试题苏教版高一化学必修2专题一第二单元第二课时《共价键》(夯基提能)安徽省六安市舒城中学2019-2020学年高二下学期第一次月考化学试题黑龙江省哈尔滨市阿城区龙涤中学2020-2021学年高二4月月考化学试题重庆市第七中学校2021-2022学年高一下学期3月月考化学试题福建省德化第一中学2021-2022学年高二下学期第一次质检化学试题安徽省青阳县第一中学2021-2022学年高二下学期3月月考化学试卷
真题
解题方法
3 . 常温下,二氧化氯(ClO2)是一种黄绿色气体,具有强氧化性,已被联合国卫生组织(WTO)列为Al级高效安全消毒剂。已知,工业上制备二氧化氯的方法之一是用甲醇在酸性条件下与氯酸钠反应,其反应的化学方程式:CH3OH+6NaClO3+3H2SO4=CO2↑+6ClO2↑+3Na2SO4+5H2O,则下列说法正确的是
| A.CO2是非极性分子 |
B.键角:ClO <ClO <ClO |
| C.NaClO3在反应中做还原剂 |
| D.ClO2分子空间构型为直线形 |
您最近一年使用:0次
2024-04-07更新
|
1343次组卷
|
4卷引用:2023年天津市高考化学试卷
2023年天津市高考化学试卷(已下线)通关练07 原子、分子、晶体结构再归纳-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)(已下线)选择题1-6广东省肇庆市加美学校2023-2024学年高二下学期竞赛化学试题
名校
4 . 近年来一些近海的煤电厂利用海水微碱性(8.0≤pH≤8.3)开发海水脱硫新工艺。主要原理是:工业烟气中的SO2与海水生成H2SO3,H2SO3被进一步氧化成SO 。脱硫后海水酸性增强,与新鲜海水中的CO
。脱硫后海水酸性增强,与新鲜海水中的CO 和HCO
和HCO 反应,最终烟气中的SO2大部分以硫酸盐的形式排入大海。下列有关SO3、SO2、CO2的说法正确的是
反应,最终烟气中的SO2大部分以硫酸盐的形式排入大海。下列有关SO3、SO2、CO2的说法正确的是
 。脱硫后海水酸性增强,与新鲜海水中的CO
。脱硫后海水酸性增强,与新鲜海水中的CO 和HCO
和HCO 反应,最终烟气中的SO2大部分以硫酸盐的形式排入大海。下列有关SO3、SO2、CO2的说法正确的是
反应,最终烟气中的SO2大部分以硫酸盐的形式排入大海。下列有关SO3、SO2、CO2的说法正确的是| A.SO3的空间构型为平面正三角形 | B.键角:CO2>SO2>SO3 |
| C.SO2中硫原子的杂化轨道类型是sp3 | D.CO2、SO2都是非极性分子 |
您最近一年使用:0次
2023-05-09更新
|
219次组卷
|
3卷引用:不定项选择题
解题方法
5 . 重铬酸钾( ),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为
),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为 ,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备
,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备 的步骤如下:
的步骤如下:
步骤I.熔融氧化
将6g铬铁矿与4g氯酸钾在研钵中混合均匀,取碳酸钠和氢氧化钠各4.5g于仪器A中混匀后,小火熔融,再将矿粉分批加入坩埚中并不断搅拌。用煤气灯强热,灼烧30~35min,稍冷几分钟,加水,过滤,得滤液i,滤渣中含红棕色固体。
步骤Ⅱ.中和除杂
将滤液i用稀硫酸调pH为7~8,加热煮沸3min后,趁热过滤,用少量蒸馏水洗涤残渣,得滤液ii。
步骤Ⅲ.结晶
将滤液ii转移至蒸发皿中,用6 硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。
硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。
步骤Ⅳ.纯度测定
利用库仑滴定法测定 固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算
固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算 的浓度公式为
的浓度公式为 (F为96500
(F为96500 ,N为1个
,N为1个 转化为
转化为 时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度
时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度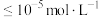 ,则认为该微粒已除尽。
,则认为该微粒已除尽。

回答下列问题:
(1)仪器A为_______(填标号)。
(2)若用 代替
代替 ,则理论上转化1mol
,则理论上转化1mol  所需
所需 的体积(标准状况,单位为L)是所消耗
的体积(标准状况,单位为L)是所消耗 物质的量的
物质的量的_______ 倍。
(3)步骤I中“分批加入”的目的是_______ 。
(4)若步骤Ⅱ中“调pH至3~4”的不良后果是_______ 。
(5)进一步提纯步骤Ⅲ所得晶体的方法是_______ 。
(6)探究pH对 溶液的氧化性强弱的影响。
溶液的氧化性强弱的影响。
(7) 与浓盐酸反应可制得
与浓盐酸反应可制得 ,已知部分卤素单质的键能如下表:
,已知部分卤素单质的键能如下表:
试解释键能 的原因
的原因_______ 。
(8) 固体样品的纯度为
固体样品的纯度为_______ (用含m的式子表示)。
 ),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为
),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为 ,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备
,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备 的步骤如下:
的步骤如下:步骤I.熔融氧化
将6g铬铁矿与4g氯酸钾在研钵中混合均匀,取碳酸钠和氢氧化钠各4.5g于仪器A中混匀后,小火熔融,再将矿粉分批加入坩埚中并不断搅拌。用煤气灯强热,灼烧30~35min,稍冷几分钟,加水,过滤,得滤液i,滤渣中含红棕色固体。
步骤Ⅱ.中和除杂
将滤液i用稀硫酸调pH为7~8,加热煮沸3min后,趁热过滤,用少量蒸馏水洗涤残渣,得滤液ii。
步骤Ⅲ.结晶
将滤液ii转移至蒸发皿中,用6
 硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。
硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。步骤Ⅳ.纯度测定
利用库仑滴定法测定
 固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算
固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算 的浓度公式为
的浓度公式为 (F为96500
(F为96500 ,N为1个
,N为1个 转化为
转化为 时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度
时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度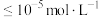 ,则认为该微粒已除尽。
,则认为该微粒已除尽。
回答下列问题:
(1)仪器A为_______(填标号)。
| A.普通坩埚 | B. 坩埚 坩埚 | C.氮化硅坩埚 | D.石英坩埚 |
 代替
代替 ,则理论上转化1mol
,则理论上转化1mol  所需
所需 的体积(标准状况,单位为L)是所消耗
的体积(标准状况,单位为L)是所消耗 物质的量的
物质的量的(3)步骤I中“分批加入”的目的是
(4)若步骤Ⅱ中“调pH至3~4”的不良后果是
(5)进一步提纯步骤Ⅲ所得晶体的方法是
(6)探究pH对
 溶液的氧化性强弱的影响。
溶液的氧化性强弱的影响。| 实验操作 | 实验现象 | 实验结论 |
向酸化的 溶液中加入一定量甲醇 溶液中加入一定量甲醇 | 溶液形成蓝紫色溶液,并产生无色无味的气体 | |
向碱化的 溶液中加入相同量甲醇 溶液中加入相同量甲醇 | 酸性条件下 溶液的氧化性更强 溶液的氧化性更强 |
 与浓盐酸反应可制得
与浓盐酸反应可制得 ,已知部分卤素单质的键能如下表:
,已知部分卤素单质的键能如下表:| 化学键 | F-F | C1-Cl | Br-Br |
键能/( ) ) | 157 | 242.7 | 193.7 |
 的原因
的原因(8)
 固体样品的纯度为
固体样品的纯度为
您最近一年使用:0次
解题方法
6 . 下列对物质性质的解释不合理的是
选项 | 性质 | 解释 |
A | 熔点:晶体硅>白磷 | 晶体硅属于共价晶体、白磷属于分子晶体 |
B | 密度:干冰>冰 |  的分子量大于 的分子量大于 的,干冰中分子采取密堆积排列,冰中分子采取非密堆积排列 的,干冰中分子采取密堆积排列,冰中分子采取非密堆积排列 |
C | 酸性: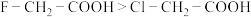 | 电负性: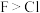 |
D | 氧化性: | 键能: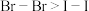 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
7 . 在日常生活中,为了达到更好的清洁效果,经常有人会将洁厕液(含有盐酸)与84消毒液混合使用,从而会发生引发中毒的事故。
(1)两种日化产品主要成分中都含有氯元素,该元素在元素周期表中位置是_______ 。
(2)84消毒液的主要成分是次氯酸钠,写出次氯酸钠的电子式:_______ 。
(3)洁厕灵的主要成分是HCl。下列关于卤化氢的性质比较中错误的是_______。
(4)常温下,0.1mol/L的NaClO溶液的PH=9.7,原因_______ 。常温下HClO的电离平衡常数为_______ 。洁厕液与84消毒液混合后会生成有毒的氯气。写出该反应的离子方程式_______ 。
(5)高铁酸钾是一种高效多功能水处理剂,工业上常采用NaClO氧化法生产,反应原理为:
①在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4,该反应的离子反应方程式为_______ 。
②Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH=K2FeO4+2NaOH
K2FeO4在水溶液中易水解:4 +10H2O⇌4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
+10H2O⇌4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用_______ 溶液(填序号)
a.水 b.NH4Cl、异丙醇 c.Fe(NO3)3、异丙醇 d.CH3COONa、异丙醇
(6)消毒效率是物质单位质量得到的电子数,则Cl2与NaClO两种消毒剂的消毒效率之比为__ 。
(1)两种日化产品主要成分中都含有氯元素,该元素在元素周期表中位置是
(2)84消毒液的主要成分是次氯酸钠,写出次氯酸钠的电子式:
(3)洁厕灵的主要成分是HCl。下列关于卤化氢的性质比较中错误的是_______。
| A.酸性:HF>HCl>HBr>HI | B.键能:H—F>H—Cl>H—Br>H—I |
| C.熔点:HF<HCl<HBr<HI | D.还原性:HF<HCl<HBr<HI |
(5)高铁酸钾是一种高效多功能水处理剂,工业上常采用NaClO氧化法生产,反应原理为:
①在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4,该反应的离子反应方程式为
②Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH=K2FeO4+2NaOH
K2FeO4在水溶液中易水解:4
 +10H2O⇌4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
+10H2O⇌4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用a.水 b.NH4Cl、异丙醇 c.Fe(NO3)3、异丙醇 d.CH3COONa、异丙醇
(6)消毒效率是物质单位质量得到的电子数,则Cl2与NaClO两种消毒剂的消毒效率之比为
您最近一年使用:0次
名校
解题方法
8 . 氮是一种重要的化工原料,主要用于化肥工业,也广泛用于硝酸、纯碱、制药等工业;合成氨反应中,N2(g)与H2(g)反应生成1molNH3(g)放出46kJ的热量,实验室用加热NH4Cl和Ca(OH)2固体混合物的方法制取少量氨气,同时生成CaCl2。肼(N2H4)是一种良好的液体燃料。下列物质结构与性质或物质性质与用途具有对应关系的是
| A.N2分子内含有N≡N,N2具有氧化性 |
| B.NH3极易溶于水,液氨可用作制冷剂 |
| C.NH3分子之间形成氢键,NH3(g)的热稳定性比PH3(g)的高 |
| D.N2H4具有还原性,可用作喷气式发动机的燃料 |
您最近一年使用:0次
解题方法
9 . 维生素C具有还原性,在酸性溶液中可以被Fe3+等氧化剂氧化为脱氢维生素C(已知:阿伏加德罗常数的值为NA)。下列有关说法错误的是


| A.脱氢维生素C中,键角①=键角② |
| B.脱氢维生素C分子中含有3种官能团 |
| C.1mol维生素C中含σ键数目为20NA |
| D.维生素C与Fe3+发生氧化还原反应时,1mol维生素C被氧化转移的电子数为2NA |
您最近一年使用:0次
名校
10 . 蔬菜和水果中富含维生素C,维生素C具有还原性,在酸性溶液中可以被 等氧化剂氧化为脱氢维生素C(已知:阿伏加德罗常数的值为
等氧化剂氧化为脱氢维生素C(已知:阿伏加德罗常数的值为 )。下列有关说法错误的是
)。下列有关说法错误的是
 等氧化剂氧化为脱氢维生素C(已知:阿伏加德罗常数的值为
等氧化剂氧化为脱氢维生素C(已知:阿伏加德罗常数的值为 )。下列有关说法错误的是
)。下列有关说法错误的是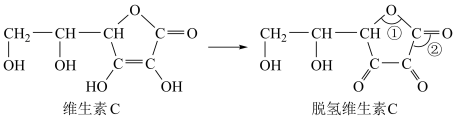
| A.脱氢维生素C中,键角①<键角② |
| B.维生素C分子中含有2个手性碳原子 |
C. 维生素C中含 维生素C中含 键数目为 键数目为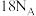 |
D.维生素C与 发生氧化还原反应时, 发生氧化还原反应时, 维生素C被氧化转移的电子数为 维生素C被氧化转移的电子数为 |
您最近一年使用:0次
2024-01-30更新
|
468次组卷
|
4卷引用:河北省武邑中学2023-2024学年高三上学期三模化学试题



