名校
1 . 很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物Ⅱ。化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的是
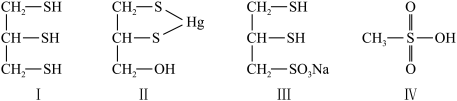

| A.在Ⅲ中键角∠CCC是180° | B.H-S键的极性比H-O键的极性大 |
| C.在I中S原子采取sp3杂化 | D.在Ⅳ中硫氧键的键能均相等 |
您最近半年使用:0次
名校
2 . 高压发电系统常用SF6作为绝缘气体,该气体分子呈正八面体结构(如图所示)。下列有关SF6的说法错误的是
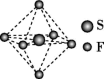

| A.是非极性分子 |
| B.键角∠FSF都等于90° |
| C.S与F之间共用电子对偏向F |
| D.基态硫原子的电子排布式为1s22s22p63s23p4 |
您最近半年使用:0次
名校
解题方法
3 . 抗癌药阿霉素与环糊精在水溶液中形成超分子包合物,结构如下图,增大了阿霉素的水溶性,控制了阿霉素的释放速度,从而提高药效。下列说法错误的是
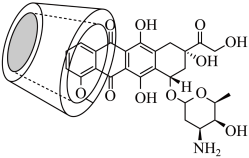
| A.阿霉素分子中碳原子的杂化方式为sp3、sp2 |
| B.可以通过晶体的X射线衍射实验获得阿霉素分子的键长和键角 |
| C.阿霉素与环糊精通过共价键结合形成超分子包合物 |
| D.阿霉素分子中含有手性碳原子 |
您最近半年使用:0次
2024-02-19更新
|
361次组卷
|
3卷引用:陕西师范大学附属中学2023-2024学年高二上学期期末考试化学试题
4 . 下列事实不能通过比较氟元素和氯元素的电负性进行解释的是
| A.氟化氢分子的极性强于氯化氢分子的极性 |
B. 键的键能小于 键的键能小于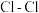 键的键能 键的键能 |
C.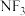 的键角比 的键角比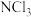 的小 的小 |
D.气态氟化氢中存在 ,而气态氯化氢中是 ,而气态氯化氢中是 分子 分子 |
您最近半年使用:0次
2024-02-19更新
|
174次组卷
|
3卷引用:河北正定中学本部2023-2024学年高二上学期期末考试化学试题
名校
解题方法
5 . 钛被称为继铁、铝之后的第三金属,性能优越,广泛用于航天航空等领域,有人说“21世纪将是钛的世纪”。冶炼金属钛的主要原料为钛铁矿(主要成分FeTiO3,含FeO、Fe2O3等杂质),其冶炼过程如图所示,除了得到金属钛,还可以得到副产物绿矾(FeSO4·7H2O)。
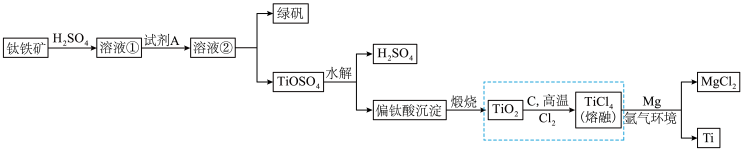
(1)Ti在元素周期表中的位置为___________ , 的键角
的键角___________ H2O分子的键角(填 “>”“<”或“=”)。
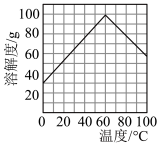
(2)试剂A为___________ 。已知绿矾的溶解度随温度变化的曲线如图所示,从溶液②获得绿矾的操作方法为___________ 、过滤、洗涤、干燥。
(3)已知常温下,Ksp[Fe(OH)2]=8×10-16,若溶液②中c(Fe2+)=0.5mol/L,为防止生成Fe(OH)2沉淀,溶液的pH不超过___________ (lg2=0.3)。
(4)TiOSO4水解生成偏钛酸(H2TiO3)沉淀的化学方程式为___________ 。
(5)TiCl4的水解程度很大,可以利用其稀溶液制备纳米级TiO2·xH2O,该反应的化学方程式为___________ 。

(1)Ti在元素周期表中的位置为
 的键角
的键角(2)试剂A为

(3)已知常温下,Ksp[Fe(OH)2]=8×10-16,若溶液②中c(Fe2+)=0.5mol/L,为防止生成Fe(OH)2沉淀,溶液的pH不超过
(4)TiOSO4水解生成偏钛酸(H2TiO3)沉淀的化学方程式为
(5)TiCl4的水解程度很大,可以利用其稀溶液制备纳米级TiO2·xH2O,该反应的化学方程式为
您最近半年使用:0次
名校
6 . 工业中可利用生产钛白的副产物 和硫铁矿(
和硫铁矿( )联合制备铁精粉(
)联合制备铁精粉( )和硫酸,实现能源及资源的有效利用。
)和硫酸,实现能源及资源的有效利用。
(1) 结构示意图如图。
结构示意图如图。

①基态O原子的核外电子轨道表示式___________ 。
② 的价层电子排布式为
的价层电子排布式为___________ 。
③与O和S同主族的Se元素基态原子的简化电子排布式为___________ 。
(2)O与同周期的C、N三种元素的第一电离能由小到大的顺序是___________ 。
(3) 中含有
中含有 和
和 两种粒子。
两种粒子。
① 分子的空间结构为
分子的空间结构为___________ 。
② 中O和
中O和 中S均为
中S均为___________ 杂化,已知 中H-O-H键角小于
中H-O-H键角小于 中O-S-O键角,请解释原因
中O-S-O键角,请解释原因___________ 。
(4) 加热脱水后生成
加热脱水后生成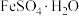 ,再与
,再与 在氧气中掺烧可联合制备铁精粉和硫酸。
在氧气中掺烧可联合制备铁精粉和硫酸。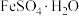 分解和
分解和 在氧气中燃烧的能量示意图如图,利用
在氧气中燃烧的能量示意图如图,利用 作为
作为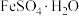 分解的燃料,除反应产物是铁精粉和制硫酸的原料外,从能源利用的角度说明该工艺的优点
分解的燃料,除反应产物是铁精粉和制硫酸的原料外,从能源利用的角度说明该工艺的优点___________ 。

 和硫铁矿(
和硫铁矿( )联合制备铁精粉(
)联合制备铁精粉( )和硫酸,实现能源及资源的有效利用。
)和硫酸,实现能源及资源的有效利用。(1)
 结构示意图如图。
结构示意图如图。
①基态O原子的核外电子轨道表示式
②
 的价层电子排布式为
的价层电子排布式为③与O和S同主族的Se元素基态原子的简化电子排布式为
(2)O与同周期的C、N三种元素的第一电离能由小到大的顺序是
(3)
 中含有
中含有 和
和 两种粒子。
两种粒子。①
 分子的空间结构为
分子的空间结构为②
 中O和
中O和 中S均为
中S均为 中H-O-H键角小于
中H-O-H键角小于 中O-S-O键角,请解释原因
中O-S-O键角,请解释原因(4)
 加热脱水后生成
加热脱水后生成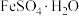 ,再与
,再与 在氧气中掺烧可联合制备铁精粉和硫酸。
在氧气中掺烧可联合制备铁精粉和硫酸。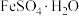 分解和
分解和 在氧气中燃烧的能量示意图如图,利用
在氧气中燃烧的能量示意图如图,利用 作为
作为 分解的燃料,除反应产物是铁精粉和制硫酸的原料外,从能源利用的角度说明该工艺的优点
分解的燃料,除反应产物是铁精粉和制硫酸的原料外,从能源利用的角度说明该工艺的优点
您最近半年使用:0次
名校
解题方法
7 . 很多含巯基(―SH)的有机化合物是重金属元素汞的解毒剂,如化合物Ⅰ、Ⅱ(结构如图)。下列说法正确的是
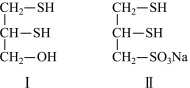

| A.在两个化合物中S原子均采取sp2杂化 |
| B.在两个化合物中C―C―C键角均是180° |
| C.两个化合物均为共价化合物 |
| D.化合物Ⅱ的水溶性好于化合物Ⅰ |
您最近半年使用:0次
8 . 下列有关说法正确的是
A.第一电离能: |
B.键角: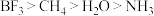 |
C.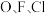 电负性由大到小的顺序为 电负性由大到小的顺序为 |
D. 溶于水和干冰升华都只有分子间作用力改变 溶于水和干冰升华都只有分子间作用力改变 |
您最近半年使用:0次
名校
解题方法
9 . “证据推理与模型认知”是化学学科核心素养之一,下列说法错误的是
A. 中心原子杂化方式是 中心原子杂化方式是 ,可以推测 ,可以推测 中心原子杂化方式也是 中心原子杂化方式也是 |
B. 是直线形分子,可以推测 是直线形分子,可以推测 也是直线形分子 也是直线形分子 |
C. 分子中的键角小于 分子中的键角小于 ,可以推测 ,可以推测 分子中的键角比 分子中的键角比 分子中的键角更小 分子中的键角更小 |
| D.氯乙酸酸性强于乙酸,可以推测三氯乙酸酸性比氯乙酸酸性更强 |
您最近半年使用:0次
2024-02-14更新
|
269次组卷
|
2卷引用:湖北省恩施州高中教育联盟2023-2024学年高二上学期期末考试化学试题
名校
解题方法
10 . 物质的结构与性质遵循一定的规律,但也有“异常”情况,下列解释有误的是
| 选项 | 一般规律 | “异常”情况及解释 |
| A | 共价键有方向性 | 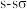 键无方向性,因为s原子轨道为球形 键无方向性,因为s原子轨道为球形 |
| B | 由同种原子构成的分子是非极性分子 |  是极性分子,因为 是极性分子,因为 分子中正负电荷中心不重合 分子中正负电荷中心不重合 |
| C | 同类型化学键,共价键键长越短,键能越大 | 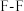 的键长比 的键长比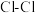 的短,但键能小,因为氟原子的半径小,两个氟原子形成共价键时,原子核之间的距离很近,斥力很大 的短,但键能小,因为氟原子的半径小,两个氟原子形成共价键时,原子核之间的距离很近,斥力很大 |
| D | 组成和结构相似的物质,相对分子质量越大,范德华力越大,熔、沸点越高 | 熔、沸点: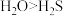 ,因为键能 ,因为键能 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2024-02-14更新
|
259次组卷
|
2卷引用:湖南省长沙市长郡中学2023-2024学年高二上学期期末考试化学试题



