解题方法
1 . 回答下列问题:
(1)1 mol CO2中含有的σ键数目为_______ ,π键数目为_______ 。
(2)CH4、NH3、H2O、HF分子中共价键的极性由强到弱的顺序是_______ 。
(3)铜原子的价层电子排布图:_______ ,写出钴的简化电子排布式_______ ,基态Fe2+与Fe3+离子中未成对的电子数之比为_______ 。
(4)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_______ 、_______ (填标号)。
A. B.
B. 
C.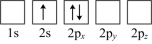 D.
D. 
(5)bte的分子式为C6H8N6,其结构简式如图所示:

①bte分子中碳原子轨道杂化类型为_______ 。
②1 mol bte分子中含σ键的数目为_______ mol。
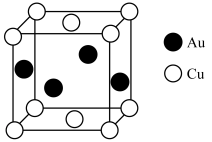
(6)一个Cu2O晶胞(见图)中,Cu原子的数目为_______ 。

(1)1 mol CO2中含有的σ键数目为
(2)CH4、NH3、H2O、HF分子中共价键的极性由强到弱的顺序是
(3)铜原子的价层电子排布图:
(4)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为
A.
 B.
B. 
C.
 D.
D. 
(5)bte的分子式为C6H8N6,其结构简式如图所示:

①bte分子中碳原子轨道杂化类型为
②1 mol bte分子中含σ键的数目为
(6)一个Cu2O晶胞(见图)中,Cu原子的数目为

您最近一年使用:0次
2 . 探索 和
和 这类化合物的特征及反应机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
这类化合物的特征及反应机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
I.CO可以与 反应制备合成天然气(SNG)。涉及反应如下:
反应制备合成天然气(SNG)。涉及反应如下:
 甲烷化:
甲烷化:
水煤气变换:
(1)反应 的
的
___________  。分别在
。分别在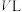 恒温密闭容器
恒温密闭容器 (恒容)、B(恒压,容积可变)中,加入
(恒容)、B(恒压,容积可变)中,加入 和
和 的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是
的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是___________ (填“A”或“B”)。
II. 可发生二聚反应生成
可发生二聚反应生成 ,化学方程式为
,化学方程式为 。该反应达到平衡后,升高温度可使体系颜色加深。
。该反应达到平衡后,升高温度可使体系颜色加深。
(2)已知该反应的正反应速率方程为v正=k正·c2(NO2),逆反应速率方程为v逆=k逆c·(N2O4),其中k正、k逆分别为正、逆反应的速率常数。如图(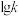 表示速率常数的对数:
表示速率常数的对数: 表示温度的倒数)所示①、②、③、④四条斜线中,
表示温度的倒数)所示①、②、③、④四条斜线中, 随
随 变化关系的是斜线③,则
变化关系的是斜线③,则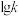 逆随
逆随 变化关系的是斜线
变化关系的是斜线___________ 。

(3)图中A、B、C、D点的纵坐标分别为 ,则
,则 温度时该反应的化学平衡常数
温度时该反应的化学平衡常数
___________  。已知
。已知 温度时,某时刻恒容密闭容器中
温度时,某时刻恒容密闭容器中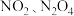 浓度均为
浓度均为 ,此时v正
,此时v正___________ v逆。(填“>”、“=”或“<”)
(4)工业上利用 溶液吸收
溶液吸收 气体,发生反应:
气体,发生反应: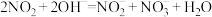 。
。 空间结构为
空间结构为___________ ,比较 与
与 的键角大小,并解释原因:
的键角大小,并解释原因:___________ 。
 和
和 这类化合物的特征及反应机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
这类化合物的特征及反应机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:I.CO可以与
 反应制备合成天然气(SNG)。涉及反应如下:
反应制备合成天然气(SNG)。涉及反应如下: 甲烷化:
甲烷化:
水煤气变换:

(1)反应
 的
的
 。分别在
。分别在 恒温密闭容器
恒温密闭容器 (恒容)、B(恒压,容积可变)中,加入
(恒容)、B(恒压,容积可变)中,加入 和
和 的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是
的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是II.
 可发生二聚反应生成
可发生二聚反应生成 ,化学方程式为
,化学方程式为 。该反应达到平衡后,升高温度可使体系颜色加深。
。该反应达到平衡后,升高温度可使体系颜色加深。(2)已知该反应的正反应速率方程为v正=k正·c2(NO2),逆反应速率方程为v逆=k逆c·(N2O4),其中k正、k逆分别为正、逆反应的速率常数。如图(
 表示速率常数的对数:
表示速率常数的对数: 表示温度的倒数)所示①、②、③、④四条斜线中,
表示温度的倒数)所示①、②、③、④四条斜线中, 随
随 变化关系的是斜线③,则
变化关系的是斜线③,则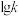 逆随
逆随 变化关系的是斜线
变化关系的是斜线
(3)图中A、B、C、D点的纵坐标分别为
 ,则
,则 温度时该反应的化学平衡常数
温度时该反应的化学平衡常数
 。已知
。已知 温度时,某时刻恒容密闭容器中
温度时,某时刻恒容密闭容器中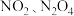 浓度均为
浓度均为 ,此时v正
,此时v正(4)工业上利用
 溶液吸收
溶液吸收 气体,发生反应:
气体,发生反应: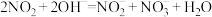 。
。 空间结构为
空间结构为 与
与 的键角大小,并解释原因:
的键角大小,并解释原因:
您最近一年使用:0次
名校
解题方法
3 . 卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
(1)属于氟原子激发态的电子排布式有_______ (填字母)。
a. b.
b. c.
c. d.
d.
(2)第三周期部分主族元素的氟化物的熔点(见表):
 比
比 熔点低的原因是
熔点低的原因是_______ 。
(3) 中心原子为
中心原子为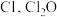 中心原子为O,二者均为V形结构,但
中心原子为O,二者均为V形结构,但 中存在大π键
中存在大π键 。
。 中
中 原子的轨道杂化方式为
原子的轨道杂化方式为_______ ;比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因_______ 。
(4) 与其他卤素单质反应可以形成卤素互化物,例如
与其他卤素单质反应可以形成卤素互化物,例如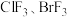 等。已知
等。已知 的键能为
的键能为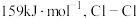 的键能为
的键能为 的键能为
的键能为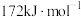 ,写出
,写出 和
和 生成
生成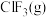 的热化学方程式
的热化学方程式_______ 。
(5)有机卤化铅晶体具有独特的光电性能,下图为其晶胞结构示意图。
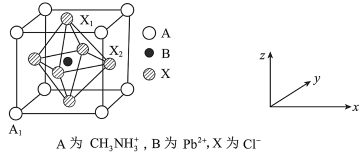
①原子坐标参数 为
为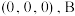 为
为 ,则
,则 为
为_______ 。
②在该晶胞的另一种表达方式中,若图中 处于顶点位置,则
处于顶点位置,则 处于
处于_______ 位置。
(6)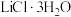 属于正交晶系(长方体形),晶胞参数为
属于正交晶系(长方体形),晶胞参数为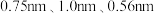 。下图为沿z轴投影的晶胞中所有氯原子的分布图和原子分数坐标。
。下图为沿z轴投影的晶胞中所有氯原子的分布图和原子分数坐标。
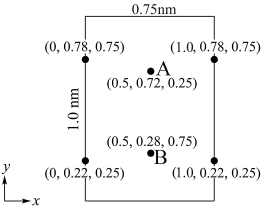
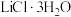 的摩尔质量为
的摩尔质量为 ,晶胞密度为
,晶胞密度为 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值 为
为_______  (列出计算式)。
(列出计算式)。
(1)属于氟原子激发态的电子排布式有
a.
 b.
b. c.
c. d.
d.
(2)第三周期部分主族元素的氟化物的熔点(见表):
| 化合物 |  |  |  |  |
| 熔点/℃ | 993 | 1040 | 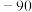 | 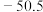 |
 比
比 熔点低的原因是
熔点低的原因是(3)
 中心原子为
中心原子为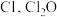 中心原子为O,二者均为V形结构,但
中心原子为O,二者均为V形结构,但 中存在大π键
中存在大π键 。
。 中
中 原子的轨道杂化方式为
原子的轨道杂化方式为 与
与 中
中 键的键长并说明原因
键的键长并说明原因(4)
 与其他卤素单质反应可以形成卤素互化物,例如
与其他卤素单质反应可以形成卤素互化物,例如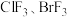 等。已知
等。已知 的键能为
的键能为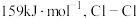 的键能为
的键能为 的键能为
的键能为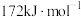 ,写出
,写出 和
和 生成
生成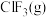 的热化学方程式
的热化学方程式(5)有机卤化铅晶体具有独特的光电性能,下图为其晶胞结构示意图。

①原子坐标参数
 为
为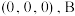 为
为 ,则
,则 为
为②在该晶胞的另一种表达方式中,若图中
 处于顶点位置,则
处于顶点位置,则 处于
处于(6)
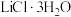 属于正交晶系(长方体形),晶胞参数为
属于正交晶系(长方体形),晶胞参数为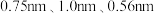 。下图为沿z轴投影的晶胞中所有氯原子的分布图和原子分数坐标。
。下图为沿z轴投影的晶胞中所有氯原子的分布图和原子分数坐标。
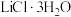 的摩尔质量为
的摩尔质量为 ,晶胞密度为
,晶胞密度为 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值 为
为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
名校
解题方法
4 . 甲硅烷 可用于制备多种新型无机非金属材料。
可用于制备多种新型无机非金属材料。
(1) 原子与
原子与 原子结合时,
原子结合时, 表现为正价,则电负性:
表现为正价,则电负性:
___________ H(填“>”“<”或“=”), 分子的空间结构为
分子的空间结构为___________ 。
(2)利用 与
与 反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。

①碳化硅晶体中每个 原子周围距离最近的
原子周围距离最近的 原子数目为
原子数目为________ , 的晶体类型是
的晶体类型是_______ 。
②基态 原子的价层电子轨道表达式为
原子的价层电子轨道表达式为___________ 。
(3)利用 与
与 可制得氮化硅(
可制得氮化硅( )材料。
)材料。
①热稳定性:
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
② 中
中 的键角
的键角___________  中
中 的键角(填“>”“<”或“=”),其键角差异的原因是
的键角(填“>”“<”或“=”),其键角差异的原因是___________ 。
 可用于制备多种新型无机非金属材料。
可用于制备多种新型无机非金属材料。(1)
 原子与
原子与 原子结合时,
原子结合时, 表现为正价,则电负性:
表现为正价,则电负性:
 分子的空间结构为
分子的空间结构为(2)利用
 与
与 反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
①碳化硅晶体中每个
 原子周围距离最近的
原子周围距离最近的 原子数目为
原子数目为 的晶体类型是
的晶体类型是②基态
 原子的价层电子轨道表达式为
原子的价层电子轨道表达式为(3)利用
 与
与 可制得氮化硅(
可制得氮化硅( )材料。
)材料。①热稳定性:

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②
 中
中 的键角
的键角 中
中 的键角(填“>”“<”或“=”),其键角差异的原因是
的键角(填“>”“<”或“=”),其键角差异的原因是
您最近一年使用:0次
名校
解题方法
5 . 氮化铬(CrN)熔点高、硬度大,常用作耐磨材料。周南化学兴趣小组在实验室用无水氯化铬(CrCl3)与氨气在高温下反应制备氮化铬,回答下列问题:
【实验一】制备无水氯化铬
反应原理为: ,相关实验装置如图(夹持装置略)。
,相关实验装置如图(夹持装置略)。
已知:① 的沸点是
的沸点是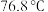 。
。
② 有毒,遇水发生水解反应。
有毒,遇水发生水解反应。
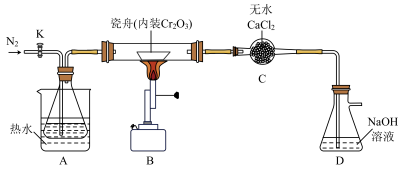
实验的主要操作步骤有:a.水浴加热并维持A的温度在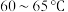 ;b.点燃B处酒精喷灯,使瓷舟温度升至
;b.点燃B处酒精喷灯,使瓷舟温度升至 左右,反应一定时间;c.打开K,通入
左右,反应一定时间;c.打开K,通入 并保证锥形瓶中每分钟有250个左右的气泡逸出;d.一段时间后停止通入
并保证锥形瓶中每分钟有250个左右的气泡逸出;d.一段时间后停止通入 ;e.先后停止加热A、B,冷却,并继续通入一段时间的
;e.先后停止加热A、B,冷却,并继续通入一段时间的 。
。
(1)上述操作步骤的先后顺序为:a→___________ 。
(2)D中盛有过量 溶液,用离子反应方程式说明D的作用:
溶液,用离子反应方程式说明D的作用:___________ 。
(3)比较 分子中键角大小:
分子中键角大小:
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
【实验二】制备氮化铬
周南化学兴趣小组设计如图装置在实验室制备氮化铬(加热及夹持装置略):

(4)a仪器的名称:___________ 。
(5)写出E中所发生反应的化学方程式:___________ 。
(6)F的作用为___________ 。
【实验三】测产品氮化铬的纯度
(7)向 所得产品中加入足量氢氧化钠溶液(杂质与氢氧化钠溶液不反应),然后通入水蒸气将氨气全部蒸出,将氨气用
所得产品中加入足量氢氧化钠溶液(杂质与氢氧化钠溶液不反应),然后通入水蒸气将氨气全部蒸出,将氨气用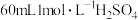 溶液完全吸收,剩余的硫酸用
溶液完全吸收,剩余的硫酸用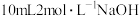 溶液恰好中和,则所得产品中氮化铬的纯度为
溶液恰好中和,则所得产品中氮化铬的纯度为___________ 。
【实验一】制备无水氯化铬
反应原理为:
 ,相关实验装置如图(夹持装置略)。
,相关实验装置如图(夹持装置略)。已知:①
 的沸点是
的沸点是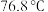 。
。 ②
 有毒,遇水发生水解反应。
有毒,遇水发生水解反应。
实验的主要操作步骤有:a.水浴加热并维持A的温度在
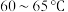 ;b.点燃B处酒精喷灯,使瓷舟温度升至
;b.点燃B处酒精喷灯,使瓷舟温度升至 左右,反应一定时间;c.打开K,通入
左右,反应一定时间;c.打开K,通入 并保证锥形瓶中每分钟有250个左右的气泡逸出;d.一段时间后停止通入
并保证锥形瓶中每分钟有250个左右的气泡逸出;d.一段时间后停止通入 ;e.先后停止加热A、B,冷却,并继续通入一段时间的
;e.先后停止加热A、B,冷却,并继续通入一段时间的 。
。(1)上述操作步骤的先后顺序为:a→
(2)D中盛有过量
 溶液,用离子反应方程式说明D的作用:
溶液,用离子反应方程式说明D的作用:(3)比较
 分子中键角大小:
分子中键角大小:
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。【实验二】制备氮化铬
周南化学兴趣小组设计如图装置在实验室制备氮化铬(加热及夹持装置略):

(4)a仪器的名称:
(5)写出E中所发生反应的化学方程式:
(6)F的作用为
【实验三】测产品氮化铬的纯度
(7)向
 所得产品中加入足量氢氧化钠溶液(杂质与氢氧化钠溶液不反应),然后通入水蒸气将氨气全部蒸出,将氨气用
所得产品中加入足量氢氧化钠溶液(杂质与氢氧化钠溶液不反应),然后通入水蒸气将氨气全部蒸出,将氨气用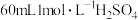 溶液完全吸收,剩余的硫酸用
溶液完全吸收,剩余的硫酸用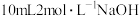 溶液恰好中和,则所得产品中氮化铬的纯度为
溶液恰好中和,则所得产品中氮化铬的纯度为
您最近一年使用:0次
2023-10-09更新
|
146次组卷
|
2卷引用:湖南省长沙市周南中学2024届高三上学期第三次阶段性测试化学试题
解题方法
6 . 铜可以形成许多结构和性质特殊的化合物或合金。回答下列问题:
(1)基态铜原子价电子的轨道表示式为___________ ;同周期中与铜原子未成对电子数相同的元素有___________ 种。
(2)含H2O2的稀硫酸溶解铜可得到CuSO4溶液,通入氨气先形成蓝色沉淀然后溶解得到深蓝色 溶液。
溶液。
①H、N、O、S四种元素的电负性由大到小的顺序为___________ ;其中第一电离能最大的为___________ (填元素名称)。
②液态NH3与液态H2O2中存在的分子间作用力类型___________ (填“完全相同”或“部分相同”);NH3分子中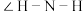 小于
小于 中的
中的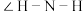 的原因为
的原因为___________ 。
③ 溶液中Cu2+的存在形式为
溶液中Cu2+的存在形式为 ,则铜的杂化方式可能为
,则铜的杂化方式可能为___________ (填标号)。
A. B.
B. C.
C. D.
D.
(3)已知: 为阿伏加德罗常数的值。铜与金(Au)可形成一种具有有序结构的储氢合金,其晶胞采取面心立方最密堆积方式,结构如图所示,该晶胞参数为anm。该合金晶胞密度为
为阿伏加德罗常数的值。铜与金(Au)可形成一种具有有序结构的储氢合金,其晶胞采取面心立方最密堆积方式,结构如图所示,该晶胞参数为anm。该合金晶胞密度为___________ g·cm-3(用含a、 的式子表示,列出计算式即可);晶胞中铜原子与金原子以原子数之比为1:1可以形成四面体,四面体空隙中填充氢原子后化学式为H4CuAu,则四面体空隙的填充率为
的式子表示,列出计算式即可);晶胞中铜原子与金原子以原子数之比为1:1可以形成四面体,四面体空隙中填充氢原子后化学式为H4CuAu,则四面体空隙的填充率为___________ 。
(1)基态铜原子价电子的轨道表示式为
(2)含H2O2的稀硫酸溶解铜可得到CuSO4溶液,通入氨气先形成蓝色沉淀然后溶解得到深蓝色
 溶液。
溶液。①H、N、O、S四种元素的电负性由大到小的顺序为
②液态NH3与液态H2O2中存在的分子间作用力类型
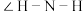 小于
小于 中的
中的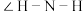 的原因为
的原因为③
 溶液中Cu2+的存在形式为
溶液中Cu2+的存在形式为 ,则铜的杂化方式可能为
,则铜的杂化方式可能为A.
 B.
B. C.
C. D.
D.
(3)已知:
 为阿伏加德罗常数的值。铜与金(Au)可形成一种具有有序结构的储氢合金,其晶胞采取面心立方最密堆积方式,结构如图所示,该晶胞参数为anm。该合金晶胞密度为
为阿伏加德罗常数的值。铜与金(Au)可形成一种具有有序结构的储氢合金,其晶胞采取面心立方最密堆积方式,结构如图所示,该晶胞参数为anm。该合金晶胞密度为 的式子表示,列出计算式即可);晶胞中铜原子与金原子以原子数之比为1:1可以形成四面体,四面体空隙中填充氢原子后化学式为H4CuAu,则四面体空隙的填充率为
的式子表示,列出计算式即可);晶胞中铜原子与金原子以原子数之比为1:1可以形成四面体,四面体空隙中填充氢原子后化学式为H4CuAu,则四面体空隙的填充率为
您最近一年使用:0次
7 . 卤素可形成许多结构和性质特殊的化合物。回答下列问题:
(1)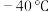 时,
时, 与冰反应生成
与冰反应生成 和
和 。常温常压下,
。常温常压下, 为无色气体,固态
为无色气体,固态 的晶体类型为
的晶体类型为_____ , 水解反应的产物为
水解反应的产物为_____ (填化学式)。
(2) 中心原子为
中心原子为 ,
, 中心原子为
中心原子为 ,二者均为
,二者均为 形结构,但
形结构,但 中存在大
中存在大 键
键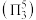 。
。 中
中 原子的轨道杂化方式
原子的轨道杂化方式_____ ;为 键角
键角_____  键角(填“>”“ <”或“=”)。比较
键角(填“>”“ <”或“=”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因_____ 。
(3)一定条件下, 和
和 反应生成
反应生成 和化合物
和化合物 。已知
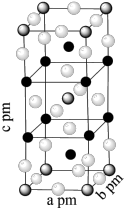
。已知 属于四方晶系,晶胞结构如图所示(晶胞参数
属于四方晶系,晶胞结构如图所示(晶胞参数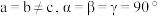 ),其中
),其中 化合价为
化合价为 。上述反应的化学方程式为
。上述反应的化学方程式为_____ 。若阿伏伽德罗常数的值为 ,化合物
,化合物 的密度
的密度
_____  (用含
(用含 的代数式表示)。
的代数式表示)。
(1)
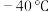 时,
时, 与冰反应生成
与冰反应生成 和
和 。常温常压下,
。常温常压下, 为无色气体,固态
为无色气体,固态 的晶体类型为
的晶体类型为 水解反应的产物为
水解反应的产物为(2)
 中心原子为
中心原子为 ,
, 中心原子为
中心原子为 ,二者均为
,二者均为 形结构,但
形结构,但 中存在大
中存在大 键
键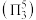 。
。 中
中 原子的轨道杂化方式
原子的轨道杂化方式 键角
键角 键角(填“>”“ <”或“=”)。比较
键角(填“>”“ <”或“=”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因(3)一定条件下,
 和
和 反应生成
反应生成 和化合物
和化合物 。已知
。已知 属于四方晶系,晶胞结构如图所示(晶胞参数
属于四方晶系,晶胞结构如图所示(晶胞参数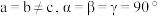 ),其中
),其中 化合价为
化合价为 。上述反应的化学方程式为
。上述反应的化学方程式为 ,化合物
,化合物 的密度
的密度
 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2023-06-19更新
|
10413次组卷
|
10卷引用:2023年高考山东卷化学真题
2023年高考山东卷化学真题(已下线)2023年高考山东卷化学真题变式题(结构与性质)(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)第11讲 氯气和卤族元素(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)(已下线)第20讲化学键(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用) 河南省南阳市第一中学校2024届高三上学期阶段检测化学试题(12月)
8 . 超纯 是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯
是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯 方面取得了显著成果,工业上以粗镓为原料,制备超纯
方面取得了显著成果,工业上以粗镓为原料,制备超纯 的工艺流程如下:
的工艺流程如下: 的化学性质和
的化学性质和 相似,
相似, 的熔点为
的熔点为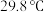 ;
;
② (乙醚)和
(乙醚)和 (三正辛胺)在上述流程中可作为配体;
(三正辛胺)在上述流程中可作为配体;
③相关物质的沸点:
回答下列问题:
(1)晶体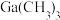 的晶体类型是
的晶体类型是_______ ;
(2)“电解精炼”装置如图所示,电解池温度控制在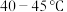 的原因是
的原因是_______ ,阴极的电极反应式为_______ ;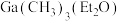 ”工序中的产物还包括
”工序中的产物还包括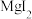 和
和 ,写出该反应的化学方程式:
,写出该反应的化学方程式:_______ ;
(4)“残渣”经纯水处理,能产生可燃性气体,该气体主要成分是_______ ;
(5)下列说法错误的是_______;
(6)直接分解 不能制备超纯
不能制备超纯 ,而本流程采用“配体交换”工艺制备超纯
,而本流程采用“配体交换”工艺制备超纯 的理由是
的理由是_______ ;
(7)比较分子中的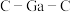 键角大小:
键角大小:
_______  (填“>”“<”或“=”),其原因是
(填“>”“<”或“=”),其原因是_______ 。
 是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯
是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯 方面取得了显著成果,工业上以粗镓为原料,制备超纯
方面取得了显著成果,工业上以粗镓为原料,制备超纯 的工艺流程如下:
的工艺流程如下: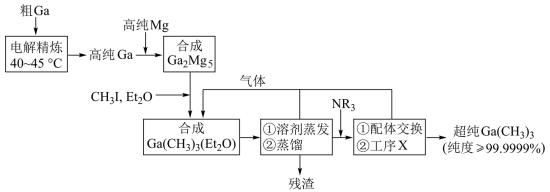
 的化学性质和
的化学性质和 相似,
相似, 的熔点为
的熔点为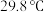 ;
;②
 (乙醚)和
(乙醚)和 (三正辛胺)在上述流程中可作为配体;
(三正辛胺)在上述流程中可作为配体;③相关物质的沸点:
| 物质 | 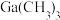 |  | 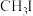 | 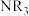 |
沸点/ | 55.7 | 34.6 | 42.4 | 365.8 |
(1)晶体
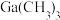 的晶体类型是
的晶体类型是(2)“电解精炼”装置如图所示,电解池温度控制在
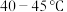 的原因是
的原因是
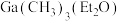 ”工序中的产物还包括
”工序中的产物还包括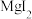 和
和 ,写出该反应的化学方程式:
,写出该反应的化学方程式:(4)“残渣”经纯水处理,能产生可燃性气体,该气体主要成分是
(5)下列说法错误的是_______;
A.流程中 得到了循环利用 得到了循环利用 |
B.流程中,“合成 ”至“工序X”需在无水无氧的条件下进行 ”至“工序X”需在无水无氧的条件下进行 |
C.“工序X”的作用是解配 ,并蒸出 ,并蒸出 |
D.用核磁共振氢谱不能区分 和 和 |
 不能制备超纯
不能制备超纯 ,而本流程采用“配体交换”工艺制备超纯
,而本流程采用“配体交换”工艺制备超纯 的理由是
的理由是(7)比较分子中的
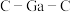 键角大小:
键角大小:
 (填“>”“<”或“=”),其原因是
(填“>”“<”或“=”),其原因是
您最近一年使用:0次
2023-06-16更新
|
10008次组卷
|
11卷引用:2023年高考湖南卷化学真题
2023年高考湖南卷化学真题(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)2023年湖南卷高考真题变式题(工业流程题)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)福建省厦门市 第一中学2023-2024上学期高三上学期12月考化学试题福建省漳州市华安县第一中学2023-2024学年高三上学期12月月考化学试题(已下线)题型四 无机化工流程题解题策略-备战2024年高考化学答题技巧与模板构建
名校
解题方法
9 . 氢能是一种极具发展潜力的清洁能源,下列物质都是具有广阔应用前景的储氢材料。按要求回答下列问题:
(1)氢化钠( )是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为
)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为___________ 。
(2)钛系贮氢合金中的钛锰合金具成本低,吸氢量大,室温下易活化等优点,基态钛的价层电子排布式为___________ 。
(3) (氨硼烷)具有很高的储氢容量及相对低的放氢温度(
(氨硼烷)具有很高的储氢容量及相对低的放氢温度(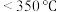 )而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、
)而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、 与
与 进行合成,则涉及的元素H、B、C、N、O电负性最大的是
进行合成,则涉及的元素H、B、C、N、O电负性最大的是___________ ,键角:
___________  (填“
(填“ ”或“
”或“ ”)。
”)。
(4)咔唑(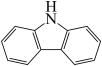 )是一种新型有机液体储氢材料,它的沸点比(
)是一种新型有机液体储氢材料,它的沸点比(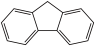 )的高,其主要原因是
)的高,其主要原因是___________ 。
(5)氢气的安全贮存和运输是氢能应用的关键,铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。
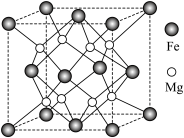
①距离 原子最近的
原子最近的 原子个数是
原子个数是___________ 。
②铁镁合金的化学式为___________ 。
③若该晶胞的晶胞边长为dnm,阿伏加德罗常数为NA,则该合金的密度为___________  。
。
④若该晶体储氢时, 分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下
分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下 的体积约为
的体积约为___________ L。
(1)氢化钠(
 )是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为
)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为(2)钛系贮氢合金中的钛锰合金具成本低,吸氢量大,室温下易活化等优点,基态钛的价层电子排布式为
(3)
 (氨硼烷)具有很高的储氢容量及相对低的放氢温度(
(氨硼烷)具有很高的储氢容量及相对低的放氢温度(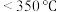 )而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、
)而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、 与
与 进行合成,则涉及的元素H、B、C、N、O电负性最大的是
进行合成,则涉及的元素H、B、C、N、O电负性最大的是
 (填“
(填“ ”或“
”或“ ”)。
”)。(4)咔唑(
 )是一种新型有机液体储氢材料,它的沸点比(
)是一种新型有机液体储氢材料,它的沸点比( )的高,其主要原因是
)的高,其主要原因是(5)氢气的安全贮存和运输是氢能应用的关键,铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。

①距离
 原子最近的
原子最近的 原子个数是
原子个数是②铁镁合金的化学式为
③若该晶胞的晶胞边长为dnm,阿伏加德罗常数为NA,则该合金的密度为
 。
。④若该晶体储氢时,
 分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下
分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下 的体积约为
的体积约为
您最近一年使用:0次
2023-05-25更新
|
345次组卷
|
3卷引用:天津市新华中学2023届高三二模化学试题
解题方法
10 . 氟在已知元素中电负性最大、非金属性最强,其单质在1886年才被首次分离出来。
(1)基态F原子的核外电子排布式为___________ 。
(2)氟氧化物 、
、 的结构已经确定。
的结构已经确定。
①依据数据推测O—O键的稳定性:
___________  (填“>”或“<”)。
(填“>”或“<”)。
② 中F—O—F键角小于
中F—O—F键角小于 中H—O—H键角,解释原因:
中H—O—H键角,解释原因:___________ 。
(3) 是一种有特殊性质的氢化物。
是一种有特殊性质的氢化物。
①已知:氢键(X—H…Y)中三原子在一条直线上时,作用力最强。测定结果表明, 固体中
固体中 分子排列为锯齿形,画出含2个
分子排列为锯齿形,画出含2个 的重复单元结构:
的重复单元结构:___________ 。
② 溶剂中加入
溶剂中加入 可以解离出
可以解离出 和具有正四面体形结构的阴离子,写出该过程的离子方程式:
和具有正四面体形结构的阴离子,写出该过程的离子方程式:___________ 。
(4)工业上用萤石(主要成分 )制备
)制备 。
。 晶体的一种立方晶胞如图所示。
晶体的一种立方晶胞如图所示。 晶体中距离
晶体中距离 最近的
最近的 有
有___________ 个。
②晶体中 与
与 的最近距离为
的最近距离为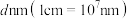 ),阿伏加德罗常数值为
),阿伏加德罗常数值为 。该晶体的密度
。该晶体的密度
___________  (列出计算式)。
(列出计算式)。
 |  | |
O—O键长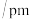 | 121 | 148 |
(2)氟氧化物
 、
、 的结构已经确定。
的结构已经确定。①依据数据推测O—O键的稳定性:

 (填“>”或“<”)。
(填“>”或“<”)。②
 中F—O—F键角小于
中F—O—F键角小于 中H—O—H键角,解释原因:
中H—O—H键角,解释原因:(3)
 是一种有特殊性质的氢化物。
是一种有特殊性质的氢化物。①已知:氢键(X—H…Y)中三原子在一条直线上时,作用力最强。测定结果表明,
 固体中
固体中 分子排列为锯齿形,画出含2个
分子排列为锯齿形,画出含2个 的重复单元结构:
的重复单元结构:②
 溶剂中加入
溶剂中加入 可以解离出
可以解离出 和具有正四面体形结构的阴离子,写出该过程的离子方程式:
和具有正四面体形结构的阴离子,写出该过程的离子方程式:(4)工业上用萤石(主要成分
 )制备
)制备 。
。 晶体的一种立方晶胞如图所示。
晶体的一种立方晶胞如图所示。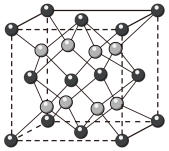
 晶体中距离
晶体中距离 最近的
最近的 有
有②晶体中
 与
与 的最近距离为
的最近距离为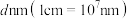 ),阿伏加德罗常数值为
),阿伏加德罗常数值为 。该晶体的密度
。该晶体的密度
 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2023-04-06更新
|
667次组卷
|
2卷引用:北京市海淀区2022-2023学年高三下学期期中练习化学试题



