20-21高二下·福建福州·阶段练习
解题方法
1 . 已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L层上有2对成对电子;E+原子核外有3层电子且M层3d轨道电子全充满。请回答下列问题:
(1)E元素在周期表中的位置_____ ,属于_____ 区。
(2)B、C、D三种元素的第一电离能数值由小到大 的顺序为___ (填元素符号),第一电离能最大的原因是____ 。
(3)D元素与氟元素相比,电负性:D____ F(填“>”、“=”或“<”),下列表述中能证明这一事实的是____ (填选项序号)
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)只含C、A两元素的离子化合物NH5,它的所有原子的最外层都符合相应的稀有气体原子电子层结构,其电子式为___ ,它的晶体中含有多种化学键,但一定不含有的化学键是____ (填选项序号)。
A.极性键 B.非极性键 C.配位键 D.金属键
(5)B2A4是重要的基本石油化工原料。lmolB2A4分子中含σ键____ mol。
(1)E元素在周期表中的位置
(2)B、C、D三种元素的第一电离能数值由
(3)D元素与氟元素相比,电负性:D
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)只含C、A两元素的离子化合物NH5,它的所有原子的最外层都符合相应的稀有气体原子电子层结构,其电子式为
A.极性键 B.非极性键 C.配位键 D.金属键
(5)B2A4是重要的基本石油化工原料。lmolB2A4分子中含σ键
您最近一年使用:0次
2021-04-21更新
|
202次组卷
|
3卷引用:第20讲化学键
2021·湖南·二模
解题方法
2 . Al、Cr、Co、Ni的合金及其相关化合物用途非常广泛,如锂离子电池的正极材料为LiCoO2,电解质溶液为LiBF4溶液。
(1)Co2+的基态核外电子排布式为_______ 。
(2)钴元素可形成种类繁多的配合物。三氯五氨合钴的化学式为Co(NH3)5Cl3,是一种典型的维尔纳配合物,具有反磁性。0.01molCo(NH3)5Cl3与足量硝酸银溶液反应时生成2.87g白色沉淀。Co(NH3)5Cl3中Co3+的配位数为_______ ,该配合物中的配位原子为_______ 。
(3)1951年Tsao最早报道了用LiAlH4还原腈:

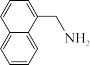 。
。
①LiAlH4中三种元素的电负性从大到小的顺序为_______ (用元素符号表示)。
② 中碳原子的轨道杂化类型为
中碳原子的轨道杂化类型为_______ ,1mol该分子中含σ键的物质的量为_______ 。
(4)全惠斯勒合金CrxCoyAlz的晶胞结构如图甲所示,其化学式为_______ 。
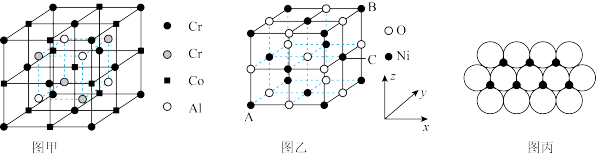
(5)NiO的晶胞结构如图乙所示其中离子坐标参数A为(0,0,0),则C的离子坐标参数为_______ 。一定温度下,NiO晶体可以自发地分散并形成“单分子层”可以认为O2-作密置单层排列,Ni2+填充其中(如图丙),已知O2-的半径为apm,设阿伏加德罗常数的值为NA,每平方米的面积上具有该晶体的质量为_______ g(用含a、NA的代数式表示,Ni的相对原子质量为59)。
(1)Co2+的基态核外电子排布式为
(2)钴元素可形成种类繁多的配合物。三氯五氨合钴的化学式为Co(NH3)5Cl3,是一种典型的维尔纳配合物,具有反磁性。0.01molCo(NH3)5Cl3与足量硝酸银溶液反应时生成2.87g白色沉淀。Co(NH3)5Cl3中Co3+的配位数为
(3)1951年Tsao最早报道了用LiAlH4还原腈:


 。
。①LiAlH4中三种元素的电负性从大到小的顺序为
②
 中碳原子的轨道杂化类型为
中碳原子的轨道杂化类型为(4)全惠斯勒合金CrxCoyAlz的晶胞结构如图甲所示,其化学式为

(5)NiO的晶胞结构如图乙所示其中离子坐标参数A为(0,0,0),则C的离子坐标参数为
您最近一年使用:0次
2021·河南洛阳·模拟预测
名校
解题方法
3 . 12月 17日凌晨,嫦娥五号完成“ 挖土” 之旅返回地球。查阅资料,月球玄武岩是构成月球的岩石之一,主要由辉石(主要成分硅酸盐)和钛铁矿(主要成分 FeTiO3)等组成。回答下列问题:
(1)基态铁原子的价电子排布式为:______ 。
(2)与 Fe同周期,且最外层电子数相同的主族元素是______ (填元素符号)。
(3)基态 Ti原子核外电子占据的最高能层符号为______ ;其最外层电子的电子云轮廓图为______ 。
(4)1molFe3[Fe(CN)6]2中含有 σ键数为______ ,[Fe(CN)6]3-中配体为______ ,其中 C原子的杂化轨道类型为______ ,H、C、N、Si四种元素的电负性由大到小的顺序为______ 。
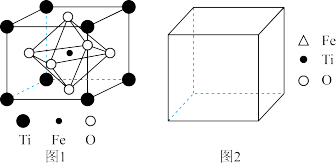
(5)FeTiO3的结构如图 1所示,其中由 O围成的______ (填“ 四面体空隙” 或“ 八面体空隙” )被 Fe占据。在图 2中画出 FeTiO3结构的另一种表示______ (要求:Fe处于晶胞的顶点),Ti的配位数为______ 。
(6)已知该晶胞的密度为 ρg/cm3,NA表示阿伏加德罗常数的值。计算晶胞参数 a=______ pm。(列出计算表达式)
(1)基态铁原子的价电子排布式为:
(2)与 Fe同周期,且最外层电子数相同的主族元素是
(3)基态 Ti原子核外电子占据的最高能层符号为
(4)1molFe3[Fe(CN)6]2中含有 σ键数为
(5)FeTiO3的结构如图 1所示,其中由 O围成的
(6)已知该晶胞的密度为 ρg/cm3,NA表示阿伏加德罗常数的值。计算晶胞参数 a=

您最近一年使用:0次
2021-03-14更新
|
851次组卷
|
3卷引用:01 物质结构与性质综合题型集训(1) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
(已下线)01 物质结构与性质综合题型集训(1) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)河南省洛阳市2021届高三3月调研考试理综化学试题湖南省娄底市第五中学2021-2022学年高三下学期期中考试化学试题
2021·江西上饶·一模
解题方法
4 . S、Se 、N、Fe等元素及其化合物在科学研究和工业生产中具有重要的作用。
(1)臭鼬排放的臭气主要成分为3﹣MBT,键线式如图所示:

0.1mol 3﹣MBT中含有σ键数目为___________ (NA为阿伏加德罗常数的值)。3﹣MBT的沸点低于(CH3)2C=CHCH2OH,主要原因是___________ 。
(2)2020年12月17日,采撷月壤的嫦娥五号荣耀归来。嫦娥五号探测器采用太阳能电池板提供能量,在太阳能电池板材料中除单晶硅外,还有铜,铟,镓,硒等化学物质。硒为第四周期第VIA族元素,其氧化物有SeO2和SeO3两种,SeO3分子的立体构型为___________ ,与其互为等电子体的阴离子为 ___________ (举一例)。
(3)铁氰化钾,化学式为K3[Fe(CN)6],主要应用于制药、电镀、造纸、钢铁生产等工业,其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
①K3[Fe(CN)6]中所涉及的各元素的第一电离能由大到小的顺序为___________ 。
②(CN)2分子中存在碳碳键,C原子的杂化轨道类型为___________ 。
③下列选项是部分同学画的基态氮原子的核外电子排布图,其中违背泡利原理的是___________ (填序号,下同),违背洪特规则的是___________ 。
A.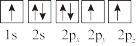 B.
B. 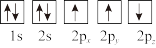 C.
C. 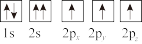
(4)如图是金属铁晶体中的一个晶胞。
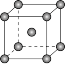
①该晶体中原子总体积占晶体体积的比值为___________ (用含π的最简代数式表示)。
②铁原子的半径为rpm,其晶体密度为___________ g•cm﹣3(用含有r、NA的最简代数式表示)。
(1)臭鼬排放的臭气主要成分为3﹣MBT,键线式如图所示:

0.1mol 3﹣MBT中含有σ键数目为
(2)2020年12月17日,采撷月壤的嫦娥五号荣耀归来。嫦娥五号探测器采用太阳能电池板提供能量,在太阳能电池板材料中除单晶硅外,还有铜,铟,镓,硒等化学物质。硒为第四周期第VIA族元素,其氧化物有SeO2和SeO3两种,SeO3分子的立体构型为
(3)铁氰化钾,化学式为K3[Fe(CN)6],主要应用于制药、电镀、造纸、钢铁生产等工业,其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
①K3[Fe(CN)6]中所涉及的各元素的第一电离能由大到小的顺序为
②(CN)2分子中存在碳碳键,C原子的杂化轨道类型为
③下列选项是部分同学画的基态氮原子的核外电子排布图,其中违背泡利原理的是
A.
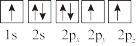 B.
B. 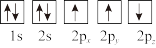 C.
C. 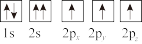
(4)如图是金属铁晶体中的一个晶胞。

①该晶体中原子总体积占晶体体积的比值为
②铁原子的半径为rpm,其晶体密度为
您最近一年使用:0次
21-22高三上·四川成都·阶段练习
解题方法
5 . 哈萨克斯坦是“丝绸之路”的一个重要节点,其境内有丰富的铬、镍、钼矿。设NA表示阿伏加德罗常数,回答下列问题:
(1)基态Cr原子的价电子排布图为_______ 。
(2)Cr的一种配合物结构如图1所示。

①阴离子 的空间构型为
的空间构型为_______ ,写出一种与之互为等电子体的离子_______ 。
②标注“1”、“2”的碳原子的杂化类型分别为_______ 、_______ 。
③基态氮原子的第一电离能大于基态氧原子,其原因是_______ 。
(3)1 mol[Ni(NH3)4]2+中含有的σ键数目为_______ 。
(4)已知:钼的晶胞如图2所示。

①下列晶体的原子堆积方式与钼晶体的相同的是_______ (填字母)。
A.Cu B.K C.金刚石D.氯化钠
②已知钼晶体的密度是ρg·cm-3,Mo的摩尔质量是Mg·mol-1,晶体中距离最近的Mo原子核之间的距离为_______ pm。
(1)基态Cr原子的价电子排布图为
(2)Cr的一种配合物结构如图1所示。

①阴离子
 的空间构型为
的空间构型为②标注“1”、“2”的碳原子的杂化类型分别为
③基态氮原子的第一电离能大于基态氧原子,其原因是
(3)1 mol[Ni(NH3)4]2+中含有的σ键数目为
(4)已知:钼的晶胞如图2所示。

①下列晶体的原子堆积方式与钼晶体的相同的是
A.Cu B.K C.金刚石D.氯化钠
②已知钼晶体的密度是ρg·cm-3,Mo的摩尔质量是Mg·mol-1,晶体中距离最近的Mo原子核之间的距离为
您最近一年使用:0次
2020·广西北海·一模
解题方法
6 . 点击化学的代表反应为铜催化的叠氮-炔基Husigen环加成反应,NaN3、SO2F2、FSO2N2等均是点击化学中常用无机试剂。回答下列问题:
(1)基态Cu原子价电子排布式为___________ ;基态N原子未成对电子有___________ 个。
(2)F、O、N的电负性从小到大的顺序是___________ 。
(3)SO2F2中硫原子价层电子对数目为___________ ;SO2F2的沸点比FSO2N3的低,其主要原因是___________ 。
(4)NaN3是HN3的钠盐,下列有关HN3说法正确的是___________ (填字母)。
a.HN3分子呈直线型 b.HN3分子间存在氢键
c.HN3中氮原子杂化方式只有sp d.HN3与HOCN互为等电子体
(5)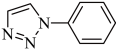 是一种叠氮-炔基Husigen环加成反应产物,每个该分子中含有
是一种叠氮-炔基Husigen环加成反应产物,每个该分子中含有___________ 个σ键。
(6)CuBr是点击化学常用的催化剂,其晶胞结构如图所示,晶胞参数为a pm。
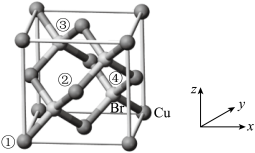
已知①、②号铜原子坐标依次为(0,0,0)、( ,0,
,0, ),则③号溴原子的坐标为
),则③号溴原子的坐标为___________ ;设NA为阿伏加德罗常数的值,CuBr的密度为___________ g·cm-3(列出计算式)。
(1)基态Cu原子价电子排布式为
(2)F、O、N的电负性从小到大的顺序是
(3)SO2F2中硫原子价层电子对数目为
(4)NaN3是HN3的钠盐,下列有关HN3说法正确的是
a.HN3分子呈直线型 b.HN3分子间存在氢键
c.HN3中氮原子杂化方式只有sp d.HN3与HOCN互为等电子体
(5)
 是一种叠氮-炔基Husigen环加成反应产物,每个该分子中含有
是一种叠氮-炔基Husigen环加成反应产物,每个该分子中含有(6)CuBr是点击化学常用的催化剂,其晶胞结构如图所示,晶胞参数为a pm。

已知①、②号铜原子坐标依次为(0,0,0)、(
 ,0,
,0, ),则③号溴原子的坐标为
),则③号溴原子的坐标为
您最近一年使用:0次
2020高三·全国·专题练习
解题方法
7 . (1)Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是___ 。Ge单晶具有金刚石型结构,微粒之间存在的作用力是___ 。
(2)Zn的氯化物与氨水反应可形成配合物[Zn(NH3)4]Cl2,1mol该配合物中含有σ键的数目为___ 。
(3)Co的氯化物与氨水反应可形成配合物[CoCl(NH3)5]Cl2,1mol该配合物中含有σ键的数目为___ ,含1mol[CoCl(NH3)5]Cl2的溶液中加入足量AgNO3溶液,生成___ molAgCl沉淀。
(4)C的某种单质单质 相对分子质量为720,分子构型为一个32面体,其中有12个五元环,20个六元环。则1个这种单质分子中所含π键的数目为
相对分子质量为720,分子构型为一个32面体,其中有12个五元环,20个六元环。则1个这种单质分子中所含π键的数目为____ 。
(2)Zn的氯化物与氨水反应可形成配合物[Zn(NH3)4]Cl2,1mol该配合物中含有σ键的数目为
(3)Co的氯化物与氨水反应可形成配合物[CoCl(NH3)5]Cl2,1mol该配合物中含有σ键的数目为
(4)C的某种单质单质
 相对分子质量为720,分子构型为一个32面体,其中有12个五元环,20个六元环。则1个这种单质分子中所含π键的数目为
相对分子质量为720,分子构型为一个32面体,其中有12个五元环,20个六元环。则1个这种单质分子中所含π键的数目为
您最近一年使用:0次
20-21高三上·广东湛江·阶段练习
解题方法
8 . 近年来,KCoF3、KFeF3等因具有独特的电性、磁性和光致发光性而引起人们极大的研究兴趣。回答下列问题:
(1)基态F原子的价层电子排布图为________ 。
(2)K、Fe、Co三种基态原子的未成对电子数之比为________ ;Co与Fe中第四电离能更大的是________ (填元素符号),原因为________________ 。
(3)Fe、Co可形成多种配合物,如Fe(SCN)3、[Fe(CN)6]4-、[Co(NH3)6]2+等。
①SCN-的立体构型为________ ,其中C原子的杂化形式为________ 。
②HCN中σ键和π键的数目之比为________ 。
③NH3比NF3更易作配体的原因为_____________________ 。
(4)KCoF3具有钙钛矿型结构,其晶体的部分结构如图所示。其中[CoF6]正八面体通过共顶角F原子连接,K填充在其间空隙,K为12配位。

①KCoF3的晶胞为________ (填“立方晶胞”或“六方晶胞”)。
②阿伏加德罗常数的值为NA,晶体密度为ρ g·cm-3,则Co与F之间的最短距离为________ pm(用代数式表示)。
(1)基态F原子的价层电子排布图为
(2)K、Fe、Co三种基态原子的未成对电子数之比为
(3)Fe、Co可形成多种配合物,如Fe(SCN)3、[Fe(CN)6]4-、[Co(NH3)6]2+等。
①SCN-的立体构型为
②HCN中σ键和π键的数目之比为
③NH3比NF3更易作配体的原因为
(4)KCoF3具有钙钛矿型结构,其晶体的部分结构如图所示。其中[CoF6]正八面体通过共顶角F原子连接,K填充在其间空隙,K为12配位。

①KCoF3的晶胞为
②阿伏加德罗常数的值为NA,晶体密度为ρ g·cm-3,则Co与F之间的最短距离为
您最近一年使用:0次
19-20高二下·甘肃兰州·期末
名校
解题方法
9 . 前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B位于同一周期且相邻,A元素原子有三个能级,且每个能级上的电子数相等;C、D、E、F是位于同一周期的金属元素,基态C、F原子的价层电子中未成对电子数均为1,且C、F原子的电子数相差10,基态D、E原子的价层电子中未成对电子数分别为4、2,且原子序数相差2。
(1)六种元素中第一电离能最小的是__ (填元素符号,下同),电负性最大的是_________ 。
(2)A、B、C、D四种元素形成的一种配合物,易溶于水,可以检验Fe2+离子,离子方程式为:_______ ; 1 mol该配合物中,含有的σ键和π键的数目比为____ ;该配合物晶体中各种微粒间的作用力不涉及____ (填字母)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.分子间作用力
(3)E2+的价层电子排布图为____ ;
(4)金属C、F晶体的晶胞结构如图所示(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为____ 。金属C的晶胞中,若设该晶胞的密度为ρ g·cm-3,阿伏加 德罗常数的值为NA,C原子的摩尔质量为M g· mol-1,则C原子的半径为____ (用含a、M、NA的代数式表示)。

(1)六种元素中第一电离能最小的是
(2)A、B、C、D四种元素形成的一种配合物,易溶于水,可以检验Fe2+离子,离子方程式为:
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.分子间作用力
(3)E2+的价层电子排布图为
(4)金属C、F晶体的晶胞结构如图所示(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为

您最近一年使用:0次
19-20高二下·内蒙古包头·期中
名校
解题方法
10 . 铁、钴、镍都属于第VIII族元素,它们的单质、合金及其化合物在催化剂和能源领域用途非常广泛。
(1)结合电子排布式分析Fe3+比Co3+氧化性弱的原因:_______________________________ 。
(2)BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①CTCN的化学式为[Co(NH3)4CO3]NO3,与Co3+形成配位键的原子是____________ 。(已知 的结构式为
的结构式为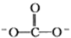 )
)
②NaNT可以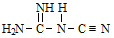 (双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为
(双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为________ ,1mol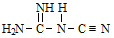 中含有σ键的物质的量为
中含有σ键的物质的量为___________ 。
③[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为_________________ 。
(3)一种新型的功能材料的晶胞结构如图1所示,它的化学式可表示为________ 。晶胞中离1个Mn原子最近的Ni原子有________ 个。
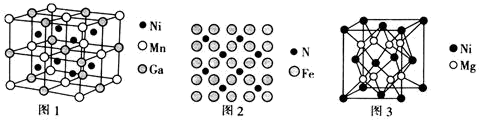
(4)铁触媒是合成氨反应的催化剂,其表面存在氮原子。氮原子在铁表面上的单层附着,局部示意图如图2所示。则铁表面上氮原子与铁原子的数目比为________ 。
(5)镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图3所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm。则镍镁晶体未储氢时的密度为________ g/cm3(列出计算表达式,NA表示阿伏加 德罗常数的数值).
(1)结合电子排布式分析Fe3+比Co3+氧化性弱的原因:
(2)BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①CTCN的化学式为[Co(NH3)4CO3]NO3,与Co3+形成配位键的原子是
 的结构式为
的结构式为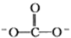 )
)②NaNT可以
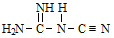 (双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为
(双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为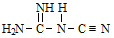 中含有σ键的物质的量为
中含有σ键的物质的量为③[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为
(3)一种新型的功能材料的晶胞结构如图1所示,它的化学式可表示为

(4)铁触媒是合成氨反应的催化剂,其表面存在氮原子。氮原子在铁表面上的单层附着,局部示意图如图2所示。则铁表面上氮原子与铁原子的数目比为
(5)镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图3所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm。则镍镁晶体未储氢时的密度为
您最近一年使用:0次



