1 . 含碳元素的物质是化学世界中最庞大的家族,请填写下列空格。
(1)CH4中的化学键从形成过程来看,属于_______ (填“σ”或“π”)键,从其极性来看属于_______ 键。
(2)CO2和CH3OH分子中C原子的杂化形式分别为_______ 和_______ 。
(3)利用CO可以合成化工原料COCl2,COCl2分子的结构式为 ,每个COCl2分子内含有的σ键、π键数目为_______。
,每个COCl2分子内含有的σ键、π键数目为_______。
(4)有两种活性反应中间体粒子,它们的粒子中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:
甲:
_______ ;乙:
_______ 。
(1)CH4中的化学键从形成过程来看,属于
(2)CO2和CH3OH分子中C原子的杂化形式分别为
(3)利用CO可以合成化工原料COCl2,COCl2分子的结构式为
 ,每个COCl2分子内含有的σ键、π键数目为_______。
,每个COCl2分子内含有的σ键、π键数目为_______。| A.4个σ键 | B.2个σ键、2个π键 | C.2个σ键、1个π键 | D.3个σ键、1个π键 |
甲:


您最近一年使用:0次
2 . 将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色。
(1)Cu的价电子轨道表达式为____ ;在周期表中,Cu元素属于___________ 区。
(2)将氨水逐滴加入硫酸铜溶液中,先生成蓝色沉淀,继续滴加氨水,沉淀溶解,写出沉淀溶解的离子方程式:___________ 。
(3)向深蓝色溶液继续加入___________ ,析出深蓝色的晶体[Cu(NH3)4]SO4·H2O。[Cu(NH3)4]SO4·H2O中,1mol[Cu(NH3)4] 2+含有σ键的数目为___________ 。
(4)___________ (填“H2O”或“NH3”)与Cu2+形成的配位键更稳定。
(5)SO 的VSEPR模型名称为
的VSEPR模型名称为___________ ,H3O+空间构型为___________ 。
(6)硫酸铜溶液中滴入氨基乙酸钠(H2NCH2COONa)即可得到配合物A,其结构如下图所示。
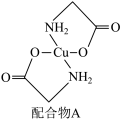
该结构中,除共价键外还存在配位键,请在图中用“→”表示出配位键___________ 。
(1)Cu的价电子轨道表达式为
(2)将氨水逐滴加入硫酸铜溶液中,先生成蓝色沉淀,继续滴加氨水,沉淀溶解,写出沉淀溶解的离子方程式:
(3)向深蓝色溶液继续加入
(4)
(5)SO
 的VSEPR模型名称为
的VSEPR模型名称为(6)硫酸铜溶液中滴入氨基乙酸钠(H2NCH2COONa)即可得到配合物A,其结构如下图所示。

该结构中,除共价键外还存在配位键,请在图中用“→”表示出配位键
您最近一年使用:0次
名校
解题方法
3 . 请回答下列有关问题。
(1)Fe元素按周期表分区属于___________ 区元素
(2)地壳中含量最多的三种元素O、Si、Al中,电负性最大的是___________ 。
(3)钠在火焰上灼烧产生的黄光是一种___________ (填字母)
A.吸收光谱 B.发射光谱
(4)Cu的基态原子的电子排布式是___________ 。
(5)钛被称为继铁、铝之后的第三金属,基态钛原子价电子层的电子排布图是___________ 。
(6)基态Fe3+与Fe2+离子中未成对的电子数之比为___________
(7)COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为________ 。
(8)H2O分子的空间构型为___________
(1)Fe元素按周期表分区属于
(2)地壳中含量最多的三种元素O、Si、Al中,电负性最大的是
(3)钠在火焰上灼烧产生的黄光是一种
A.吸收光谱 B.发射光谱
(4)Cu的基态原子的电子排布式是
(5)钛被称为继铁、铝之后的第三金属,基态钛原子价电子层的电子排布图是
(6)基态Fe3+与Fe2+离子中未成对的电子数之比为
(7)COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为
(8)H2O分子的空间构型为
您最近一年使用:0次
名校
解题方法
4 . 有下列8种晶体:A.水晶B.白磷C.冰醋酸D.固态氩E.氯化铵F.铝G.金刚石H.烧碱。用序号回答下列问题:
(1)含有非极性键的原子晶体是_______ ;属于分子晶体的单质是_______ ;含有离子键、共价键、配位键的化合物是_______ ;受热熔化,需克服共价键的是_______ 。
(2)在肺部,血红素中的Fe2+结合的水分子与氧分子交换,形成氧合血红蛋白,经动脉运送到组织释放出O2;然后血红素结合组织代谢所产生的CO2,经静脉送回肺中与水分子交换,最后将CO2排出体外,完成呼吸过程。血红素中Fe2+与CO2中的氧原子以配位键形式结合,这种结合是可逆的,比Fe2+与N的结合弱的原因是_______ 。
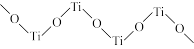
(3)TiO2难溶于水和稀酸,但能溶于浓硫酸,析出含有钛酰离子的晶体,钛酰离子常成为链状聚合形式的阳离子,其结构形式如图,化学式为_______
(4)氨硼烷是一种特殊的化合物,分子式为NH3BH3.氨硼烷在催化剂作用下水解释放出氢气: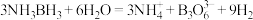 。
。 的结构如图。回答下列问题:
的结构如图。回答下列问题:

①请写出氧原子价电子轨道表达式_______ 。
②NH3BH3晶体中含有的微粒间作用力有_______ (填标号)。
a.非极性共价键 b.配位键 c.氢键 d.范德华力 e.金属键
③已知钛的一种常见化合物是 。1mol该物质中含有σ键的数目为
。1mol该物质中含有σ键的数目为_______
(5)图象是NaCl、CsCl、ZnS等离子晶体结构图或者是从其中分割出来的部分结构图。其中属于NaCl的晶体结构的图是_______
(1)含有非极性键的原子晶体是
(2)在肺部,血红素中的Fe2+结合的水分子与氧分子交换,形成氧合血红蛋白,经动脉运送到组织释放出O2;然后血红素结合组织代谢所产生的CO2,经静脉送回肺中与水分子交换,最后将CO2排出体外,完成呼吸过程。血红素中Fe2+与CO2中的氧原子以配位键形式结合,这种结合是可逆的,比Fe2+与N的结合弱的原因是
(3)TiO2难溶于水和稀酸,但能溶于浓硫酸,析出含有钛酰离子的晶体,钛酰离子常成为链状聚合形式的阳离子,其结构形式如图,化学式为

(4)氨硼烷是一种特殊的化合物,分子式为NH3BH3.氨硼烷在催化剂作用下水解释放出氢气:
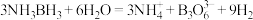 。
。 的结构如图。回答下列问题:
的结构如图。回答下列问题:
①请写出氧原子价电子轨道表达式
②NH3BH3晶体中含有的微粒间作用力有
a.非极性共价键 b.配位键 c.氢键 d.范德华力 e.金属键
③已知钛的一种常见化合物是
 。1mol该物质中含有σ键的数目为
。1mol该物质中含有σ键的数目为(5)图象是NaCl、CsCl、ZnS等离子晶体结构图或者是从其中分割出来的部分结构图。其中属于NaCl的晶体结构的图是_______
A.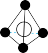 | B. | C.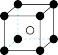 | D.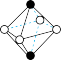 |
您最近一年使用:0次
名校
5 .  常用作分析试剂,也用于有机合成。请回答下列问题:
常用作分析试剂,也用于有机合成。请回答下列问题:
(1) 的结构简式为
的结构简式为 ,该分子中π键和σ键的个数比为
,该分子中π键和σ键的个数比为___________ 。
(2) 三种气态氢化物稳定性由强到弱的顺序:
三种气态氢化物稳定性由强到弱的顺序:___________ ,原因是___________ (用共价键理论解释)。
(3)原子中的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为自旋磁量子数。对于基态
表示,称为自旋磁量子数。对于基态 原子,其自旋磁量子数的代数和为
原子,其自旋磁量子数的代数和为___________ 。
(4)为标定 浓度,现用
浓度,现用 的
的 溶液滴定
溶液滴定 的
的 溶液。随
溶液。随 溶液的加入,溶液的
溶液的加入,溶液的 、含硒分布系数
、含硒分布系数 与
与 的变化关系如图所示。
的变化关系如图所示。

①曲线b代表的微粒为___________ 。
②计算 的第二步电离平衡常数
的第二步电离平衡常数
___________ 。
③计算A点溶液中
___________  (保留两位有效数字)。
(保留两位有效数字)。
 常用作分析试剂,也用于有机合成。请回答下列问题:
常用作分析试剂,也用于有机合成。请回答下列问题:(1)
 的结构简式为
的结构简式为 ,该分子中π键和σ键的个数比为
,该分子中π键和σ键的个数比为(2)
 三种气态氢化物稳定性由强到弱的顺序:
三种气态氢化物稳定性由强到弱的顺序:(3)原子中的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示,称为自旋磁量子数。对于基态
表示,称为自旋磁量子数。对于基态 原子,其自旋磁量子数的代数和为
原子,其自旋磁量子数的代数和为(4)为标定
 浓度,现用
浓度,现用 的
的 溶液滴定
溶液滴定 的
的 溶液。随
溶液。随 溶液的加入,溶液的
溶液的加入,溶液的 、含硒分布系数
、含硒分布系数 与
与 的变化关系如图所示。
的变化关系如图所示。
①曲线b代表的微粒为
②计算
 的第二步电离平衡常数
的第二步电离平衡常数
③计算A点溶液中

 (保留两位有效数字)。
(保留两位有效数字)。
您最近一年使用:0次
6 . 有A、B、C、D、E五种元素的原子序数依次增大。A、B、C位于同一周期,A原子的第一电离能大于B原子,B原子的2p能级上有两个未成对电子,D位于第四周期且原子的d能级上没有电子,C与D形成的化合物为DC2。E原子的3d能级上电子数是4s能级上电子数的三倍。
(1)写出基态E3+的电子排布式___ 。
(2)A原子第一电离能大于B的原因___ 。
(3)一个A2C2分子中含个___ σ键,___ 个π键;AB 离子的空间构型为
离子的空间构型为___ 。
(4)上述五种元素的原子中电负性由大到小顺序是___ (填元素符号)。
(1)写出基态E3+的电子排布式
(2)A原子第一电离能大于B的原因
(3)一个A2C2分子中含个
 离子的空间构型为
离子的空间构型为(4)上述五种元素的原子中电负性由大到小顺序是
您最近一年使用:0次
名校
解题方法
7 . 工业上采用还原法冾炼黄金(Au)的原理如下:


请回答下列问题:
(1)在元素周期表中,Au与Cu位于同族,基态Au原子比基态Cu原子多2个电子层。基态Au原子的价层电子排布式为___________ ,金元素位于___________ 区。
(2)Zn和Cu相邻,第一电离能:I1(Cu)___________ (填“>”、“<”或“=”,下同)I1(Zn),第二电离能:I2(Cu)___________ I2(Zn)。
(3)1mol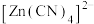 中含
中含___________ molσ键。
(4)已知卤化锌的熔点如下表所示:
卤化锌的熔点存在差异的主要原因是___________ 。
(5)由金、氯、铯三种元素组成的晶体M,其晶胞结构如图1所示,M的化学式为___________ ,其中金原子形成了2种不同的配离子(均呈负一价),它们分别是___________ 和___________ (写出离子符号,不分顺序)。

(6)金晶体的晶胞结构如图2所示,其晶胞参数为408pm,金晶体的密度为___________ (只列计算式,设 为阿伏加德罗常数的值)
为阿伏加德罗常数的值) 。
。



请回答下列问题:
(1)在元素周期表中,Au与Cu位于同族,基态Au原子比基态Cu原子多2个电子层。基态Au原子的价层电子排布式为
(2)Zn和Cu相邻,第一电离能:I1(Cu)
(3)1mol
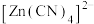 中含
中含(4)已知卤化锌的熔点如下表所示:
| 卤化锌 |  |  | 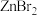 | 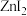 |
| 熔点/℃ | 872 | 283 | 394 | 446 |
(5)由金、氯、铯三种元素组成的晶体M,其晶胞结构如图1所示,M的化学式为

(6)金晶体的晶胞结构如图2所示,其晶胞参数为408pm,金晶体的密度为
 为阿伏加德罗常数的值)
为阿伏加德罗常数的值) 。
。
您最近一年使用:0次
2021-12-02更新
|
328次组卷
|
6卷引用:广东省2021-2022学年高三11月联考化学试题
广东省2021-2022学年高三11月联考化学试题河南省名校联盟2021-2022学年高三上学期11月联考化学试题河北省保定市部分学校2021-2022学年高三上学期期中考试化学试题广东省韶关市2021-2022学年高三上学期期中考试化学试题(已下线)押新高考卷15题 物质结构与性质综合题-备战2022年高考化学临考题号押题(新高考通版)广东省深圳市龙华中学2021-2022学年高三下学期(二月第二次)半周测化学试题
名校
解题方法
8 . 下列关于乙烯的说法不正确 的是
| A.碳原子均采用sp2杂化,键角接近120° |
| B.分子中总共有5个σ键和1个π键 |
| C.π键由2个碳原子的p轨道“头碰头”重叠而成 |
| D.碳碳双键中的π键键能比σ键的小,易断裂,因此乙烯易发生加成反应 |
您最近一年使用:0次
2021-07-11更新
|
139次组卷
|
5卷引用:北京市顺义区第一中学2021-2022学年高三上学期8月月考化学试题
解题方法
9 . 锌及其化合物在工农业生产及科学研究中具有广泛的用途。回答下列问题:
(1)Zn位于元素周期表的___________ 区,基态Zn2+的核外电子排布式为___________ 。
(2)氨基酸锌是研究最早和使用最广泛的第三代锌添加剂,该添加剂具有优良的营养功能。如图1是氨基酸锌的结构简式。
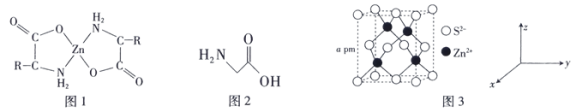
①组成氨基酸锌的C、N、O的电负性由大到小的顺序是___________ 。
②氨基酸锌的Zn2+形成配位键,其中提供空轨道的原子是___________ 。
③最简单的氨基酸是甘氨酸(结构简式如图2),其结构中π键与σ键的数量比为___________ 。
(3)ZnS可用于制白色颜料、玻璃、发光粉、橡胶、塑料、发光油漆等。ZnS的晶胞如图3所示。
①上图中 的坐标有
的坐标有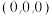 、
、 ,与
,与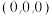 距离最近的
距离最近的 还有
还有___________ (填坐标)。
②Zn2+占据___________ (填“八面体”或“四面体”)空隙,空隙利用率为___________ %。
③ZnS的密度为___________  。
。
(1)Zn位于元素周期表的
(2)氨基酸锌是研究最早和使用最广泛的第三代锌添加剂,该添加剂具有优良的营养功能。如图1是氨基酸锌的结构简式。

①组成氨基酸锌的C、N、O的电负性由大到小的顺序是
②氨基酸锌的Zn2+形成配位键,其中提供空轨道的原子是
③最简单的氨基酸是甘氨酸(结构简式如图2),其结构中π键与σ键的数量比为
(3)ZnS可用于制白色颜料、玻璃、发光粉、橡胶、塑料、发光油漆等。ZnS的晶胞如图3所示。
①上图中
 的坐标有
的坐标有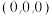 、
、 ,与
,与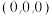 距离最近的
距离最近的 还有
还有②Zn2+占据
③ZnS的密度为
 。
。
您最近一年使用:0次
2021-07-05更新
|
127次组卷
|
2卷引用:江西省赣抚吉名校2022届高三上学期8月联合考试化学试题
名校
10 . 我国 排放力争2030年前达到峰值,力争2060年前实现碳中和。有关
排放力争2030年前达到峰值,力争2060年前实现碳中和。有关 的说法不正确的是
的说法不正确的是
 排放力争2030年前达到峰值,力争2060年前实现碳中和。有关
排放力争2030年前达到峰值,力争2060年前实现碳中和。有关 的说法不正确的是
的说法不正确的是A. 的电负性比 的电负性比 的大 的大 |
B. 是由极性键构成的极性分子 是由极性键构成的极性分子 |
C. 中σ键和π键的数目之比为 中σ键和π键的数目之比为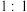 |
D.相同压强下, 的熔点比 的熔点比 的低 的低 |
您最近一年使用:0次
2021-06-09更新
|
544次组卷
|
5卷引用:河北省邢台市2020-2021学年高二下学期第三次月考化学试题



