名校
1 . “价一类”二维图是预测物质性质的重要思维工具。下图1是硫元素的常见化合价与部分物质类别的对应关系。下列说法正确的是
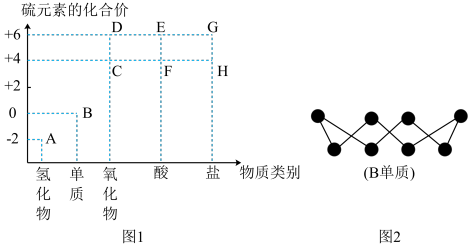

| A.A、C和D都可以通过单质间化合制得 |
| B.C不可用于饮料工业 |
| C.B单质的常见形式为S8 (结构如图2),32 g B单质含有的共价键数为2NA |
| D.A、C、D、E、F分子内均存在共价键 |
您最近一年使用:0次
2022-12-06更新
|
259次组卷
|
2卷引用:安徽省芜湖市第一中学2022-2023学年高三上学期12月月考化学试题
名校
解题方法
2 .  及其化合物在生产生活方面都有重要的用途.回答下列问题:
及其化合物在生产生活方面都有重要的用途.回答下列问题:
(1)基态铁原子的核外电子排布式为:______ , 比
比 更稳定的原因是:
更稳定的原因是:______ 。
(2) 中铁元素的配位数是
中铁元素的配位数是______ ,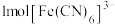 中含有的
中含有的 键的数目为
键的数目为______ , 中C原子的杂化方式为
中C原子的杂化方式为______ 。
(3)铁和氨在 可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:
可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:______ 。
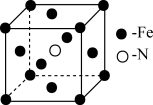
(4)血红素铁用作铁强化剂,其吸收率比一般铁剂高3倍,图中画出 与N原子间的化学键(若是配位键,需要用箭头加以表示)
与N原子间的化学键(若是配位键,需要用箭头加以表示)______ 。

 及其化合物在生产生活方面都有重要的用途.回答下列问题:
及其化合物在生产生活方面都有重要的用途.回答下列问题:(1)基态铁原子的核外电子排布式为:
 比
比 更稳定的原因是:
更稳定的原因是:(2)
 中铁元素的配位数是
中铁元素的配位数是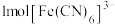 中含有的
中含有的 键的数目为
键的数目为 中C原子的杂化方式为
中C原子的杂化方式为(3)铁和氨在
 可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:
可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:
(4)血红素铁用作铁强化剂,其吸收率比一般铁剂高3倍,图中画出
 与N原子间的化学键(若是配位键,需要用箭头加以表示)
与N原子间的化学键(若是配位键,需要用箭头加以表示)
您最近一年使用:0次
名校
解题方法
3 . 物质的结构决定性质,依据性质在我们日常生活中才会有形形色色的用途。
I.磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。磷的化合物在药物生产和农药制造等方面用途非常广泛。请回答下列有关问题:
(1)画出基态P原子的核外电子排布图_____ 。
(2)NH3比PH3易液化的原因是_____ 。
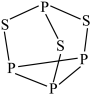
(3)P4S3可用于制造火柴,其结构如图所示。
①P4S3中硫原子的杂化轨道类型为_____ 。
②电负性:磷_____ 硫(填“>”或“<”);第一电离能磷大于硫的原因是_____ 。
(4)NH4BF4是合成氮化硼纳米管的原料之一,1molNH4BF4中含有_____ mol配位键。
Ⅱ.
(5)有一种氮化钛晶体的晶胞与NaCl晶胞相似(如图),其中阴离子(N3-)采用面心立方最密堆积方式,X-射线衍射实验测得氮化钛的晶胞参数(晶胞边长)为acm,则r(N3-)为_____ cm。该氮化钛的密度为_____ g·cm-3(NA为阿伏加德罗常数的值,只列计算式)。

I.磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。磷的化合物在药物生产和农药制造等方面用途非常广泛。请回答下列有关问题:

(1)画出基态P原子的核外电子排布图
(2)NH3比PH3易液化的原因是
(3)P4S3可用于制造火柴,其结构如图所示。
①P4S3中硫原子的杂化轨道类型为
②电负性:磷
(4)NH4BF4是合成氮化硼纳米管的原料之一,1molNH4BF4中含有
Ⅱ.
(5)有一种氮化钛晶体的晶胞与NaCl晶胞相似(如图),其中阴离子(N3-)采用面心立方最密堆积方式,X-射线衍射实验测得氮化钛的晶胞参数(晶胞边长)为acm,则r(N3-)为

您最近一年使用:0次
名校
解题方法
4 . 碳族元素中的碳、硅、锗及其化合物在诸多领域有重要用途。

(1)碳族元素位于周期表__________ 区,基态锗原子外围电子的轨道表示式为__________ 。
(2)科学家以 、
、 等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。
等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。 、
、 结构中含氮碳环均为平面结构,则N的杂化方式是
结构中含氮碳环均为平面结构,则N的杂化方式是____________ 。
(3)金刚石(甲)、石墨(乙)、 (丙)的结构如图所示:
(丙)的结构如图所示:

①12g金刚石和石墨中含有的 键数目之比为
键数目之比为__________ 。
②金刚石的熔点高于 ,但低于石墨,原因是
,但低于石墨,原因是__________ 。
③ 的晶胞呈分子密堆积,下列晶体中,与
的晶胞呈分子密堆积,下列晶体中,与 具有相同晶体结构的是
具有相同晶体结构的是__________ 。
A. B.冰C.
B.冰C. D.
D. E.
E.
(4)六方氮化硼的结构与石墨结构相类似(如图甲),上、下层平行,B、N原子相互交替,层内 核间距为a
核间距为a ,层间距为k
,层间距为k ,晶体密度为ρ
,晶体密度为ρ ,晶胞如图乙所示。六方氮化硼晶体中硼原子的杂化类型为
,晶胞如图乙所示。六方氮化硼晶体中硼原子的杂化类型为_________ ,其结构与石墨相似却不导电,原因是_____________ ,阿伏加德罗常数
__________ 。(用含a、k、ρ的式子表示)。


(1)碳族元素位于周期表
(2)科学家以
 、
、 等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。
等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。 、
、 结构中含氮碳环均为平面结构,则N的杂化方式是
结构中含氮碳环均为平面结构,则N的杂化方式是(3)金刚石(甲)、石墨(乙)、
 (丙)的结构如图所示:
(丙)的结构如图所示:
①12g金刚石和石墨中含有的
 键数目之比为
键数目之比为②金刚石的熔点高于
 ,但低于石墨,原因是
,但低于石墨,原因是③
 的晶胞呈分子密堆积,下列晶体中,与
的晶胞呈分子密堆积,下列晶体中,与 具有相同晶体结构的是
具有相同晶体结构的是A.
 B.冰C.
B.冰C. D.
D. E.
E.
(4)六方氮化硼的结构与石墨结构相类似(如图甲),上、下层平行,B、N原子相互交替,层内
 核间距为a
核间距为a ,层间距为k
,层间距为k ,晶体密度为ρ
,晶体密度为ρ ,晶胞如图乙所示。六方氮化硼晶体中硼原子的杂化类型为
,晶胞如图乙所示。六方氮化硼晶体中硼原子的杂化类型为

您最近一年使用:0次
名校
解题方法
5 . 请回答下列问题。
(1)钴及其化合物有重要的用途,探究其结构有重要意义。
①请写出基态钴原子的核外电子排布式_________ 。
②按照核外电子排布,可把元素周期表划分为5个区, 在元素周期表中属于
在元素周期表中属于_________ 区。
(2) 是
是 的一种重要配合物。
的一种重要配合物。
①该配合物的一种配体是 ,
, 的空间结构呈
的空间结构呈_________ 形,是_________ (填“极性”或“非极性)分子。
② 的价层电子轨道表示式是
的价层电子轨道表示式是_________ 。
③ 中含有的
中含有的 键的数目为
键的数目为_________ (用 代表阿伏加德罗常数) 。
代表阿伏加德罗常数) 。
④设计实验证实该配合物溶于水时,离子键发生断裂,配位键没有断裂。实验如下:称取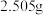 该配合物,先加水溶解,再加足量
该配合物,先加水溶解,再加足量 溶液,
溶液,_________ (补全实验操作),称量沉淀质量为_________ (精确到 ,相对分子质量
,相对分子质量 :250.5;
:250.5; :143.5) 。
:143.5) 。
(3)第ⅤA族元素及其化合物的结构和性质如下:
① 、
、 、
、 的沸点由高到低的顺序为
的沸点由高到低的顺序为_________ (填化学式,下同),键角由大到小的顺序为_________ 。
②某一种氮化硼晶体的立方晶胞结构如图:
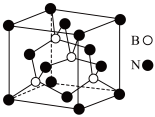
i.氮化硼 属于
属于_________ 晶体;该种氮化硼 的熔点
的熔点_________  (填>、<、=)。
(填>、<、=)。
ii.已知氮化硼 晶胞的边长为
晶胞的边长为 ,则晶胞密度为
,则晶胞密度为_________  (用含有a、
(用含有a、 的代数式表示)。
的代数式表示)。
(1)钴及其化合物有重要的用途,探究其结构有重要意义。
①请写出基态钴原子的核外电子排布式
②按照核外电子排布,可把元素周期表划分为5个区,
 在元素周期表中属于
在元素周期表中属于(2)
 是
是 的一种重要配合物。
的一种重要配合物。①该配合物的一种配体是
 ,
, 的空间结构呈
的空间结构呈②
 的价层电子轨道表示式是
的价层电子轨道表示式是③
 中含有的
中含有的 键的数目为
键的数目为 代表阿伏加德罗常数) 。
代表阿伏加德罗常数) 。④设计实验证实该配合物溶于水时,离子键发生断裂,配位键没有断裂。实验如下:称取
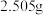 该配合物,先加水溶解,再加足量
该配合物,先加水溶解,再加足量 溶液,
溶液, ,相对分子质量
,相对分子质量 :250.5;
:250.5; :143.5) 。
:143.5) 。(3)第ⅤA族元素及其化合物的结构和性质如下:
①
 、
、 、
、 的沸点由高到低的顺序为
的沸点由高到低的顺序为②某一种氮化硼晶体的立方晶胞结构如图:

i.氮化硼
 属于
属于 的熔点
的熔点 (填>、<、=)。
(填>、<、=)。ii.已知氮化硼
 晶胞的边长为
晶胞的边长为 ,则晶胞密度为
,则晶胞密度为 (用含有a、
(用含有a、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
6 . 回答下列问题:
(1)肼(N2H4)分子可视为NH3中的一个氢原子被—NH2(氨基)取代形成的氢化物。
①NH3分子的VSEPR模型是___________ ;N2H4分子中氮原子轨道的杂化类型是___________ 。
②肼作火箭燃料:N2O4+2N2H4=3N2+4H2O若反应中有4 mol N—H键断裂,则形成的π键有___________ mol。
(2)VIA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。H2Se的热稳定性比H2S___________ (填“强”或“弱”)。SO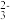 离子的立体构型为
离子的立体构型为___________ 。
(3)过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=___________ 。CO与N2结构相似,CO分子内σ键与π键个数之比为___________ 。
(1)肼(N2H4)分子可视为NH3中的一个氢原子被—NH2(氨基)取代形成的氢化物。
①NH3分子的VSEPR模型是
②肼作火箭燃料:N2O4+2N2H4=3N2+4H2O若反应中有4 mol N—H键断裂,则形成的π键有
(2)VIA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。H2Se的热稳定性比H2S
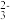 离子的立体构型为
离子的立体构型为(3)过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=
您最近一年使用:0次
7 . 铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)基态Cu原子的价电子排布式为_______ ;在周期表中,Cu元素属于_______ 区。
(2)往硫酸铜溶液中加入氨水,先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色透明溶液,写出沉淀溶解的离子方程式:_______ 。
(3)1mol[Cu(H2O)4]2+中含有σ键的数目为_______ 。
(4)[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl—取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为_______ ,其结构可用示意图表示为_______ 。
(1)基态Cu原子的价电子排布式为
(2)往硫酸铜溶液中加入氨水,先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色透明溶液,写出沉淀溶解的离子方程式:
(3)1mol[Cu(H2O)4]2+中含有σ键的数目为
(4)[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl—取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为
您最近一年使用:0次
名校
解题方法
8 . 第VA族元素氮、磷、砷、锑在生产、科研有着重要用途。
(1)乙腈CH3CN常用于制备含氮有机化合物,与水混溶。乙腈分子中含有的σ键与π键数目之比为_______ ;能与水混溶的原因是_______ 。
(2)咪唑可作为铜的防锈剂而用于印刷电路版和集成电路。咪唑分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取_______ 杂化。

(3)Fe3+与水会形成黄色的配离子[Fe(OH)]2+,为避免颜色干扰,常在含Fe3+溶液中加入H3PO4形成无色的[Fe(PO4)2]3-。由此推测与Fe3+形成的配离子更稳定的配体是____ ,配位原子是____ 。
(4)砒霜有剧毒,可用石灰消毒生成 和少量
和少量 。基态33As原子的原子结构示意图是
。基态33As原子的原子结构示意图是_______ , 的空间构型为
的空间构型为_______ 。
(5)某铁、镧、锑的合金晶胞如图l所示,铁原子位于锑原子构成的正八面体的体心,晶胞的6个表面结构都如图2所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如图l中A点锑原子的坐标为 。已知晶胞中La的原子分数坐标有两种,分别为(0,0,0)和
。已知晶胞中La的原子分数坐标有两种,分别为(0,0,0)和_______ 。
②该合金的化学式是_______ 。
③若该晶体的密度为ρg·m-3,晶胞参数为anm,计算阿伏加德罗常数的值NA=_______ 。(用含ρ、a的计算式表示)
(1)乙腈CH3CN常用于制备含氮有机化合物,与水混溶。乙腈分子中含有的σ键与π键数目之比为
(2)咪唑可作为铜的防锈剂而用于印刷电路版和集成电路。咪唑分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取

(3)Fe3+与水会形成黄色的配离子[Fe(OH)]2+,为避免颜色干扰,常在含Fe3+溶液中加入H3PO4形成无色的[Fe(PO4)2]3-。由此推测与Fe3+形成的配离子更稳定的配体是
(4)砒霜有剧毒,可用石灰消毒生成
 和少量
和少量 。基态33As原子的原子结构示意图是
。基态33As原子的原子结构示意图是 的空间构型为
的空间构型为(5)某铁、镧、锑的合金晶胞如图l所示,铁原子位于锑原子构成的正八面体的体心,晶胞的6个表面结构都如图2所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如图l中A点锑原子的坐标为
 。已知晶胞中La的原子分数坐标有两种,分别为(0,0,0)和
。已知晶胞中La的原子分数坐标有两种,分别为(0,0,0)和②该合金的化学式是
③若该晶体的密度为ρg·m-3,晶胞参数为anm,计算阿伏加德罗常数的值NA=
您最近一年使用:0次
名校
解题方法
9 . 铜及其化合物在科学研究和工农业生产中有许多用途。回答下列问题:
(1)①将氨水逐滴加入硫酸铜溶液中,先生成蓝色沉淀,继续滴加氨水,沉淀溶解并得到深蓝色溶液,写出沉淀溶解的离子方程式:____ 。
②向深蓝色溶液中继续加入乙醇,会析出深蓝色的晶体[Cu(NH3)4]SO4•H2O。在该晶体中1mol[Cu(NH3)4]2+含有σ键的数目为____ 。
③[Cu(NH3)4]2+中各元素电负性由大到小的顺序为____ ,其中N原子的杂化轨道类型为____ 。
④[Cu(NH3)4]2+中NH3的键角比独立存在的分子结构中的键角____ 。(填“大”“小”或“相等”)
(2)Cu−Mn−Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示。
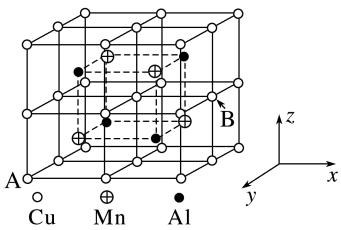
①合金的化学式为____ 。
②若A原子的坐标参数为(0,1,0),则B原子的坐标参数为____ 。
③已知该合金晶体的密度为ρg•cm-3,则最近的两个Al原子间的距离为___ nm(阿伏加德罗常数的值用NA表示)。
(1)①将氨水逐滴加入硫酸铜溶液中,先生成蓝色沉淀,继续滴加氨水,沉淀溶解并得到深蓝色溶液,写出沉淀溶解的离子方程式:
②向深蓝色溶液中继续加入乙醇,会析出深蓝色的晶体[Cu(NH3)4]SO4•H2O。在该晶体中1mol[Cu(NH3)4]2+含有σ键的数目为
③[Cu(NH3)4]2+中各元素电负性由大到小的顺序为
④[Cu(NH3)4]2+中NH3的键角比独立存在的分子结构中的键角
(2)Cu−Mn−Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示。

①合金的化学式为
②若A原子的坐标参数为(0,1,0),则B原子的坐标参数为
③已知该合金晶体的密度为ρg•cm-3,则最近的两个Al原子间的距离为
您最近一年使用:0次
名校
10 . 铜单质及其化合物在很多领域都有着重要用途,如金属铜可用来制造各项体育赛事的奖牌、电线、电缆,胆矾可用作杀菌剂等。试回答下列问题。
(1)Cu+的价电子排布式为_______ 。
(2)下列分子或离子中,能提供孤电子对与Cu2+形成配位键的是_______(填序号,下同)。
①H2O ②NH3 ③F- ④CN-
(3)向盛有硫酸铜溶液的试管中加入氨水,首先形成难溶物,继续加入氨水,难溶物溶解并得到深蓝色的透明溶液。
①请分别写出难溶物形成、难溶物溶解得到深蓝色透明溶液涉及的离子反应方程式:_______ ;_______ 。
②对上述现象叙述正确的是_______
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后生成深蓝色的[Cu(NH3)4]2+
C.若硫酸铜溶液中混有少量硫酸,则可用氨水除去硫酸铜溶液中的硫酸
D.在[Cu(NH3)4]2+中,NH3提供孤电子对,Cu2+提供空轨道
(4)回答下列关于[Cu(NH3)4]SO4的问题:
①[Cu(NH3)4]SO4中所含的化学键类型有_______ ;
②[Cu(NH3)4]SO4的配体空间构型为_______ 。
③1mol[Cu(NH3)4]SO4中含有的σ键数目为_______ 。
(1)Cu+的价电子排布式为
(2)下列分子或离子中,能提供孤电子对与Cu2+形成配位键的是_______(填序号,下同)。
①H2O ②NH3 ③F- ④CN-
| A.①② | B.①②③ | C.①②④ | D.①②③④ |
①请分别写出难溶物形成、难溶物溶解得到深蓝色透明溶液涉及的离子反应方程式:
②对上述现象叙述正确的是
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后生成深蓝色的[Cu(NH3)4]2+
C.若硫酸铜溶液中混有少量硫酸,则可用氨水除去硫酸铜溶液中的硫酸
D.在[Cu(NH3)4]2+中,NH3提供孤电子对,Cu2+提供空轨道
(4)回答下列关于[Cu(NH3)4]SO4的问题:
①[Cu(NH3)4]SO4中所含的化学键类型有
②[Cu(NH3)4]SO4的配体空间构型为
③1mol[Cu(NH3)4]SO4中含有的σ键数目为
您最近一年使用:0次



