解题方法
1 . 锂单质及化合物用途广泛,涉及电池、陶瓷、玻璃、润滑剂、制冷液、核工业等领域。
(1)锂离子电池的电解液有LiBF4,等,碳酸亚乙酯(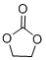 )用作该电解液的添加剂。
)用作该电解液的添加剂。
①LiBF4中阴离子的空间构型为_______ ,LiBF4中不存在______ (填序号)。
A.离子键 B.极性共价键 C.配位键 D.氢键
②碳酸亚乙酯分子中σ键与π键数目之比为______ 。酯密度一般比水小,难溶于水,而碳酸亚乙酯能溶于水的主要原因是______ 。
(2)碱金属在空气中燃烧时,只有锂生成普通氧化物 。
。 是离子晶体,其晶格能可通过下图的
是离子晶体,其晶格能可通过下图的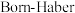 循环计算得到。
循环计算得到。
①由图中数据可知O=O键键能为___________  ,
, 晶格能为
晶格能为___________  。
。
② 和
和 的熔点如下表所示:
的熔点如下表所示:
熔点差异的原因是___________ 。
(1)锂离子电池的电解液有LiBF4,等,碳酸亚乙酯(
 )用作该电解液的添加剂。
)用作该电解液的添加剂。①LiBF4中阴离子的空间构型为
A.离子键 B.极性共价键 C.配位键 D.氢键
②碳酸亚乙酯分子中σ键与π键数目之比为
(2)碱金属在空气中燃烧时,只有锂生成普通氧化物
 。
。 是离子晶体,其晶格能可通过下图的
是离子晶体,其晶格能可通过下图的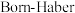 循环计算得到。
循环计算得到。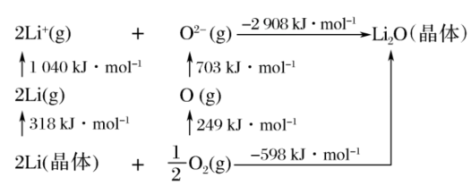
①由图中数据可知O=O键键能为
 ,
, 晶格能为
晶格能为 。
。②
 和
和 的熔点如下表所示:
的熔点如下表所示:| 氧化物 |  |  |
| 熔点/℃ | 1570 | 2800 |
熔点差异的原因是
您最近一年使用:0次
解题方法
2 . 卤族元素的单质和化合物在生产生活中有重要用途。
(1)某浓度的HF溶液中,氟化氢主要以(HF)2缔合形式存在。使氟化氢分子缔合的作用力是___________ ;气态氟化氢分子的热稳定性大于氯化氢的原因是___________ 。
(2)氯元素有多种含氧酸根离子。 中氯原子的杂化类型为
中氯原子的杂化类型为___________ , 的空间结构为
的空间结构为___________ 。
(3)几种卤化锌的熔点见表:
则x___________ (填“大于”或“小于”)283,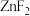 熔点远高于
熔点远高于 ,原因为
,原因为___________ 。
(4)2-碘酰基苯甲酸是典型的高价碘试剂,在有机合成中用作氧化剂,结构如图:

其分子中 键个数为
键个数为___________ ,基态碘原子的价电子轨道式为___________ 。
(1)某浓度的HF溶液中,氟化氢主要以(HF)2缔合形式存在。使氟化氢分子缔合的作用力是
(2)氯元素有多种含氧酸根离子。
 中氯原子的杂化类型为
中氯原子的杂化类型为 的空间结构为
的空间结构为(3)几种卤化锌的熔点见表:
| 物质 | 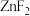 |  |  |
| 熔点/℃ | 872 | 283 | x |
则x
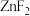 熔点远高于
熔点远高于 ,原因为
,原因为(4)2-碘酰基苯甲酸是典型的高价碘试剂,在有机合成中用作氧化剂,结构如图:

其分子中
 键个数为
键个数为
您最近一年使用:0次
解题方法
3 . 锌及其化合物在工农业生产及科学研究中具有广泛的用途。回答下列问题:
(1)Zn位于元素周期表的___________ 区,基态Zn2+的核外电子排布式为___________ 。
(2)氨基酸锌是研究最早和使用最广泛的第三代锌添加剂,该添加剂具有优良的营养功能。如图1是氨基酸锌的结构简式。
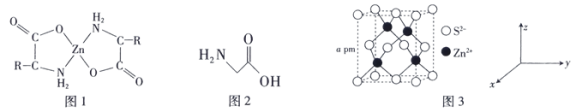
①组成氨基酸锌的C、N、O的电负性由大到小的顺序是___________ 。
②氨基酸锌的Zn2+形成配位键,其中提供空轨道的原子是___________ 。
③最简单的氨基酸是甘氨酸(结构简式如图2),其结构中π键与σ键的数量比为___________ 。
(3)ZnS可用于制白色颜料、玻璃、发光粉、橡胶、塑料、发光油漆等。ZnS的晶胞如图3所示。
①上图中 的坐标有
的坐标有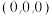 、
、 ,与
,与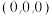 距离最近的
距离最近的 还有
还有___________ (填坐标)。
②Zn2+占据___________ (填“八面体”或“四面体”)空隙,空隙利用率为___________ %。
③ZnS的密度为___________  。
。
(1)Zn位于元素周期表的
(2)氨基酸锌是研究最早和使用最广泛的第三代锌添加剂,该添加剂具有优良的营养功能。如图1是氨基酸锌的结构简式。

①组成氨基酸锌的C、N、O的电负性由大到小的顺序是
②氨基酸锌的Zn2+形成配位键,其中提供空轨道的原子是
③最简单的氨基酸是甘氨酸(结构简式如图2),其结构中π键与σ键的数量比为
(3)ZnS可用于制白色颜料、玻璃、发光粉、橡胶、塑料、发光油漆等。ZnS的晶胞如图3所示。
①上图中
 的坐标有
的坐标有 、
、 ,与
,与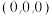 距离最近的
距离最近的 还有
还有②Zn2+占据
③ZnS的密度为
 。
。
您最近一年使用:0次
2021-07-05更新
|
127次组卷
|
2卷引用:湖北省2020-2021学年高二下学期7月统一调研测试化学试题
解题方法
4 . Al、Cr、Co、Ni的合金及其相关化合物用途非常广泛,如锂离子电池的正极材料为LiCoO2,电解质溶液为LiBF4溶液。
(1)Co2+的基态核外电子排布式为_______ 。
(2)钴元素可形成种类繁多的配合物。三氯五氨合钴的化学式为Co(NH3)5Cl3,是一种典型的维尔纳配合物,具有反磁性。0.01molCo(NH3)5Cl3与足量硝酸银溶液反应时生成2.87g白色沉淀。Co(NH3)5Cl3中Co3+的配位数为_______ ,该配合物中的配位原子为_______ 。
(3)1951年Tsao最早报道了用LiAlH4还原腈:

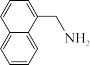 。
。
①LiAlH4中三种元素的电负性从大到小的顺序为_______ (用元素符号表示)。
② 中碳原子的轨道杂化类型为
中碳原子的轨道杂化类型为_______ ,1mol该分子中含σ键的物质的量为_______ 。
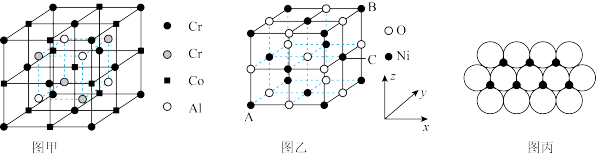
(4)全惠斯勒合金CrxCoyAlz的晶胞结构如图甲所示,其化学式为_______ 。
(5)NiO的晶胞结构如图乙所示其中离子坐标参数A为(0,0,0),则C的离子坐标参数为_______ 。一定温度下,NiO晶体可以自发地分散并形成“单分子层”可以认为O2-作密置单层排列,Ni2+填充其中(如图丙),已知O2-的半径为apm,设阿伏加德罗常数的值为NA,每平方米的面积上具有该晶体的质量为_______ g(用含a、NA的代数式表示,Ni的相对原子质量为59)。
(1)Co2+的基态核外电子排布式为
(2)钴元素可形成种类繁多的配合物。三氯五氨合钴的化学式为Co(NH3)5Cl3,是一种典型的维尔纳配合物,具有反磁性。0.01molCo(NH3)5Cl3与足量硝酸银溶液反应时生成2.87g白色沉淀。Co(NH3)5Cl3中Co3+的配位数为
(3)1951年Tsao最早报道了用LiAlH4还原腈:


 。
。①LiAlH4中三种元素的电负性从大到小的顺序为
②
 中碳原子的轨道杂化类型为
中碳原子的轨道杂化类型为(4)全惠斯勒合金CrxCoyAlz的晶胞结构如图甲所示,其化学式为

(5)NiO的晶胞结构如图乙所示其中离子坐标参数A为(0,0,0),则C的离子坐标参数为
您最近一年使用:0次
解题方法
5 . 铁及其化合物在国民生产、生活中用途广泛。
(1)向FeCl3溶液加入少量的KSCN溶液,生成红色的[Fe(SCN)(H2O)5]2+。N、C、H元素的第一电离能由大到小的顺序为___________ ,O、N、C、H四种元素电负性最大的是___________ (填元素符号) 。
(2)FeCl3 与K4[Fe(CN)6]溶液混合生成Fe4[Fe(CN)6]3沉淀。配体CN-中C原子的杂化方式为___________ ,CH2=CHCH2CN分子中σ键与π键的数目比n(σ)∶n(π)=___________ 。
(3)用邻二氮菲(phen,如图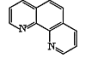 )与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。
)与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。
①[Fe(phen)3]2+中,存在的化学键有___________ (填序号)。
a.配位键 b.离子键 c.π键 d.氢键
②用邻二氮菲测定Fe2+浓度时应控制pH为2~9的适宜范围,请解释原因___________ 。
(4)铁合金用途广泛,某种铁镁合金储氢效率很高,其晶胞如图所示。
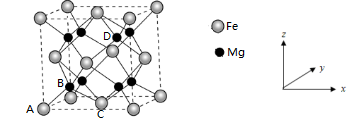
晶体中每个铁原子周围距离最近的镁原子有___________ 个,原子坐标参数可以表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0,0,0),B为( ),C为(
),C为(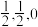 ),则D点坐标参数为
),则D点坐标参数为___________ 。
(1)向FeCl3溶液加入少量的KSCN溶液,生成红色的[Fe(SCN)(H2O)5]2+。N、C、H元素的第一电离能由大到小的顺序为
(2)FeCl3 与K4[Fe(CN)6]溶液混合生成Fe4[Fe(CN)6]3沉淀。配体CN-中C原子的杂化方式为
(3)用邻二氮菲(phen,如图
 )与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。
)与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。①[Fe(phen)3]2+中,存在的化学键有
a.配位键 b.离子键 c.π键 d.氢键
②用邻二氮菲测定Fe2+浓度时应控制pH为2~9的适宜范围,请解释原因
(4)铁合金用途广泛,某种铁镁合金储氢效率很高,其晶胞如图所示。

晶体中每个铁原子周围距离最近的镁原子有
 ),C为(
),C为(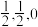 ),则D点坐标参数为
),则D点坐标参数为
您最近一年使用:0次
2021-01-29更新
|
298次组卷
|
2卷引用:山东省烟台市2020-2021学年高二上学期期末考试化学试题



