名校
1 . 高锰酸钾( )是一种重要的化工原料,也是实验室中常用的强氧化剂,在生物医药方面也有重要用途。工业生产高锰酸钾涉及的一个反应为
)是一种重要的化工原料,也是实验室中常用的强氧化剂,在生物医药方面也有重要用途。工业生产高锰酸钾涉及的一个反应为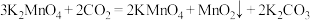 ,设NA为阿伏加德罗常数的值,下列说法错误的是
,设NA为阿伏加德罗常数的值,下列说法错误的是
 )是一种重要的化工原料,也是实验室中常用的强氧化剂,在生物医药方面也有重要用途。工业生产高锰酸钾涉及的一个反应为
)是一种重要的化工原料,也是实验室中常用的强氧化剂,在生物医药方面也有重要用途。工业生产高锰酸钾涉及的一个反应为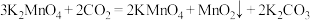 ,设NA为阿伏加德罗常数的值,下列说法错误的是
,设NA为阿伏加德罗常数的值,下列说法错误的是| A.11g金属锰其原子处于基态时,含有的未成对电子数为NA |
B.该反应中有1mol  参与反应时,转移的电子数为NA 参与反应时,转移的电子数为NA |
C.2L 0.5 的 的 溶液中 溶液中 和 和 总数为NA 总数为NA |
D.标准状况下,11.2L  中含有的π键数目为NA 中含有的π键数目为NA |
您最近一年使用:0次
名校
解题方法
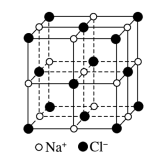
2 . 金刚石硬度大,熔点高,用途非常广泛。工业上利用反应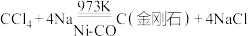 人工合成金刚石。已知:氯化钠晶胞结构如图所示,相邻的
人工合成金刚石。已知:氯化钠晶胞结构如图所示,相邻的 与
与 的距离为
的距离为 。设
。设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
(1) 、
、 、金刚石三种物质的熔沸点由大到小的顺序
、金刚石三种物质的熔沸点由大到小的顺序___________ ;并解释说明理由___________ 。
(2)12g金刚石(晶体结构如图所示)中含有C-C键的数目为___________ 。

(3) 晶体中每个
晶体中每个 周围与它最近且等距离的
周围与它最近且等距离的 有
有___________ 个,若 晶体密度为
晶体密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为___________ 。
(4)比较 和
和 分子中的键角大小
分子中的键角大小___________ ;并解释说明理由___________ 。
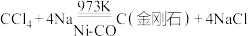 人工合成金刚石。已知:氯化钠晶胞结构如图所示,相邻的
人工合成金刚石。已知:氯化钠晶胞结构如图所示,相邻的 与
与 的距离为
的距离为 。设
。设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
(1)
 、
、 、金刚石三种物质的熔沸点由大到小的顺序
、金刚石三种物质的熔沸点由大到小的顺序(2)12g金刚石(晶体结构如图所示)中含有C-C键的数目为

(3)
 晶体中每个
晶体中每个 周围与它最近且等距离的
周围与它最近且等距离的 有
有 晶体密度为
晶体密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为(4)比较
 和
和 分子中的键角大小
分子中的键角大小
您最近一年使用:0次
名校
解题方法
3 . 磷、碳、氢、氧等非金属及其化合物用途广泛。回答下列问题:
(1)白磷(P4)在氯气中燃烧可生成PCl3和PCl5。
①31 g白磷(P4)中含有化学键的数目为_______ 。(用NA表示阿伏伽德罗常数的值)
②形成PCl5时,P原子的一个3s电子激发入3d轨道后参与成键,该激发态的价电子排布式为_______ 。
③研究表明,在加压条件下PCl5于148℃液化时能发生与水类似的自耦电离,形成一种能导电的熔体,其电离方程式为_______ ,产生的阳离子的空间结构为_______ 。
(2)分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为 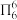 )。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为
)。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为_______ ,一定在同一平面上的原子有_______ 个;乙醇显中性而苯酚显酸性的原因是:在大π键中氧的p电子云向苯环转移,_______ 。
(3)可溶性普鲁士蓝晶体属立方晶系,晶胞棱长为a pm,铁-氰骨架组成的小立方体中,Fe粒子在顶点,CN—在棱上,两端均与Fe相连,立方体中心空隙可容纳K+,如图所示(CN—在图中省略)。
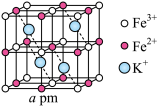
①该化合物的化学式为_______ 。
②若所有铁粒子均视为等径小球,则K+与Fe2+之间最近距离为_______ pm;该晶体的密度为_______ g•cm-3(阿伏加德罗常数为NA)
(1)白磷(P4)在氯气中燃烧可生成PCl3和PCl5。
①31 g白磷(P4)中含有化学键的数目为
②形成PCl5时,P原子的一个3s电子激发入3d轨道后参与成键,该激发态的价电子排布式为
③研究表明,在加压条件下PCl5于148℃液化时能发生与水类似的自耦电离,形成一种能导电的熔体,其电离方程式为
(2)分子中的大π键可用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为 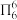 )。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为
)。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为(3)可溶性普鲁士蓝晶体属立方晶系,晶胞棱长为a pm,铁-氰骨架组成的小立方体中,Fe粒子在顶点,CN—在棱上,两端均与Fe相连,立方体中心空隙可容纳K+,如图所示(CN—在图中省略)。

①该化合物的化学式为
②若所有铁粒子均视为等径小球,则K+与Fe2+之间最近距离为
您最近一年使用:0次
名校
解题方法
4 . N、P的单质及化合物有重要的用途。请回答:
(1)白磷 为正四面体结构,
为正四面体结构, 分子中P原子的价层电子对数为
分子中P原子的价层电子对数为_______ ,从能量角度看,氮以 而白磷以
而白磷以 形式存在的原因是
形式存在的原因是_______ 。
(2) 离子的空间结构如图所示(孤电子对已标出),其空间构型为V形,则N原子a的杂化类型为
离子的空间结构如图所示(孤电子对已标出),其空间构型为V形,则N原子a的杂化类型为_______ ,N原子b的杂化类型为_______ 。
(4)甘氨酸(结构简式为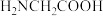 和氢氧化铜反应可制得重要的饲料添加剂甘氨酸铜,在甘氨酸分子中,存在
和氢氧化铜反应可制得重要的饲料添加剂甘氨酸铜,在甘氨酸分子中,存在_______ 个 键,
键,_______ 个 键(填数字)。甘氨酸铜有两种结构(如图),已知两种结构中Cu周围的4个原子共平面,则在水中溶解度较大的是
键(填数字)。甘氨酸铜有两种结构(如图),已知两种结构中Cu周围的4个原子共平面,则在水中溶解度较大的是_______ (填“A”或“B”)。
(1)白磷
 为正四面体结构,
为正四面体结构, 分子中P原子的价层电子对数为
分子中P原子的价层电子对数为 而白磷以
而白磷以 形式存在的原因是
形式存在的原因是| 化学键 |  |  | 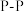 |  |
键能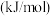 | 193 | 946 | 197 | 489 |
 离子的空间结构如图所示(孤电子对已标出),其空间构型为V形,则N原子a的杂化类型为
离子的空间结构如图所示(孤电子对已标出),其空间构型为V形,则N原子a的杂化类型为
A.电负性: |
B.因为 键键能大于 键键能大于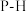 键,故 键,故 的沸点高于 的沸点高于 |
C.由于成键电子对间的斥力较小, 的键角小于 的键角小于 的键角 的键角 |
D.氧化物对应水化物的酸性: |
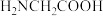 和氢氧化铜反应可制得重要的饲料添加剂甘氨酸铜,在甘氨酸分子中,存在
和氢氧化铜反应可制得重要的饲料添加剂甘氨酸铜,在甘氨酸分子中,存在 键,
键, 键(填数字)。甘氨酸铜有两种结构(如图),已知两种结构中Cu周围的4个原子共平面,则在水中溶解度较大的是
键(填数字)。甘氨酸铜有两种结构(如图),已知两种结构中Cu周围的4个原子共平面,则在水中溶解度较大的是
您最近一年使用:0次
解题方法
5 . 氮、磷、砷及其化合物在生产、生活中用途广泛。回答下列问题:
(1) 结构式为
结构式为 ,分子中
,分子中 键和π键个数比
键和π键个数比_______ 。
(2)氮、磷、砷的简单气态氢化物的沸点由高到低的顺序为_______ (填化学式,下同),键角由大到小的顺序为_______ 。
(3)磷酸和亚砷酸 ,酸性较强的是
,酸性较强的是_______ ,原因是_______ 。
(4)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,继续滴加氨水至沉淀恰好完全溶解,得到深蓝色溶液,再向其中加入乙醇可以得到深蓝色[Cu(NH3)2]SO4∙H2O沉淀。
①沉淀溶解时发生的离子反应方程式为_______ 。
②[Cu(NH3)4]2+为平面四边形结构,则离子中Cu2+杂化方式为_______ (填标号)。
A.sp2 B.sp3 C.dsp2 D.dsp3
(1)
 结构式为
结构式为 ,分子中
,分子中 键和π键个数比
键和π键个数比(2)氮、磷、砷的简单气态氢化物的沸点由高到低的顺序为
(3)磷酸和亚砷酸
 ,酸性较强的是
,酸性较强的是(4)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,继续滴加氨水至沉淀恰好完全溶解,得到深蓝色溶液,再向其中加入乙醇可以得到深蓝色[Cu(NH3)2]SO4∙H2O沉淀。
①沉淀溶解时发生的离子反应方程式为
②[Cu(NH3)4]2+为平面四边形结构,则离子中Cu2+杂化方式为
A.sp2 B.sp3 C.dsp2 D.dsp3
您最近一年使用:0次
22-23高三上·天津河北·期末
名校
解题方法
6 . 请回答下列问题。
(1)钴及其化合物有重要的用途,探究其结构有重要意义。
①请写出基态钴原子的核外电子排布式_________ 。
②按照核外电子排布,可把元素周期表划分为5个区, 在元素周期表中属于
在元素周期表中属于_________ 区。
(2)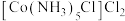 是
是 的一种重要配合物。
的一种重要配合物。
①该配合物的一种配体是 ,
, 的空间结构呈
的空间结构呈_________ 形,是_________ (填“极性”或“非极性)分子。
② 的价层电子轨道表示式是
的价层电子轨道表示式是_________ 。
③ 中含有的
中含有的 键的数目为
键的数目为_________ (用 代表阿伏加德罗常数) 。
代表阿伏加德罗常数) 。
④设计实验证实该配合物溶于水时,离子键发生断裂,配位键没有断裂。实验如下:称取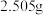 该配合物,先加水溶解,再加足量
该配合物,先加水溶解,再加足量 溶液,
溶液,_________ (补全实验操作),称量沉淀质量为_________ (精确到 ,相对分子质量
,相对分子质量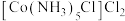 :250.5;
:250.5; :143.5) 。
:143.5) 。
(3)第ⅤA族元素及其化合物的结构和性质如下:
① 、
、 、
、 的沸点由高到低的顺序为
的沸点由高到低的顺序为_________ (填化学式,下同),键角由大到小的顺序为_________ 。
②某一种氮化硼晶体的立方晶胞结构如图:
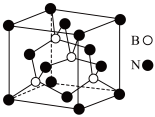
i.氮化硼 属于
属于_________ 晶体;该种氮化硼 的熔点
的熔点_________  (填>、<、=)。
(填>、<、=)。
ii.已知氮化硼 晶胞的边长为
晶胞的边长为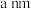 ,则晶胞密度为
,则晶胞密度为_________  (用含有a、
(用含有a、 的代数式表示)。
的代数式表示)。
(1)钴及其化合物有重要的用途,探究其结构有重要意义。
①请写出基态钴原子的核外电子排布式
②按照核外电子排布,可把元素周期表划分为5个区,
 在元素周期表中属于
在元素周期表中属于(2)
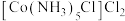 是
是 的一种重要配合物。
的一种重要配合物。①该配合物的一种配体是
 ,
, 的空间结构呈
的空间结构呈②
 的价层电子轨道表示式是
的价层电子轨道表示式是③
 中含有的
中含有的 键的数目为
键的数目为 代表阿伏加德罗常数) 。
代表阿伏加德罗常数) 。④设计实验证实该配合物溶于水时,离子键发生断裂,配位键没有断裂。实验如下:称取
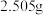 该配合物,先加水溶解,再加足量
该配合物,先加水溶解,再加足量 溶液,
溶液, ,相对分子质量
,相对分子质量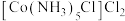 :250.5;
:250.5; :143.5) 。
:143.5) 。(3)第ⅤA族元素及其化合物的结构和性质如下:
①
 、
、 、
、 的沸点由高到低的顺序为
的沸点由高到低的顺序为②某一种氮化硼晶体的立方晶胞结构如图:

i.氮化硼
 属于
属于 的熔点
的熔点 (填>、<、=)。
(填>、<、=)。ii.已知氮化硼
 晶胞的边长为
晶胞的边长为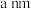 ,则晶胞密度为
,则晶胞密度为 (用含有a、
(用含有a、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
7 . 第三周期元素的单质及其化合物具有重要用途。在熔融状态下,可用金属钠制备金属钾;MgCl2可制备多种镁产品;Al-空气电池具有较高的比能量,在碱性电解液中总反应式为4Al+3O2+6H2O=4[Al(OH)4]-;高纯硅广泛用于信息技术领域,高温条件下,将粗硅转化为三氯硅烷(SiHCl3),再经H2还原得到高纯硅。下列说法正确的是
| A.钠燃烧时火焰呈黄色与电子跃迁有关 | B.SiHCl3的空间结构模型是正四面体形 |
| C.1mol[Al(OH)4]-中含有4molσ键 | D.Si-Si键的键能大于Si-O键的键能 |
您最近一年使用:0次
22-23高三上·广东广州·阶段练习
名校
解题方法
8 . 第VA族元素氮、磷、砷、锑在生产、科研有着重要用途。
(1)乙腈CH3CN常用于制备含氮有机化合物,与水混溶。乙腈分子中含有的σ键与π键数目之比为_______ ;能与水混溶的原因是_______ 。
(2)咪唑可作为铜的防锈剂而用于印刷电路版和集成电路。咪唑分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取_______ 杂化。

(3)Fe3+与水会形成黄色的配离子[Fe(OH)]2+,为避免颜色干扰,常在含Fe3+溶液中加入H3PO4形成无色的[Fe(PO4)2]3-。由此推测与Fe3+形成的配离子更稳定的配体是____ ,配位原子是____ 。
(4)砒霜有剧毒,可用石灰消毒生成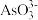 和少量
和少量 。基态33As原子的原子结构示意图是
。基态33As原子的原子结构示意图是_______ ,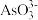 的空间构型为
的空间构型为_______ 。
(5)某铁、镧、锑的合金晶胞如图l所示,铁原子位于锑原子构成的正八面体的体心,晶胞的6个表面结构都如图2所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如图l中A点锑原子的坐标为 。已知晶胞中La的原子分数坐标有两种,分别为(0,0,0)和
。已知晶胞中La的原子分数坐标有两种,分别为(0,0,0)和_______ 。
②该合金的化学式是_______ 。
③若该晶体的密度为ρg·m-3,晶胞参数为anm,计算阿伏加德罗常数的值NA=_______ 。(用含ρ、a的计算式表示)
(1)乙腈CH3CN常用于制备含氮有机化合物,与水混溶。乙腈分子中含有的σ键与π键数目之比为
(2)咪唑可作为铜的防锈剂而用于印刷电路版和集成电路。咪唑分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取

(3)Fe3+与水会形成黄色的配离子[Fe(OH)]2+,为避免颜色干扰,常在含Fe3+溶液中加入H3PO4形成无色的[Fe(PO4)2]3-。由此推测与Fe3+形成的配离子更稳定的配体是
(4)砒霜有剧毒,可用石灰消毒生成
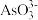 和少量
和少量 。基态33As原子的原子结构示意图是
。基态33As原子的原子结构示意图是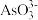 的空间构型为
的空间构型为(5)某铁、镧、锑的合金晶胞如图l所示,铁原子位于锑原子构成的正八面体的体心,晶胞的6个表面结构都如图2所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如图l中A点锑原子的坐标为
 。已知晶胞中La的原子分数坐标有两种,分别为(0,0,0)和
。已知晶胞中La的原子分数坐标有两种,分别为(0,0,0)和②该合金的化学式是
③若该晶体的密度为ρg·m-3,晶胞参数为anm,计算阿伏加德罗常数的值NA=
您最近一年使用:0次
名校
解题方法
9 . 明朝《天工开物》中有世界上最早的“火法”炼锌技术的记载。锌及其化合物在生产、生活中有着重要的用途。锌是生命体必需的微量元素,被称为“生命之花”。
(1)基态Zn原子核外电子共有____ 种空间运动状态。
(2)锌与铜在周期表中的位置相邻。现有4种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10失去1个电子需要的能量由大到小排序是____ (填字母)。
(3)锌在潮湿的空气中极易生成一层紧密的碱式碳酸锌[ZnCO3·3Zn(OH)2]薄膜,使其具有抗腐蚀性。其中CO 的空间构型为
的空间构型为____ (用文字描述)。与CO 互为等电子体的分子是
互为等电子体的分子是____ (写一种即可)。
(4)葡萄糖酸锌为有机锌补剂,对胃黏膜刺激小,在人体中吸收率高。如图是葡萄糖酸锌的结构简式。

①葡萄糖酸锌组成元素中电负性最大的元素为____ ,其中C原子的杂化方式为____ 。
②1mol葡萄糖酸分子中含有____ molσ键。葡萄糖酸的熔点小于葡萄糖酸锌的熔点原因是____ 。
(5)ZnS是一种性能优异的荧光材料,在自然界中有立方ZnS和六方ZnS两种晶型,其晶胞结构如图所示:

①立方ZnS中,Zn2+填充在S2—形成的____ 空隙中;
②六方ZnS的晶体密度为____ g·cm-3(设NA为阿伏加德罗常数的值)。
(1)基态Zn原子核外电子共有
(2)锌与铜在周期表中的位置相邻。现有4种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10失去1个电子需要的能量由大到小排序是
| A.④②①③ | B.④②③① | C.①②④③ | D.①④③② |
 的空间构型为
的空间构型为 互为等电子体的分子是
互为等电子体的分子是(4)葡萄糖酸锌为有机锌补剂,对胃黏膜刺激小,在人体中吸收率高。如图是葡萄糖酸锌的结构简式。

①葡萄糖酸锌组成元素中电负性最大的元素为
②1mol葡萄糖酸分子中含有
(5)ZnS是一种性能优异的荧光材料,在自然界中有立方ZnS和六方ZnS两种晶型,其晶胞结构如图所示:

①立方ZnS中,Zn2+填充在S2—形成的
②六方ZnS的晶体密度为
您最近一年使用:0次
2022-05-24更新
|
544次组卷
|
2卷引用:四川省宜宾市叙州区第一中学校2024届高三上学期一诊模拟考试理综化学试题
解题方法
10 . 铁及其化合物在国民生产、生活中用途广泛。
(1)向FeCl3溶液加入少量的KSCN溶液,生成红色的[Fe(SCN)(H2O)5]2+。N、C、H元素的第一电离能由大到小的顺序为___________ ,O、N、C、H四种元素电负性最大的是___________ (填元素符号) 。
(2)FeCl3 与K4[Fe(CN)6]溶液混合生成Fe4[Fe(CN)6]3沉淀。配体CN-中C原子的杂化方式为___________ ,CH2=CHCH2CN分子中σ键与π键的数目比n(σ)∶n(π)=___________ 。
(3)用邻二氮菲(phen,如图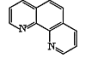 )与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。
)与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。
①[Fe(phen)3]2+中,存在的化学键有___________ (填序号)。
a.配位键 b.离子键 c.π键 d.氢键
②用邻二氮菲测定Fe2+浓度时应控制pH为2~9的适宜范围,请解释原因___________ 。
(4)铁合金用途广泛,某种铁镁合金储氢效率很高,其晶胞如图所示。
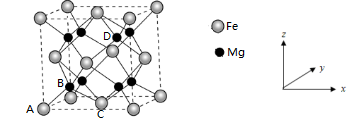
晶体中每个铁原子周围距离最近的镁原子有___________ 个,原子坐标参数可以表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0,0,0),B为( ),C为(
),C为(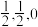 ),则D点坐标参数为
),则D点坐标参数为___________ 。
(1)向FeCl3溶液加入少量的KSCN溶液,生成红色的[Fe(SCN)(H2O)5]2+。N、C、H元素的第一电离能由大到小的顺序为
(2)FeCl3 与K4[Fe(CN)6]溶液混合生成Fe4[Fe(CN)6]3沉淀。配体CN-中C原子的杂化方式为
(3)用邻二氮菲(phen,如图
 )与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。
)与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。①[Fe(phen)3]2+中,存在的化学键有
a.配位键 b.离子键 c.π键 d.氢键
②用邻二氮菲测定Fe2+浓度时应控制pH为2~9的适宜范围,请解释原因
(4)铁合金用途广泛,某种铁镁合金储氢效率很高,其晶胞如图所示。

晶体中每个铁原子周围距离最近的镁原子有
 ),C为(
),C为(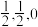 ),则D点坐标参数为
),则D点坐标参数为
您最近一年使用:0次
2021-01-29更新
|
299次组卷
|
2卷引用:河北省衡水市第十四中学2022-2023学年高二下学期第一次选择性考试化学试题



