名校
解题方法
1 . 下列说法正确的是
| A.HF、HCl、HBr、HI的熔沸点、还原性都依次升高(增强) |
| B.通常测定氟化氢的相对分子质量大于理论值,因分子间存在氢键 |
| C.BF3、NCl3、PH3中心原子的杂化方式相同 |
| D.各种含氯元素的酸性由强到弱排列为HCl<HClO<HClO2<HClO3<HClO4 |
您最近一年使用:0次
2 . 铜及其化合物在生产生活中有着广泛的应用。请回答:
(1)已知Cu第一电离能I1(Cu)=746 kJ·mol-1,Zn第一电离能I1(Zn)=906 kJ·mol-1;则第二电离能大小关系为I2(Cu)___________ I2(Zn)(填“>”、“=”或“<”)。。
(2)在碱性条件下CuSO4与双缩脲[HN(CONH2)2]生成紫色的配位化合物,该原理可用于检验蛋白质。该配位化合物的阴离子结构如图所示:
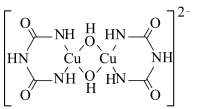
①该阴离子中所有元素的电负性从大到小的顺序为___________ 。
②该阴离子中氧原子的杂化方式为___________ ;
③lmol该阴离子含有σ键的数目为___________ ;
④该配合物中心铜离子的外围电子排布图为___________ ;
(3)磁性形状记忆材料Cu-Mn-Al合金的晶胞如图a所示(Mn、Al位于Cu形成的立方体体心位置),图b是沿立方格子对角面取得的截图,Cu在沿立方格子对角面取得截图中的相对位置如图c所示。

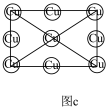
①该合金随温度升高,电导率_______ (填“升高”或“降低”或“不变”) ,原因为________ ;
②在图c中画出上图b切面上的Al和Mn的相对位置___________ (不考虑各原子的大小)。
(1)已知Cu第一电离能I1(Cu)=746 kJ·mol-1,Zn第一电离能I1(Zn)=906 kJ·mol-1;则第二电离能大小关系为I2(Cu)
(2)在碱性条件下CuSO4与双缩脲[HN(CONH2)2]生成紫色的配位化合物,该原理可用于检验蛋白质。该配位化合物的阴离子结构如图所示:

①该阴离子中所有元素的电负性从大到小的顺序为
②该阴离子中氧原子的杂化方式为
③lmol该阴离子含有σ键的数目为
④该配合物中心铜离子的外围电子排布图为
(3)磁性形状记忆材料Cu-Mn-Al合金的晶胞如图a所示(Mn、Al位于Cu形成的立方体体心位置),图b是沿立方格子对角面取得的截图,Cu在沿立方格子对角面取得截图中的相对位置如图c所示。


①该合金随温度升高,电导率
②在图c中画出上图b切面上的Al和Mn的相对位置
您最近一年使用:0次
名校
解题方法
3 . 铁、钴、镍都属于第VIII族元素,它们的单质、合金及其化合物在催化剂和能源领域用途非常广泛。
(1)结合电子排布式分析Fe3+比Co3+氧化性弱的原因:_______________________________ 。
(2)BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①CTCN的化学式为[Co(NH3)4CO3]NO3,与Co3+形成配位键的原子是____________ 。(已知 的结构式为
的结构式为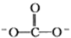 )
)
②NaNT可以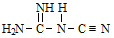 (双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为
(双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为________ ,1mol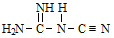 中含有σ键的物质的量为
中含有σ键的物质的量为___________ 。
③[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为_________________ 。
(3)一种新型的功能材料的晶胞结构如图1所示,它的化学式可表示为________ 。晶胞中离1个Mn原子最近的Ni原子有________ 个。
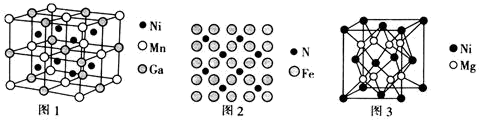
(4)铁触媒是合成氨反应的催化剂,其表面存在氮原子。氮原子在铁表面上的单层附着,局部示意图如图2所示。则铁表面上氮原子与铁原子的数目比为________ 。
(5)镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图3所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm。则镍镁晶体未储氢时的密度为________ g/cm3(列出计算表达式,NA表示阿伏加 德罗常数的数值).
(1)结合电子排布式分析Fe3+比Co3+氧化性弱的原因:
(2)BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①CTCN的化学式为[Co(NH3)4CO3]NO3,与Co3+形成配位键的原子是
 的结构式为
的结构式为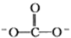 )
)②NaNT可以
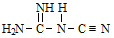 (双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为
(双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为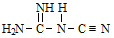 中含有σ键的物质的量为
中含有σ键的物质的量为③[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为
(3)一种新型的功能材料的晶胞结构如图1所示,它的化学式可表示为

(4)铁触媒是合成氨反应的催化剂,其表面存在氮原子。氮原子在铁表面上的单层附着,局部示意图如图2所示。则铁表面上氮原子与铁原子的数目比为
(5)镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图3所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm。则镍镁晶体未储氢时的密度为
您最近一年使用:0次
名校
4 . X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示。若Y原子为其所在周期中未成对电子最多的原子,下列说法中正确的是
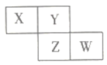

A. 的空间构型为V形 的空间构型为V形 |
| B.Y的最简单气态氢化物的水溶液显碱性 |
| C.Z的氯化物中各原子最外层一定满足8电子稳定结构 |
| D.W的氧化物对应水化物的酸性比Z的氧化物对应水化物的酸性强 |
您最近一年使用:0次
2021-07-04更新
|
118次组卷
|
4卷引用:内蒙古阿拉善盟第一中学2020-2021学年高二上学期第一次段考化学试题
5 . M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质M的晶体类型为____ ,晶体中原子间通过____ (填化学键类型)作用形成面心立方密堆积,其中M原子的配位数为____ 。
(2)元素Y基态原子的价电子排布图为____ 。元素Y的含氧酸中,酸性最强的是___ (写化学式),该酸根离子的立体构型为____ 。
(3)M与Y形成的一种化合物的立方晶胞如图所示。

①该化合物的化学式为____ ,已知晶胞参数a=0.542nm,此晶体的密度为____ g·cm-3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
②该化合物难溶于水但易溶于氨水,其原因是____ 。此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为____ 。
(4)CuCl的盐酸溶液能吸收CO生成复合物氯化羰基亚铜[Cu2Cl2(CO)2·2H2O],其结构如图。下列说法不正确的是____ 。

(5)向硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____ 。
(1)单质M的晶体类型为
(2)元素Y基态原子的价电子排布图为
(3)M与Y形成的一种化合物的立方晶胞如图所示。

①该化合物的化学式为
②该化合物难溶于水但易溶于氨水,其原因是
(4)CuCl的盐酸溶液能吸收CO生成复合物氯化羰基亚铜[Cu2Cl2(CO)2·2H2O],其结构如图。下列说法不正确的是

| A.该复合物中只含有离子键、配位键 |
| B.该复合物中Cl原子的杂化类型为sp3 |
| C.该复合物中只有CO和H2O作为配体 |
| D.CO与N2的价电子总数相同,其结构为C≡O |
您最近一年使用:0次



