解题方法
1 . 元素周期表中的四种元素A、B、C、D、E、F,原子序数依次增大。A的基态原子价层电子排布为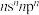 ;B的基态原子2p能级有3个单电子;C的原子最外层电子数是其内层的3倍;D的基态原子的3p轨道上有4个电子;
;B的基态原子2p能级有3个单电子;C的原子最外层电子数是其内层的3倍;D的基态原子的3p轨道上有4个电子;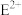 的3d轨道中有10个电子;F单质在金属活动性顺序中排在最末位。
的3d轨道中有10个电子;F单质在金属活动性顺序中排在最末位。
(1)A、B形成的 常作为配位化合物中的配体。在
常作为配位化合物中的配体。在 中,元素A的原子采取sp杂化,则A与B形成的化学键中含有的σ键与π键的数目之比为
中,元素A的原子采取sp杂化,则A与B形成的化学键中含有的σ键与π键的数目之比为___________ 。
(2)B的基态原子的价电子排布图___________ ;E的基态原子的电子排布式___________ ;C与D形成的DC3的空间构型为___________ ;C与D可形成的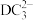 的VSEPR模型为
的VSEPR模型为___________ (用文字描述)。
(3)E与D所形成化合物晶体的晶胞如下图所示。在该晶胞中,E离子的数目为___________ ;与E离子周围紧邻且距离相等的D离子共有___________ 个;该化合物的化学式为___________ ;该晶胞边长为a pm,则E离子与D离子之间的最短距离为___________ cm。___________ 。
(5)E、F均能与 形成配离子,已知
形成配离子,已知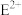 与
与 形成配离子时,配位数为4;
形成配离子时,配位数为4;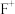 与
与 形成配离子时,配位数为2。工业上常用
形成配离子时,配位数为2。工业上常用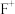 和
和 形成的配离子与E单质反应,生成
形成的配离子与E单质反应,生成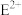 与
与 形成的配离子和F单质来提取F,写出上述反应的离子方程式
形成的配离子和F单质来提取F,写出上述反应的离子方程式___________ 。
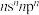 ;B的基态原子2p能级有3个单电子;C的原子最外层电子数是其内层的3倍;D的基态原子的3p轨道上有4个电子;
;B的基态原子2p能级有3个单电子;C的原子最外层电子数是其内层的3倍;D的基态原子的3p轨道上有4个电子;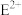 的3d轨道中有10个电子;F单质在金属活动性顺序中排在最末位。
的3d轨道中有10个电子;F单质在金属活动性顺序中排在最末位。(1)A、B形成的
 常作为配位化合物中的配体。在
常作为配位化合物中的配体。在 中,元素A的原子采取sp杂化,则A与B形成的化学键中含有的σ键与π键的数目之比为
中,元素A的原子采取sp杂化,则A与B形成的化学键中含有的σ键与π键的数目之比为(2)B的基态原子的价电子排布图
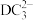 的VSEPR模型为
的VSEPR模型为(3)E与D所形成化合物晶体的晶胞如下图所示。在该晶胞中,E离子的数目为

(5)E、F均能与
 形成配离子,已知
形成配离子,已知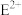 与
与 形成配离子时,配位数为4;
形成配离子时,配位数为4;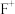 与
与 形成配离子时,配位数为2。工业上常用
形成配离子时,配位数为2。工业上常用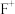 和
和 形成的配离子与E单质反应,生成
形成的配离子与E单质反应,生成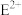 与
与 形成的配离子和F单质来提取F,写出上述反应的离子方程式
形成的配离子和F单质来提取F,写出上述反应的离子方程式
您最近半年使用:0次
2 . I.按构成晶体的粒子和粒子间作用力的不同,将以下晶体进行分类:
①氯化钡、②石英、③金刚砂、④水、⑤乙醇、⑥铜、⑦氯酸钾、⑧高锰酸钾、⑨稀有气体的晶体、⑩干冰
(1)属于共价晶体的有:___________ ;属于分子晶体的有:___________ ;属于离子晶体的有:___________ ;属于金属晶体的有:___________ 。
Ⅱ.比较:
(2)熔点:金刚石___________ 干冰(填“>”或“<”),原因是___________ 。
(3)键角:CH4___________ H2O(填“>”或“<”),原因是___________ 。
Ⅲ.请回答:
(4)黄铜合金采取面心立方堆积,其晶胞结构如图所示:___________ 。
②与Cu原子等距离且最近的Cu原子有___________ 个。
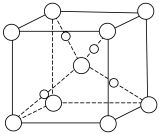
(5)甲醛与新制Cu(OH)2悬浊液加热可得砖红色沉淀Cu2O,已知Cu2O晶胞的结构如图所示:___________ 。
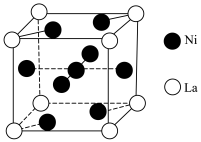
(6)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构如图。___________ 。
①氯化钡、②石英、③金刚砂、④水、⑤乙醇、⑥铜、⑦氯酸钾、⑧高锰酸钾、⑨稀有气体的晶体、⑩干冰
(1)属于共价晶体的有:
Ⅱ.比较:
(2)熔点:金刚石
(3)键角:CH4
Ⅲ.请回答:
(4)黄铜合金采取面心立方堆积,其晶胞结构如图所示:

②与Cu原子等距离且最近的Cu原子有
(5)甲醛与新制Cu(OH)2悬浊液加热可得砖红色沉淀Cu2O,已知Cu2O晶胞的结构如图所示:
(6)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构如图。
您最近半年使用:0次
解题方法
3 . 生产生活中处处有化学,结合物质与结构的相关知识,回答下列问题:
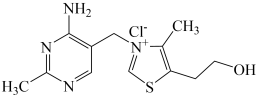
(1)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用,该物质的结构简式如图所示:___________ 。
a.离子键、共价键 b.离子键、氢键、共价键
c.氢键、范德华力 d.离子键、氢键、范德华力
②维生素B1燃烧可生成N2、NH3、CO2、SO2、H2O、HCl等物质,这些物质中属于非极性分子的化合物有___________ 。
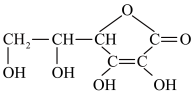
(2)维生素C的结构简式如下,它能防治坏血病,该分子中有___________ 个手性碳原子。___________ (填标号)。
a.原子轨道电子排布半充满时体系能量最低,电子排布式为[Ne]3s13p3
b.3p轨道的电子总是比3s轨道的电子在离核更远的区域运动
c.电负性比Al高,原子对键合电子的吸引力比Al大
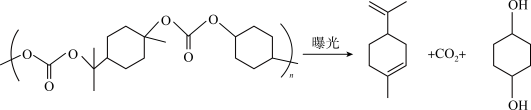
(4)近年来美国为了遏制中国发展,对我国发起了以封锁“芯片”为核心的全方位打压,此举激发了中国科技人员自研的决心。2022年10月宁波南大光电ArF光刻胶生产线正式投产,国内7 nm芯片制造材料获得重大突破。一种聚碳酸酯胶的曝光分解原理如下:___________ 。
②聚碳酸酯膜曝光后的产物加热可汽化或溶于水,加热汽化或溶于水克服的作用力有___________ 。
(5)金属钛密度小、强度高、抗腐蚀性能好,是应用广泛的金属。含钛的矿石主要有金红石和钛铁矿。将1 mol TiCl3∙4H2O溶于水,加入足量AgNO3溶液,得到1 mol AgCl沉淀,已知Ti3+的配位数为6,TiCl3∙4H2O的化学式用配合物的形式表示为___________ 。
(1)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用,该物质的结构简式如图所示:
a.离子键、共价键 b.离子键、氢键、共价键
c.氢键、范德华力 d.离子键、氢键、范德华力
②维生素B1燃烧可生成N2、NH3、CO2、SO2、H2O、HCl等物质,这些物质中属于非极性分子的化合物有
(2)维生素C的结构简式如下,它能防治坏血病,该分子中有
a.原子轨道电子排布半充满时体系能量最低,电子排布式为[Ne]3s13p3
b.3p轨道的电子总是比3s轨道的电子在离核更远的区域运动
c.电负性比Al高,原子对键合电子的吸引力比Al大
(4)近年来美国为了遏制中国发展,对我国发起了以封锁“芯片”为核心的全方位打压,此举激发了中国科技人员自研的决心。2022年10月宁波南大光电ArF光刻胶生产线正式投产,国内7 nm芯片制造材料获得重大突破。一种聚碳酸酯胶的曝光分解原理如下:
②聚碳酸酯膜曝光后的产物加热可汽化或溶于水,加热汽化或溶于水克服的作用力有
(5)金属钛密度小、强度高、抗腐蚀性能好,是应用广泛的金属。含钛的矿石主要有金红石和钛铁矿。将1 mol TiCl3∙4H2O溶于水,加入足量AgNO3溶液,得到1 mol AgCl沉淀,已知Ti3+的配位数为6,TiCl3∙4H2O的化学式用配合物的形式表示为
您最近半年使用:0次
解题方法
4 . 科技强国,我国科学家在诸多领域取得新突破。
(1)芯片制造会经过六个最为关键的步骤:沉积、光刻胶涂覆、光刻、刻蚀、离子注入和封装。
其中“刻蚀”过程可能用到刻蚀剂 、
、 及清洗剂
及清洗剂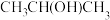 。
。
①基态F原子核外电子有_____ 种空间运动状态,下列为氟原子激发态的电子排布式的是_____ (填标号)。
A. B.
B. C.
C. D.
D.
②C、N、O、F四种元素的第一电离能由大到小的顺序为__________ 。
③氟硼酸铵( )中B的杂化方式为
)中B的杂化方式为__________ , 的空间构型为
的空间构型为__________ 。
(2)复兴号高铁车体材质用到了Mn、Co等元素。Mn的一种配合物的化学式为[Mn(CO)5(CH3CN)],CH3CN与Mn原子配位时,提供孤电子对的是__________ (填元素符号),Mn原子的配位数为__________ ,CH3CN中 键与
键与 键数目之比为
键数目之比为__________ 。
(3)超导材料 具有
具有 型结构(如图),晶胞参数(晶胞边长)为a pm,该氮化钛晶体的密度为
型结构(如图),晶胞参数(晶胞边长)为a pm,该氮化钛晶体的密度为__________ (列出计算式即可) 。
。
(1)芯片制造会经过六个最为关键的步骤:沉积、光刻胶涂覆、光刻、刻蚀、离子注入和封装。
其中“刻蚀”过程可能用到刻蚀剂
 、
、 及清洗剂
及清洗剂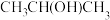 。
。①基态F原子核外电子有
A.
 B.
B. C.
C. D.
D.
②C、N、O、F四种元素的第一电离能由大到小的顺序为
③氟硼酸铵(
 )中B的杂化方式为
)中B的杂化方式为 的空间构型为
的空间构型为(2)复兴号高铁车体材质用到了Mn、Co等元素。Mn的一种配合物的化学式为[Mn(CO)5(CH3CN)],CH3CN与Mn原子配位时,提供孤电子对的是
 键与
键与 键数目之比为
键数目之比为(3)超导材料
 具有
具有 型结构(如图),晶胞参数(晶胞边长)为a pm,该氮化钛晶体的密度为
型结构(如图),晶胞参数(晶胞边长)为a pm,该氮化钛晶体的密度为 。
。
您最近半年使用:0次
5 . 黄铜矿(CuFeS2)是工业炼铜,炼铁和制硫酸的重要原料。回答下列问题:
(1)铜元素位于元素周期表___________ 区,基态Fe2+的价层电子排布图(轨道表示式)是___________ 。
(2)气态SO3以单分子形式存在,其分子的空间结构为___________ 。固体:SO3中存在如图1所示的三聚分子,该分子中S原子的杂化轨道类型为___________ 。___________ 。
②该配离子中H—O—H的键角___________ (填“大于”、“小于”或“等于”)单个水分子中H—O——H的键角。
(4)①改性Fe3O4是一种优良的磁性材料,Fe3O4晶胞的 的结构如图3所示,研究发现结构中的Fe2+只可能出现在图中某一“▲”所示位置上,请确定Fe2+在晶胞中的位置是
的结构如图3所示,研究发现结构中的Fe2+只可能出现在图中某一“▲”所示位置上,请确定Fe2+在晶胞中的位置是___________ (填“a”或“b”或“c”)。
②普鲁士蓝晶体属于立方晶系,晶胞结构如图4所示(CN⁻在图中省略),该晶体的化学式为___________ 。
(1)铜元素位于元素周期表
(2)气态SO3以单分子形式存在,其分子的空间结构为

②该配离子中H—O—H的键角
(4)①改性Fe3O4是一种优良的磁性材料,Fe3O4晶胞的
 的结构如图3所示,研究发现结构中的Fe2+只可能出现在图中某一“▲”所示位置上,请确定Fe2+在晶胞中的位置是
的结构如图3所示,研究发现结构中的Fe2+只可能出现在图中某一“▲”所示位置上,请确定Fe2+在晶胞中的位置是②普鲁士蓝晶体属于立方晶系,晶胞结构如图4所示(CN⁻在图中省略),该晶体的化学式为

您最近半年使用:0次
6 . N、P、As为第VA族元素,该族元素及其化合物在生产、生活中有广泛应用。回答下列问题:
(1)基态As原子核外有______ 个未成对电子,N、P、As电负性由大到小的顺序为______ 。
(2)已知:4AsH3 As4+6H2↑,AsH3的空间结构为
As4+6H2↑,AsH3的空间结构为______ ,已知As4为正四面体结构,则1molAs4中含______ molσ键。
(3)氨、肼(N2H4)和叠氮酸(HN3)都是氮元素的重要氢化物,肼的相对分子质量与乙烷(C2H6)接近,但沸点远高于乙烷的原因是______ 。叠氮酸的结构如图1所示,分子中②号N原子的杂化方式为_______ 。
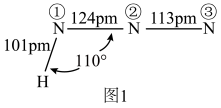
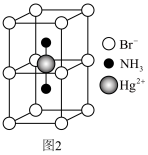
(4)某含氮化合物晶胞结构如图2所示,Br-作简单立方堆积,两个立方体共用的面中心存在一个Hg2+,相邻Br-的距离均为apm,阿伏加德罗常数的值为NA。该物质的化学式为_______ ,该晶体的密度为______ g cm3。
cm3。
(1)基态As原子核外有
(2)已知:4AsH3
 As4+6H2↑,AsH3的空间结构为
As4+6H2↑,AsH3的空间结构为(3)氨、肼(N2H4)和叠氮酸(HN3)都是氮元素的重要氢化物,肼的相对分子质量与乙烷(C2H6)接近,但沸点远高于乙烷的原因是

(4)某含氮化合物晶胞结构如图2所示,Br-作简单立方堆积,两个立方体共用的面中心存在一个Hg2+,相邻Br-的距离均为apm,阿伏加德罗常数的值为NA。该物质的化学式为
 cm3。
cm3。
您最近半年使用:0次
名校
7 . 我国在新材料领域研究的重大突破,为“天宫”空间站的建设提供了坚实的物质基础。“天宫”空间站使用的材料中含有B、C、N、Ni等元素。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是_______ (填标号,下同),用光谱仪可捕捉到发射光谱的是_______ 。
A. B.
B. 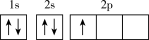
C.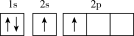 D.
D. 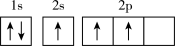
(2)镍能形成多种配合物,其中 是无色挥发性液体,
是无色挥发性液体,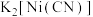 是红黄色单斜晶体。
是红黄色单斜晶体。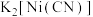 的熔点高于
的熔点高于 的原因是
的原因是_______ 。
(3)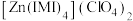 是
是 的一种配合物,IMI的结构为
的一种配合物,IMI的结构为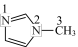 ,其中碳原子杂化方式为
,其中碳原子杂化方式为_______ ,所含元素电负性由大到小的顺序是_______ 。IMI中大π键可表示为_______ (已知苯中的大π键可表示为 ),该配合物的配位原子为
),该配合物的配位原子为_______ (填序号)。
(4)氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,质地软,可作润滑剂。立方相氮化硼与金刚石相似,是超硬材料,有优异的耐磨性。它们的晶体结构及晶胞如图所示。
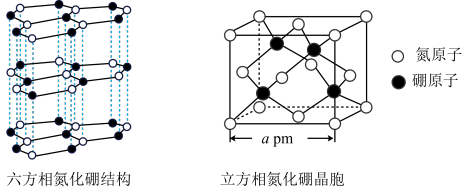
①石墨能导电,六方相氮化硼结构与石墨相似却不导电,原因是_______ 。
②立方相氮化硼晶体中“一般共价键”与配位键的数目之比为_______ 。
(5)红银矿NiAs晶体结构如图所示:
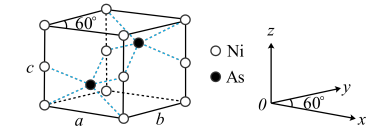
①两个As原子的原子分数坐标依次为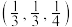 和
和_______ 。
②已知 为阿伏加德罗常数的值,X射线光谱测算出的晶胞参数为a=b=mpm、c=npm,则该晶体的密度为
为阿伏加德罗常数的值,X射线光谱测算出的晶胞参数为a=b=mpm、c=npm,则该晶体的密度为_______  (用含m、n的代数式表示)。
(用含m、n的代数式表示)。
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是
A.
 B.
B. 
C.
 D.
D. 
(2)镍能形成多种配合物,其中
 是无色挥发性液体,
是无色挥发性液体, 是红黄色单斜晶体。
是红黄色单斜晶体。 的熔点高于
的熔点高于 的原因是
的原因是(3)
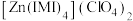 是
是 的一种配合物,IMI的结构为
的一种配合物,IMI的结构为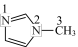 ,其中碳原子杂化方式为
,其中碳原子杂化方式为 ),该配合物的配位原子为
),该配合物的配位原子为(4)氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,质地软,可作润滑剂。立方相氮化硼与金刚石相似,是超硬材料,有优异的耐磨性。它们的晶体结构及晶胞如图所示。

①石墨能导电,六方相氮化硼结构与石墨相似却不导电,原因是
②立方相氮化硼晶体中“一般共价键”与配位键的数目之比为
(5)红银矿NiAs晶体结构如图所示:

①两个As原子的原子分数坐标依次为
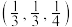 和
和②已知
 为阿伏加德罗常数的值,X射线光谱测算出的晶胞参数为a=b=mpm、c=npm,则该晶体的密度为
为阿伏加德罗常数的值,X射线光谱测算出的晶胞参数为a=b=mpm、c=npm,则该晶体的密度为 (用含m、n的代数式表示)。
(用含m、n的代数式表示)。
您最近半年使用:0次
名校
解题方法
8 . 某种镁盐具有良好的电化学性能,其阴离子结构如下图所示。W、X、Y、Z、Q是核电荷数依次增大的短周期元素,W、Y原子序数之和等于Z,Y原子价电子数是Q原子价电子数的2倍。下列说法错误的是
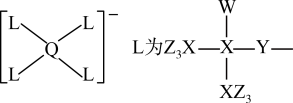
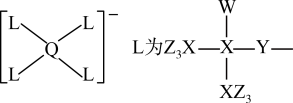
| A.W与X的化合物,其分子空间构型为正四面体 |
| B.第一电离能Z>Y>X |
| C.Q的氧化物是两性氧化物 |
| D.该阴离子中含有配位键 |
您最近半年使用:0次
名校
9 .  为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A.将2molNO与 充分反应后得到的气体分子数为 充分反应后得到的气体分子数为 |
B.40gSiC晶体中含有的共价键数为 |
C.46g乙醇中 杂化的原子数为 杂化的原子数为 |
D.1mol环戊二烯(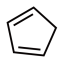 )中含有σ键的数目是 )中含有σ键的数目是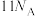 , , 键的数目为 键的数目为 |
您最近半年使用:0次
名校
10 . 过渡金属元素铬( )是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。句答下列问题:
)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。句答下列问题:
(1)对于基态 原子,下列叙述正确的是
原子,下列叙述正确的是_____ (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布简式应为
B. 电子能量较高,总是在比
电子能量较高,总是在比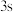 电子离核更远的地方运动
电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)三价铬离子能形成多种配位化合物。 中提供电子对形成配位键的原子是
中提供电子对形成配位键的原子是______ ,中心离子的配位数为_____ 。
(3) 中配体分子
中配体分子 以及
以及 分子的空间结构如图所示。
分子的空间结构如图所示。
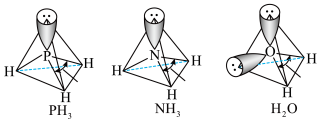
 中
中 的杂化类型是
的杂化类型是______ 。 的沸点比
的沸点比 的
的______ ,原因是________  的键角
的键角______ (填“大于”“小于”或“等于”) 的键角。
的键角。
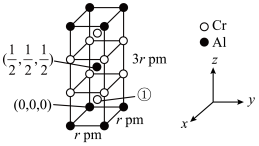
(4)铝与铬可形成如图所示的晶胞,以晶胞参数为单位长度建立的坐标系可表示晶胞中各原子的位置,称为原子分数坐标。则①铬原子的原子分数坐标为________ 。
 )是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。句答下列问题:
)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。句答下列问题:(1)对于基态
 原子,下列叙述正确的是
原子,下列叙述正确的是A.轨道处于半充满时体系总能量低,核外电子排布简式应为

B.
 电子能量较高,总是在比
电子能量较高,总是在比 电子离核更远的地方运动
电子离核更远的地方运动C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)三价铬离子能形成多种配位化合物。
 中提供电子对形成配位键的原子是
中提供电子对形成配位键的原子是(3)
 中配体分子
中配体分子 以及
以及 分子的空间结构如图所示。
分子的空间结构如图所示。
 中
中 的杂化类型是
的杂化类型是 的沸点比
的沸点比 的
的 的键角
的键角 的键角。
的键角。(4)铝与铬可形成如图所示的晶胞,以晶胞参数为单位长度建立的坐标系可表示晶胞中各原子的位置,称为原子分数坐标。则①铬原子的原子分数坐标为

您最近半年使用:0次



