名校
解题方法
1 . 氯化亚砜(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。下列关于氯化亚砜分子的空间结构和中心原子(S)采取的杂化方式的说法正确的是
| A.三角锥形、sp3 | B.平面三角形、sp3 |
| C.平面三角形、sp2 | D.三角锥形、sp2 |
您最近一年使用:0次
2022-08-28更新
|
1232次组卷
|
42卷引用:内蒙古通辽市开鲁县第一中学2021-2022学年高二下学期期中考试化学试题
内蒙古通辽市开鲁县第一中学2021-2022学年高二下学期期中考试化学试题2015-2016学年辽宁鞍山一中高二下期中化学试卷2016-2017学年河北省张家口一中高二12月月考化学卷河南省焦作市博爱一中2016-2017学年高二下学期第一次月考化学试题(已下线)【段考模拟】高二化学下学期第一次月考(3月)原创B卷【全国百强校】黑龙江省实验中学2017-2018学年高二下学期期中考试(理)化学试题【全国百强校】福建省莆田第一中学2017-2018学年高二下学期期中考试化学试题【全国百强校】福建省三明市第一中学2019届高三第二次返校考试化学试题吉林省长春汽车经济开发区第三中学2018-2019学年高二下学期4月月考化学试题辽宁省凤城市第一中学2018-2019学年高二6月月考化学试题福建省泉州市泉港区第一中学2018-2019学年高二下学期期末考试化学试题山东省济宁市2019-2020学年高二上学期期末考试化学试题江苏省徐州市第一中学2019-2020学年高二下学期第三次在线检测化学试题(已下线)《2020年新高考政策解读与配套资源》2020年山东新高考化学全真模拟卷(三)第2章 化学键与分子间作用力 易错疑难集训(二)——A学习区 夯实基础(鲁科版选修3)宁夏海原县第一中学2019-2020学年高二下学期第一次月考化学试题山东省青岛市平度市2020届高三3月高考模拟化学试卷福建省福州市福清西山学校高中部2021届高三12月月考化学试题新疆哈密市第八中学2019-2020学年高二下学期期末考试化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 章末综合检测卷(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 第2节 共价键与分子的空间结构(人教版2019)选择性必修2 第二章 分子结构与性质 第二节 分子的空间结构 课时2 杂化轨道理论(已下线)模块同步卷07 第二章综合检测-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)(已下线)2.2.1 分子空间结构的理论分析-2020-2021学年高二化学课时同步练(鲁科2019选择性必修2)(已下线)2.2 分子的空间结构(A级基础练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)辽宁省大石桥市第三高级中学2020-2021学年高二下学期期初考试化学试题陕西省榆林市第十二中学2020-2021学年高二下学期第二次月考(5月底)化学试题广西钦州市2020-2021学年高二下学期期末考试化学试题陕西省咸阳市武功县普集高级中学2021-2022学年高二上学期第一次月考化学试题(已下线)2.2.2 杂化轨道理论(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)第2.2.2讲 杂化轨道理论-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)(已下线)第二单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)北京市第七中学2021-2022学年高二下学期期中考试化学试题专题4 分子空间结构与物质性质 第一单元 分子的空间结构 第1课时 分子的空间结构模型第二节 分子的空间结构 第2课时 杂化轨道理论山东省嘉祥县第一中学2022-2023学年高二上学期期末考试化学试题湖南省长沙市雅礼中字2022-2023学年高二下学期第一次月考化学试题宁夏银川市唐徕中学2022-2023学年高二下学期期中考试化学试题4.1.1杂化轨道理论 课中安徽省合肥市第七中学2022-2023学年高二下学期期中检测化学试题四川省大英中学2022-2023学年高二下学期3月月考化学试题2.2.1分子空间结构的理论分析(课前)-鲁科版选择性必修2
名校
2 . 教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
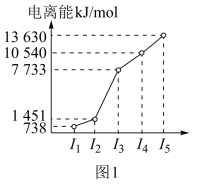
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有_______ 种不同运动状态的电子。
(2)如图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是_______ 。

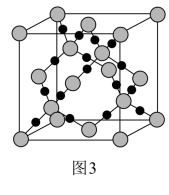
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于_______ 晶体。
(4)第一电离能介于Al、P之间的第三周期元素有_______ 种。 GaCl3原子的杂化方式为_______ 。写出与GaCl3结构相同的一种等电子体(写离子)_______ 。
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性,而干冰、碘的晶体具有相似的结构特征,干冰分子中一个分子周围有_______ 个紧邻分子。D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是_______ (填字母标号)。
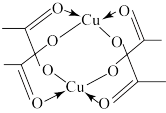
a.极性键 b.非极性键 c.配位键 d.金属键
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有

(2)如图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是

(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于

(4)第一电离能介于Al、P之间的第三周期元素有
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性,而干冰、碘的晶体具有相似的结构特征,干冰分子中一个分子周围有

a.极性键 b.非极性键 c.配位键 d.金属键
您最近一年使用:0次
名校
解题方法
3 . 某油脂厂废弃的油脂加氢反应的镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如图工艺流程回收其中的镍制备硫酸镍晶体(NiSO4:7H2O);

溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)基态Ni2+的价电子排布式为_______ 。H2O2的结构如图所示,则H2O2中的O原子的杂化方式为_______ ,转化过程中的双氧水可用O3代替,O3的空间构型是_______ ,O3是_______ 分子(填“极性“或”非极性”)。

(2)“转化”过程宜控制较低温度的原因是_______ 。
(3)利用上述表格数据,计算Ni(OH)2的Ksp_______ 。如果“转化”后的溶液中Ni2+浓度为1.0mol·L-1,则“调pH”应控制的pH范围是_______ 。
(4)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式_______ 。

溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.01mol·L-1)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
| 沉淀完全时(c=1.0×10-5mol·L-1)的pH | 8.7 | 4.7 | 3.2 | 9.0 |
回答下列问题:
(1)基态Ni2+的价电子排布式为

(2)“转化”过程宜控制较低温度的原因是
(3)利用上述表格数据,计算Ni(OH)2的Ksp
(4)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式
您最近一年使用:0次
解题方法
4 . 元素周期表中第四周期元素形成的化合物性质丰富,回答下列问题:
(1)复兴号高铁车体材质用到 、
、 等元素。
等元素。 的一种配合物化学式为
的一种配合物化学式为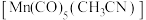 ,下列说法正确的是___________(填字母标号)。
,下列说法正确的是___________(填字母标号)。
(2)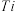 能形成化合物
能形成化合物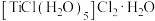 ,在该化合物中不含
,在该化合物中不含___________ (填字母标号)。
A. 键 B.
键 B. 键 C.配位键 D.离子键 E.极性键 F.非极性键
键 C.配位键 D.离子键 E.极性键 F.非极性键
(3) 中
中 的键角比
的键角比 的键角
的键角___________ (填“大”或“小”)原因是___________ 。
(4)在 催化作用下,呋喃(
催化作用下,呋喃( )可与氨反应,转化为吡咯(
)可与氨反应,转化为吡咯( )。二者熔、沸点关系为:呋喃
)。二者熔、沸点关系为:呋喃___________ 吡咯(填“高于”或“低于”),原因是___________ 。
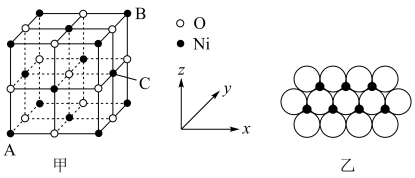
(5) 的晶胞结构如图甲所示,其中离子坐标参数A为
的晶胞结构如图甲所示,其中离子坐标参数A为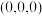 ,B为
,B为 ,则C的离子坐标参数为
,则C的离子坐标参数为___________ 。一定温度下, 晶体可以自发地分散并形成“单分子层”,可以认为
晶体可以自发地分散并形成“单分子层”,可以认为 作密置单层排列,
作密置单层排列, 填充其中(如图乙),已知
填充其中(如图乙),已知 的半径为
的半径为 ,设阿伏加德罗常数值为
,设阿伏加德罗常数值为 ,每平方米面积上具有该晶体的质量为
,每平方米面积上具有该晶体的质量为___________ g(用含a、 的代数式表示)。
的代数式表示)。
(1)复兴号高铁车体材质用到
 、
、 等元素。
等元素。 的一种配合物化学式为
的一种配合物化学式为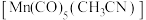 ,下列说法正确的是___________(填字母标号)。
,下列说法正确的是___________(填字母标号)。A. 与 与 原子配位时,提供孤电子对的是C原子 原子配位时,提供孤电子对的是C原子 |
B. 原子的配位数为6 原子的配位数为6 |
C. 中C原子的杂化类型为 中C原子的杂化类型为 |
D. 中 中 键与 键与 键数目之比为5∶2 键数目之比为5∶2 |
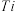 能形成化合物
能形成化合物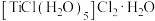 ,在该化合物中不含
,在该化合物中不含A.
 键 B.
键 B. 键 C.配位键 D.离子键 E.极性键 F.非极性键
键 C.配位键 D.离子键 E.极性键 F.非极性键(3)
 中
中 的键角比
的键角比 的键角
的键角(4)在
 催化作用下,呋喃(
催化作用下,呋喃( )可与氨反应,转化为吡咯(
)可与氨反应,转化为吡咯( )。二者熔、沸点关系为:呋喃
)。二者熔、沸点关系为:呋喃(5)
 的晶胞结构如图甲所示,其中离子坐标参数A为
的晶胞结构如图甲所示,其中离子坐标参数A为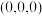 ,B为
,B为 ,则C的离子坐标参数为
,则C的离子坐标参数为 晶体可以自发地分散并形成“单分子层”,可以认为
晶体可以自发地分散并形成“单分子层”,可以认为 作密置单层排列,
作密置单层排列, 填充其中(如图乙),已知
填充其中(如图乙),已知 的半径为
的半径为 ,设阿伏加德罗常数值为
,设阿伏加德罗常数值为 ,每平方米面积上具有该晶体的质量为
,每平方米面积上具有该晶体的质量为 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
5 . 下列图示或化学用语表示不正确 的是
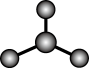 | 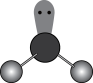 | 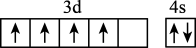 |  |
A. 的空间结构模型 的空间结构模型 | B. 的 的 模型 模型 | C.基态 的价层电子的轨道表示式 的价层电子的轨道表示式 | D.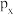 轨道的电子云轮廓图 轨道的电子云轮廓图 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-07-10更新
|
356次组卷
|
3卷引用:内蒙古赤峰市2021-2022学年高二下学期期末考试化学试题
10-11高二上·内蒙古赤峰·期中
名校
解题方法
6 . 下列关于分子或晶体中中心原子的杂化类型的说法中正确的是
| A.CH3CH3中的两个碳原子与BF3中的硼原子均为sp2杂化 |
| B.晶体硅和石英(SiO2)晶体中硅原子均为sp3杂化 |
| C.BeCl2中的铍原子和H2O中的氧原子均为sp1杂化 |
| D.CO2中的碳原子与CH2=CH2中的两个碳原子均为sp1杂化 |
您最近一年使用:0次
2022-06-29更新
|
129次组卷
|
4卷引用:2010年内蒙古赤峰市田家炳中学高二上学期期中考试化学试卷
(已下线)2010年内蒙古赤峰市田家炳中学高二上学期期中考试化学试卷山东省德州市2021-2022学年高二下学期物质结构与性质模块综合测评化学试题新疆乌鲁木齐高级中学2021-2022学年高二上学期期末考试化学试题山东省新泰市第一中学东校2022-2023学年高二下学期第一次质量检测化学试题
名校
解题方法
7 . 按要求回答下列问题。
(1)基态氮原子价层电子排布图为_______ ,电子占据最高能级的电子云轮廓图形状为_______ 。
(2)基态Ni原子的电子排布式为_______ ,该元素位于元素周期表的第_______ 族。
(3)基态Fe原子有_______ 个未成对电子,Fe位于周期表的_______ 区, 的价层电子排布式为
的价层电子排布式为_______ 。
(4)C、N、O三种元素第一电离能从小到大的顺序为_______ 。
(5)基态Ti原子核外电子排布的能量最高的能级符号是_______ 。与钛同周期的元素中,基态原子的未成对电子数与钛相同的有_______ 种。
(6)磷和砷是同一主族的元素,第一电离能:磷_______ 砷(填“>”“<”或“=”,下同),它们形成的氢化物的沸点:
_______  ,原因是
,原因是_______ 。
(7)已知第三电离能数据: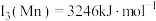 ,
,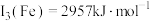 锰的第三电离能大于铁的第三电离能,其主要原因是
锰的第三电离能大于铁的第三电离能,其主要原因是_______ 。
(8)据报道,在 的催化下,甲醛可被氧化成
的催化下,甲醛可被氧化成 ,在处理含HCHO的废水或空气方面有广泛应用。HCHO中键角
,在处理含HCHO的废水或空气方面有广泛应用。HCHO中键角_______  中键角(填“大于”“小于”或“等于”)。原因是
中键角(填“大于”“小于”或“等于”)。原因是_______ 。
(1)基态氮原子价层电子排布图为
(2)基态Ni原子的电子排布式为
(3)基态Fe原子有
 的价层电子排布式为
的价层电子排布式为(4)C、N、O三种元素第一电离能从小到大的顺序为
(5)基态Ti原子核外电子排布的能量最高的能级符号是
(6)磷和砷是同一主族的元素,第一电离能:磷

 ,原因是
,原因是(7)已知第三电离能数据:
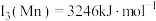 ,
,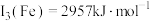 锰的第三电离能大于铁的第三电离能,其主要原因是
锰的第三电离能大于铁的第三电离能,其主要原因是(8)据报道,在
 的催化下,甲醛可被氧化成
的催化下,甲醛可被氧化成 ,在处理含HCHO的废水或空气方面有广泛应用。HCHO中键角
,在处理含HCHO的废水或空气方面有广泛应用。HCHO中键角 中键角(填“大于”“小于”或“等于”)。原因是
中键角(填“大于”“小于”或“等于”)。原因是
您最近一年使用:0次
8 . 锌是一种重要金属,原子序数为30.回答下列问题:
(1)锌元素位于元素周期表_______ 区,Zn的价层电子排布式为_______ 。
(2)Zn2+能形成多种配位化合物,在[Zn(NH3)4]2+中,提供电子对形成配位键的原子是_______ ,中心离子的配位数为_______ 。
(3)一种锌的配合物结构简式如图所示,结构中的C原子有_______ 种杂化方式,其中标注“★”的C原子为_______ 杂化。

(4)已知NH3和H2O的空间结构和相应键角如图所示,试解释H2O的键角小于NH3键角的原因:_______ 。

(5)立方闪锌矿(ZnO)的晶胞结构如图所示,若晶体密度为dg·cm-3,则距离最近的氧原子与锌原子核间距离为_______ cm(用含d和NA的代数式表示)。

(1)锌元素位于元素周期表
(2)Zn2+能形成多种配位化合物,在[Zn(NH3)4]2+中,提供电子对形成配位键的原子是
(3)一种锌的配合物结构简式如图所示,结构中的C原子有

(4)已知NH3和H2O的空间结构和相应键角如图所示,试解释H2O的键角小于NH3键角的原因:

(5)立方闪锌矿(ZnO)的晶胞结构如图所示,若晶体密度为dg·cm-3,则距离最近的氧原子与锌原子核间距离为

您最近一年使用:0次
名校
解题方法
9 . 元素周期表中第VIIA族元素包括氟(F)、氯(C1)、溴(Br)、碘(I)、砹(At),简称卤素。卤素及其化合物在生产生活中的应用非常广泛。回答下列问题:
(1)氯原子的核外电子排布式为_______ 。
(2)为了延长液氯的杀菌时间,某些自来水厂在用液氯进行消毒处理时还加入了液氨,其反应的化学方程式为NH3+HClO=H2O+NH2Cl,其中N、O、H的电负性由小到大的顺序为_______ (用元素符号表示);HClO中氧原子的杂化方式为_______ :NH3分子的VSEPR模型为_______ ;在水和苯两种溶剂中,NH2Cl更易溶于_______ 。
(3)卤素单质的化学键的键参数如表所示:
从物质结构角度分析,F—F键的键能反常的原因是_______ 。
(4)AgCl的晶胞与NaCl的类似,AgCl的晶胞结构如图所示,已知晶胞边长为 a pm,则晶胞内Ag+的配位数为_______ ,晶胞的6个面心围成的正八面体的边长为_______ pm,设阿伏加德罗常数的值为NA,则该晶体的密度为_______ (列出计算表达式)g·cm-3。

(1)氯原子的核外电子排布式为
(2)为了延长液氯的杀菌时间,某些自来水厂在用液氯进行消毒处理时还加入了液氨,其反应的化学方程式为NH3+HClO=H2O+NH2Cl,其中N、O、H的电负性由小到大的顺序为
(3)卤素单质的化学键的键参数如表所示:
| 化学键 | F-F | Cl-Cl | Br-Br | I-I |
| 键长/pm | 141 | 198 | 228 | 267 |
| 键能/(kJ·mol-1) | 157 | 242.7 | 193.7 | 152.7 |
从物质结构角度分析,F—F键的键能反常的原因是
(4)AgCl的晶胞与NaCl的类似,AgCl的晶胞结构如图所示,已知晶胞边长为 a pm,则晶胞内Ag+的配位数为

您最近一年使用:0次
2022-05-25更新
|
302次组卷
|
3卷引用:内蒙古赤峰市2022届高三下学期5月模拟考试理科综合化学试题
10 . 磷及其化合物在电池、催化等领域有重要应用。黑磷与石墨类似,也具有层状结构(如图1)。为大幅度提高锂电池的充电速率,科学家最近研发了黑磷-石墨复合负极材料,其单层结构俯视图如图2所示。

回答下列问题:
(1)Li 、C、P三种元素中,电负性最小的是_______ (用元素符号作答)。
(2)基态磷原子的电子排布式为_______ 。
(3)图2中,黑磷区P原子的杂化方式为_______ ,石墨区C原子的杂化方式为_______ 。
(4)氢化物PH3、CH4、NH3的沸点最高的是_______ ,原因是_______ 。
(5)根据图1和图2的信息,下列说法正确的有_______ (填字母)。
a.黑磷区P- P键的键能不完全相同
b.黑磷与石墨都属于混合型晶体
c.复合材料单层中,P原子与C原子之间的作用力属范德华力
(6)LiPF6、LiAsF6.等也可作为聚乙二醇锂离子电池的电极材料。电池放电时, Li+沿聚乙二醇分子中的碳氧链向正极迁移的过程如图所示(图中阴离子未画出)。

①从化学键角度看, Li+迁移过程发生_______ (填“物理”或“化学” )变化。
②相同条件下,电极材料_______ ( 填“LiPF6”或“LiAsF6”)中的Li+迁移较快,原因是_______ 。
(7)贵金属磷化物Rh2P(化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图3所示。已知晶胞参数为anm,晶体中与P距离最近的Rh的数目为_______ ,晶体的密度为_______ g·cm-3(列出计算式)。
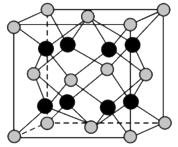
图3

回答下列问题:
(1)Li 、C、P三种元素中,电负性最小的是
(2)基态磷原子的电子排布式为
(3)图2中,黑磷区P原子的杂化方式为
(4)氢化物PH3、CH4、NH3的沸点最高的是
(5)根据图1和图2的信息,下列说法正确的有
a.黑磷区P- P键的键能不完全相同
b.黑磷与石墨都属于混合型晶体
c.复合材料单层中,P原子与C原子之间的作用力属范德华力
(6)LiPF6、LiAsF6.等也可作为聚乙二醇锂离子电池的电极材料。电池放电时, Li+沿聚乙二醇分子中的碳氧链向正极迁移的过程如图所示(图中阴离子未画出)。

①从化学键角度看, Li+迁移过程发生
②相同条件下,电极材料
(7)贵金属磷化物Rh2P(化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图3所示。已知晶胞参数为anm,晶体中与P距离最近的Rh的数目为

图3
您最近一年使用:0次



