1 . 下列各组微粒的空间构型相同的是
①NH3和H2O ②NH 和H3O+ ③NH3 和H3O+ ④O3和SO2 ⑤CO2 和C2H2 ⑥SiO
和H3O+ ③NH3 和H3O+ ④O3和SO2 ⑤CO2 和C2H2 ⑥SiO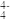 和SO
和SO
①NH3和H2O ②NH
 和H3O+ ③NH3 和H3O+ ④O3和SO2 ⑤CO2 和C2H2 ⑥SiO
和H3O+ ③NH3 和H3O+ ④O3和SO2 ⑤CO2 和C2H2 ⑥SiO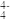 和SO
和SO
| A.全部 | B.除①④⑥以外 | C.③④⑤⑥ | D.②⑤⑥ |
您最近一年使用:0次
2022-04-30更新
|
80次组卷
|
4卷引用:内蒙古赤峰第四中学2020-2021学年高二下学期第一次月考化学试题
名校
2 . 下列分子的中心原子的杂化轨道类型相同的是
| A.CO2与SO2 | B.SO3与XeO3 |
| C.PH3与BF3 | D.C2H4 与HCHO |
您最近一年使用:0次
2022-04-28更新
|
220次组卷
|
2卷引用:内蒙古通辽市开鲁县第一中学2021-2022学年高二下学期期中考试化学试题
解题方法
3 . 在元素周期表中,铜副族(IB族)包括铜、银、金等元素,在生产、生活和科研中都有着广泛用途和重要的研究价值。
(1)Ag元素在元素周期表分区中属于_______ 区,基态Ag原子的价电子排布式为_______ 。
(2)硫代硫酸银(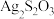 )是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠(
)是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠( )溶液生成
)溶液生成 等络阴离子。
等络阴离子。
①依据 理论推测
理论推测 的空间构型为
的空间构型为_______ ,中心原子S的杂化方式为_______ 。
②在 中配位原子是S原子而非O原子,其原因是
中配位原子是S原子而非O原子,其原因是_______ 。
(3)碘化银常用于做人工增雨剂。其中碘元素形成的最高价氧化物对应水化物有 (偏高碘酸,不稳定)和
(偏高碘酸,不稳定)和 (正高碘酸)等多种形式,它们的酸性
(正高碘酸)等多种形式,它们的酸性
_______  (填“弱于”、“等于”或“强于”)。而
(填“弱于”、“等于”或“强于”)。而 、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是
、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是_______ 。
(4)在离子晶体中,当 (阳离子)∶r(阴离子)
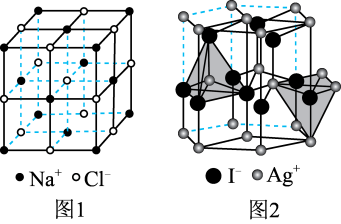
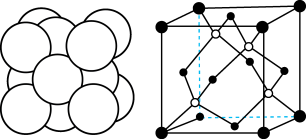
(阳离子)∶r(阴离子) 时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知
时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知 ,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为
,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为_______ ,造成AgI晶体结构不同于NaCl晶体结构的原因不可能是_______ (填标号)。
a.几何因素 b.电荷因素 c.键性因素
(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体(密度为 ),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为
),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为_______ ;若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______ (储氢能力 )
)
(1)Ag元素在元素周期表分区中属于
(2)硫代硫酸银(
 )是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠(
)是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠( )溶液生成
)溶液生成 等络阴离子。
等络阴离子。①依据
 理论推测
理论推测 的空间构型为
的空间构型为②在
 中配位原子是S原子而非O原子,其原因是
中配位原子是S原子而非O原子,其原因是(3)碘化银常用于做人工增雨剂。其中碘元素形成的最高价氧化物对应水化物有
 (偏高碘酸,不稳定)和
(偏高碘酸,不稳定)和 (正高碘酸)等多种形式,它们的酸性
(正高碘酸)等多种形式,它们的酸性
 (填“弱于”、“等于”或“强于”)。而
(填“弱于”、“等于”或“强于”)。而 、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是
、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是(4)在离子晶体中,当
 (阳离子)∶r(阴离子)
(阳离子)∶r(阴离子) 时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知
时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知 ,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为
,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为a.几何因素 b.电荷因素 c.键性因素

(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体(密度为
 ),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为
),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为 )
)
您最近一年使用:0次
2022-04-25更新
|
1244次组卷
|
4卷引用:内蒙古包头市2022届高三第二次模拟考试理综试卷化学试题
内蒙古包头市2022届高三第二次模拟考试理综试卷化学试题(已下线)押全国卷理综第35题 物质结构与性质-备战2022年高考化学临考题号押题(课标全国卷)(已下线)【直抵名校】01-备战2022年高考化学名校进阶模拟卷(通用版)河南省南阳市2021-2022学年高二下学期期末考试化学试题
名校
解题方法
4 . 分子中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co(Ⅱ)双核配合物的内界,下列说法正确的是


A.图示结构中的氯元素为 ,则其含有极性键、非极性键和离子键 ,则其含有极性键、非极性键和离子键 |
B.配合物中的 原子的杂化方式是 原子的杂化方式是 、 、 |
C.每个中心离子的配位数为4,孤对电子全部由 原子提供 原子提供 |
| D.图示结构中所有微粒共平面 |
您最近一年使用:0次
2022-04-23更新
|
139次组卷
|
5卷引用:内蒙古霍林郭勒市第一中学2021-2022学年高二下学期第一次月考化学试题
内蒙古霍林郭勒市第一中学2021-2022学年高二下学期第一次月考化学试题湖南省天壹名校联盟2021-2022学年高二下学期3月大联考化学(B)试题浙江省台州市九校联盟2021-2022学年高二下学期期中考试化学试题(已下线)【2022】【高二下】【长河】【期中考】【高中化学】【徐外兰收集】山西省怀仁市第一中学校2022-2023学年高二下学期期末考试理综化学试题
名校
解题方法
5 . 2022年北京冬奥会已经成功落下帷幕,它的成功举办离不开各种科技力量的支撑。下列说法正确的是

| A.跨临界直接制冰使用的CO2分子中含有非极性键 |
| B.滑冰场上的冰中水分子的稳定性低于甲烷 |
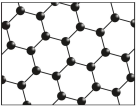
| C.颁奖礼服内胆中添加了石墨烯(结构如图),其中C原子的杂化方式是sp3杂化 |
| D.闭幕式中,鸟巢上空绽放的璀璨焰火与原子核外电子发生跃迁释放能量有关 |
您最近一年使用:0次
2022-04-23更新
|
491次组卷
|
7卷引用:内蒙古通辽市开鲁县第一中学2021-2022学年高二下学期6月检测化学试题
名校
解题方法
6 . 已知A、B、C、D、E、F、G是原子序数依次增大的前四周期元素,其中A是最轻的元素;B元素基态原子的最外层有2个未成对电子;D元素原子的价层电子排布式为 ;E元素的原子只有两种形状的电子云,最外层只有一种自旋方向的电子;F元素原子有5个未成对电子;G元素基态的正三价离子的3d轨道为半充满状态。请回答下列问题:
;E元素的原子只有两种形状的电子云,最外层只有一种自旋方向的电子;F元素原子有5个未成对电子;G元素基态的正三价离子的3d轨道为半充满状态。请回答下列问题:
(1)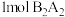 分子中有
分子中有_______  个
个 键、
键、_______  个
个 键。
键。
(2)比较熔沸点:BD_______ (填“高于”、“低于”或“等于”) 原因是
原因是_______ 。
(3)基态E原子中电子占据的最高能级的原子轨道形状为_______ ,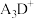 的立体构型为
的立体构型为_______ 。
(4)F是正常机体必需的微量元素之一,它构成体内若干种有重要作用的酶。F在元素周期表中的位置为_______ ,气态 再失去一个电子比气态
再失去一个电子比气态 再失去一个电子更难的原因是
再失去一个电子更难的原因是_______ 。
 ;E元素的原子只有两种形状的电子云,最外层只有一种自旋方向的电子;F元素原子有5个未成对电子;G元素基态的正三价离子的3d轨道为半充满状态。请回答下列问题:
;E元素的原子只有两种形状的电子云,最外层只有一种自旋方向的电子;F元素原子有5个未成对电子;G元素基态的正三价离子的3d轨道为半充满状态。请回答下列问题:(1)
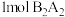 分子中有
分子中有 个
个 键、
键、 个
个 键。
键。(2)比较熔沸点:BD
 原因是
原因是(3)基态E原子中电子占据的最高能级的原子轨道形状为
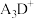 的立体构型为
的立体构型为(4)F是正常机体必需的微量元素之一,它构成体内若干种有重要作用的酶。F在元素周期表中的位置为
 再失去一个电子比气态
再失去一个电子比气态 再失去一个电子更难的原因是
再失去一个电子更难的原因是
您最近一年使用:0次
2022-04-17更新
|
88次组卷
|
2卷引用:内蒙古额尔古纳市第一中学2021-2022学年高二下学期阶段性考试化学试题
名校
解题方法
7 . 前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1∶2,D的最高化合价和最低化合价代数和等于4;基态E原子核外有6个未成对电子。
(1)基态E原子的价电子排布式为_______ ;基态D原子核外电子占据的能量最高的能级符号为_______ 。
(2)A元素的各级电离能数据如表:
分析表中数据可知,相邻两级的电离能中,I3和I4之间差异最大,其主要原因是_______ 。
(3)A、B、C元素的最高价氧化物对应的水化物酸性依次增强,其原因是_______ 。
(4)氯元素与A、B、C元素组成的共价分子ACl3、BCl4、CCl3中,中心原子采用sp3杂化、空间结构为三角锥形的是_______ (填分子式)。
(5)(DC)4为热色性固体,且有色温效应.其颜色在低于-30℃时为淡黄色,室温下为橙黄色,高于100℃时为深红色。在淡黄色→橙黄色→深红色的转化中,破坏的作用力是_______ ;在常压下,(DC)4高于130℃分解为相应的单质,这一变化中破坏的作用力是_______ 。在B、C、D的简单气态氢化物中,属于非极性分子的是_______ (填分子式)。
(6)A、C形成立方晶体,晶体结构类似于金刚石,如图所示(白色球代表A原子,黑色球代表C原子).

该晶体的化学式为_______ 。
(1)基态E原子的价电子排布式为
(2)A元素的各级电离能数据如表:
| 符号 | I1 | I2 | I3 | I4 | I5 |
电离能/( ) ) | 800.6 | 2427 | 3660 | 25026 | 32827 |
分析表中数据可知,相邻两级的电离能中,I3和I4之间差异最大,其主要原因是
(3)A、B、C元素的最高价氧化物对应的水化物酸性依次增强,其原因是
(4)氯元素与A、B、C元素组成的共价分子ACl3、BCl4、CCl3中,中心原子采用sp3杂化、空间结构为三角锥形的是
(5)(DC)4为热色性固体,且有色温效应.其颜色在低于-30℃时为淡黄色,室温下为橙黄色,高于100℃时为深红色。在淡黄色→橙黄色→深红色的转化中,破坏的作用力是
(6)A、C形成立方晶体,晶体结构类似于金刚石,如图所示(白色球代表A原子,黑色球代表C原子).

该晶体的化学式为
您最近一年使用:0次
名校
解题方法
8 . Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)根据对角线规则,Li的化学性质最相似的邻族元素是____ ,该元素基态原子核外M层电子的自旋状态____ (填“相同”或“相反”)。
(2)基态Fe2+与Fe3+离子中未成对的电子数之比为____ 。
(3)Co基态原子核外电子排布式为____ ,该元素位于周期表的____ 区。
(4)磷酸根离子的空间构型为____ ,其中P的价层电子对数为____ 、杂化轨道类型为____ 。
(1)根据对角线规则,Li的化学性质最相似的邻族元素是
(2)基态Fe2+与Fe3+离子中未成对的电子数之比为
(3)Co基态原子核外电子排布式为
(4)磷酸根离子的空间构型为
您最近一年使用:0次
名校
解题方法
9 . 以下有关杂化轨道的说法中,错误的是
| A.ⅠA族元素成键时一般不能形成杂化轨道 |
| B.杂化轨道既可形成σ键,也可能形成π键 |
| C.孤电子对有可能占据杂化轨道 |
| D.s轨道和p轨道杂化不可能有sp4杂化 |
您最近一年使用:0次
名校
解题方法
10 . 下列说法正确的是
A.  分子呈三角锥形,中心原子P采取 分子呈三角锥形,中心原子P采取 杂化 杂化 |
B. 杂化轨道是由任意的1个s轨道和3个p轨道混合形成的4个 杂化轨道是由任意的1个s轨道和3个p轨道混合形成的4个 杂化轨道 杂化轨道 |
C.凡中心原子采取 杂化的分子,其几何构型都是四面体形 杂化的分子,其几何构型都是四面体形 |
| D.AB3型分子的空间构型必为平面三角形 |
您最近一年使用:0次



