解题方法
1 . 青蒿素 是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。
是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。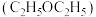 提取,效果更好。
提取,效果更好。
①乙醚沸点低于乙醇,原因是_____ 。
②用乙醚提取效果更好,原因是_____ 。
(2)确定结构
①青蒿素分子中含有_____ 个不对称碳原子。
②能确定晶体中哪些原子间存在化学键、并能确定键长和键角,从而得出分子空间结构的一种方法是_____ 。
a.质谱法 b.X射线衍射 c.核磁共振氢谱 d.红外光谱
(3)修饰结构,提高疗效:一定条件下,用 将青蒿素选择性还原生成双氢青蒿素。
将青蒿素选择性还原生成双氢青蒿素。_____ 。
②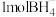 中有
中有_____  σ键,
σ键, 的空间结构为
的空间结构为_____ 。
③比较水溶性:双氢青蒿素_____ (填“ ”)青蒿素。
”)青蒿素。
 是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。
是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。
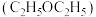 提取,效果更好。
提取,效果更好。①乙醚沸点低于乙醇,原因是
②用乙醚提取效果更好,原因是
(2)确定结构
①青蒿素分子中含有
②能确定晶体中哪些原子间存在化学键、并能确定键长和键角,从而得出分子空间结构的一种方法是
a.质谱法 b.X射线衍射 c.核磁共振氢谱 d.红外光谱
(3)修饰结构,提高疗效:一定条件下,用
 将青蒿素选择性还原生成双氢青蒿素。
将青蒿素选择性还原生成双氢青蒿素。
②
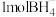 中有
中有 σ键,
σ键, 的空间结构为
的空间结构为③比较水溶性:双氢青蒿素
 ”)青蒿素。
”)青蒿素。
您最近一年使用:0次
2 . 黄铜矿(CuFeS2)是工业炼铜,炼铁和制硫酸的重要原料。回答下列问题:
(1)铜元素位于元素周期表___________ 区,基态Fe2+的价层电子排布图(轨道表示式)是___________ 。
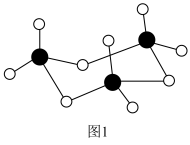
(2)气态SO3以单分子形式存在,其分子的空间结构为___________ 。固体:SO3中存在如图1所示的三聚分子,该分子中S原子的杂化轨道类型为___________ 。___________ 。
②该配离子中H—O—H的键角___________ (填“大于”、“小于”或“等于”)单个水分子中H—O——H的键角。
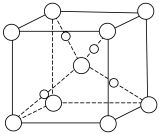
(4)①改性Fe3O4是一种优良的磁性材料,Fe3O4晶胞的 的结构如图3所示,研究发现结构中的Fe2+只可能出现在图中某一“▲”所示位置上,请确定Fe2+在晶胞中的位置是
的结构如图3所示,研究发现结构中的Fe2+只可能出现在图中某一“▲”所示位置上,请确定Fe2+在晶胞中的位置是___________ (填“a”或“b”或“c”)。
②普鲁士蓝晶体属于立方晶系,晶胞结构如图4所示(CN⁻在图中省略),该晶体的化学式为___________ 。
(1)铜元素位于元素周期表
(2)气态SO3以单分子形式存在,其分子的空间结构为

②该配离子中H—O—H的键角
(4)①改性Fe3O4是一种优良的磁性材料,Fe3O4晶胞的
 的结构如图3所示,研究发现结构中的Fe2+只可能出现在图中某一“▲”所示位置上,请确定Fe2+在晶胞中的位置是
的结构如图3所示,研究发现结构中的Fe2+只可能出现在图中某一“▲”所示位置上,请确定Fe2+在晶胞中的位置是②普鲁士蓝晶体属于立方晶系,晶胞结构如图4所示(CN⁻在图中省略),该晶体的化学式为

您最近一年使用:0次
2024-05-08更新
|
226次组卷
|
2卷引用:2024届内蒙古自治区赤峰市高三下学期三模理科综合试题-高中化学
3 . I.按构成晶体的粒子和粒子间作用力的不同,将以下晶体进行分类:
①氯化钡、②石英、③金刚砂、④水、⑤乙醇、⑥铜、⑦氯酸钾、⑧高锰酸钾、⑨稀有气体的晶体、⑩干冰
(1)属于共价晶体的有:___________ ;属于分子晶体的有:___________ ;属于离子晶体的有:___________ ;属于金属晶体的有:___________ 。
Ⅱ.比较:
(2)熔点:金刚石___________ 干冰(填“>”或“<”),原因是___________ 。
(3)键角:CH4___________ H2O(填“>”或“<”),原因是___________ 。
Ⅲ.请回答:
(4)黄铜合金采取面心立方堆积,其晶胞结构如图所示:___________ 。
②与Cu原子等距离且最近的Cu原子有___________ 个。
(5)甲醛与新制Cu(OH)2悬浊液加热可得砖红色沉淀Cu2O,已知Cu2O晶胞的结构如图所示:___________ 。
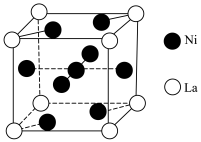
(6)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构如图。___________ 。
①氯化钡、②石英、③金刚砂、④水、⑤乙醇、⑥铜、⑦氯酸钾、⑧高锰酸钾、⑨稀有气体的晶体、⑩干冰
(1)属于共价晶体的有:
Ⅱ.比较:
(2)熔点:金刚石
(3)键角:CH4
Ⅲ.请回答:
(4)黄铜合金采取面心立方堆积,其晶胞结构如图所示:

②与Cu原子等距离且最近的Cu原子有
(5)甲醛与新制Cu(OH)2悬浊液加热可得砖红色沉淀Cu2O,已知Cu2O晶胞的结构如图所示:
(6)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构如图。
您最近一年使用:0次
解题方法
4 . MnS纳米粒子被广泛应用于除去重金属离子中的镉离子。
(1)锰的价层电子排布式为__________ 。
(2)磁性氧化铁纳米粒子除镉效率不如MnS纳米粒子,试比较两种纳米材料中的阴离子的半径大小
__________  (填>、<或=)。
(填>、<或=)。 中
中 的键角比
的键角比 中的
中的__________ (填大或小)
(3)Mn可以形成多种配合物, 中第二周期元素第一电离能由大到小关系为
中第二周期元素第一电离能由大到小关系为__________ ,配体 中心原子杂化类型为
中心原子杂化类型为__________ 配体 的空间构型为
的空间构型为__________ (用文字描述)。
(1)锰的价层电子排布式为
(2)磁性氧化铁纳米粒子除镉效率不如MnS纳米粒子,试比较两种纳米材料中的阴离子的半径大小

 (填>、<或=)。
(填>、<或=)。 中
中 的键角比
的键角比 中的
中的(3)Mn可以形成多种配合物,
 中第二周期元素第一电离能由大到小关系为
中第二周期元素第一电离能由大到小关系为 中心原子杂化类型为
中心原子杂化类型为 的空间构型为
的空间构型为
您最近一年使用:0次
5 . 2016年9月南开大学学者首次测试了一种新型锌离子电池,该电池以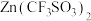 为电解质,用有阳离子型缺陷的
为电解质,用有阳离子型缺陷的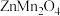 为电极,成功的获得了稳定的大功率电流。
为电极,成功的获得了稳定的大功率电流。
(1)写出基态 原子核外M能层的电子排布式
原子核外M能层的电子排布式_____ 。
(2)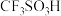 是一种有机强酸,结构式如图所示,通常用
是一种有机强酸,结构式如图所示,通常用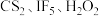 等为主要原料制取。
等为主要原料制取。
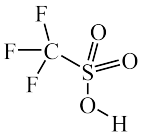
①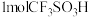 分子中含有的
分子中含有的 键的数目为
键的数目为_____ 。
② 分子中O原子的杂化方式与
分子中O原子的杂化方式与 中硫原子杂化方式
中硫原子杂化方式_____ (填“相同”或“不同”)
③ 难溶于水的原因是
难溶于水的原因是_____ 。与 互为等电子体的一种分子为
互为等电子体的一种分子为_____ 。
④ 遇水完全水解生成两种酸,写出相关化学方程式:
遇水完全水解生成两种酸,写出相关化学方程式:_____ 。
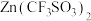 为电解质,用有阳离子型缺陷的
为电解质,用有阳离子型缺陷的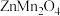 为电极,成功的获得了稳定的大功率电流。
为电极,成功的获得了稳定的大功率电流。(1)写出基态
 原子核外M能层的电子排布式
原子核外M能层的电子排布式(2)
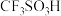 是一种有机强酸,结构式如图所示,通常用
是一种有机强酸,结构式如图所示,通常用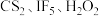 等为主要原料制取。
等为主要原料制取。
①
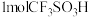 分子中含有的
分子中含有的 键的数目为
键的数目为②
 分子中O原子的杂化方式与
分子中O原子的杂化方式与 中硫原子杂化方式
中硫原子杂化方式③
 难溶于水的原因是
难溶于水的原因是 互为等电子体的一种分子为
互为等电子体的一种分子为④
 遇水完全水解生成两种酸,写出相关化学方程式:
遇水完全水解生成两种酸,写出相关化学方程式:
您最近一年使用:0次
名校
解题方法
6 . 回答下列问题。
(1)CCl4、H2S、BF3、CO2键角由大到小的顺序是___________ 。
(2)As4O6的分子结构如图所示: ,其中As原子的杂化方式为
,其中As原子的杂化方式为___________ ,O原子的杂化方式为___________ 。
(3)[Co(NO2)(NH3)5]Cl2中Co3+的配位数为___________ ,粒子中的大π键可用符号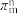 表示,中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大
表示,中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大 键可表示为
键可表示为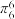 ),则配体中NO
),则配体中NO 的大π键可表示为
的大π键可表示为___________ ,空间构型为___________ 。
(4)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)回答下列问题:
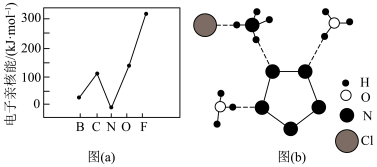
①元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1(纵坐标)变化趋势如图(a)。其中除氮元素外,其他元素的E1自左而右依次增大的原因___________ ,氮元素的E1呈现异常的原因是___________ 。
②用X射线衍射实验方法测得化合物R的晶体结构,其局部结构如图(b)所示:从结构分析,R中两种阳离子的相同之处为___________ (填标号),不同之处为___________ (填标号)。
A.中心原子的杂化类型
B.中心原子的价层电子对数
C.立体结构
(1)CCl4、H2S、BF3、CO2键角由大到小的顺序是
(2)As4O6的分子结构如图所示:
 ,其中As原子的杂化方式为
,其中As原子的杂化方式为(3)[Co(NO2)(NH3)5]Cl2中Co3+的配位数为
 表示,中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大
表示,中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大 键可表示为
键可表示为 ),则配体中NO
),则配体中NO 的大π键可表示为
的大π键可表示为(4)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)回答下列问题:

①元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1(纵坐标)变化趋势如图(a)。其中除氮元素外,其他元素的E1自左而右依次增大的原因
②用X射线衍射实验方法测得化合物R的晶体结构,其局部结构如图(b)所示:从结构分析,R中两种阳离子的相同之处为
A.中心原子的杂化类型
B.中心原子的价层电子对数
C.立体结构
您最近一年使用:0次
名校
解题方法
7 . 我国力争在2030年前实现“碳达峰”。2060年前实现“碳中和”的目标,因此二氧化碳的固定及转化成了重要的研究课题。
Ⅰ.在 催化作用下
催化作用下 和
和 反应生成甲醇:
反应生成甲醇: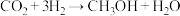 ;
;
Ⅱ.新型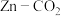 水介质电池放电时,温室气体
水介质电池放电时,温室气体 被转化为储能物质
被转化为储能物质 。
。
请回答下列问题:
(1)基态Cu原子的外围电子排布式为___________ ,基态O原子核外有___________ 种不同运动状态的电子。
(2)Ⅰ中涉及的 、
、 、
、 、
、 ,属于非极性分子的是
,属于非极性分子的是___________ (填化学式)。
(3) 分子中碳原子的杂化轨道类型为
分子中碳原子的杂化轨道类型为___________ ,分子中含有的 键和
键和 键数目之比为
键数目之比为___________ 。
(4)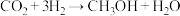 反应中,
反应中, 的立体构型为
的立体构型为___________ , 的沸点高于
的沸点高于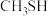 的原因是
的原因是___________ 。
(5)氧化锌(ZnO),俗称锌白,是一种常用的化学添加剂,广泛地应用于塑料、硅酸盐制品、合成橡胶等产品的制作中。一种ZnO的立方晶胞如图所示。
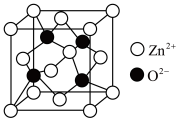
① 周围距离最近且等距的
周围距离最近且等距的 数目为
数目为___________ 。
②设晶胞边长为anm, 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为___________  。
。
Ⅰ.在
 催化作用下
催化作用下 和
和 反应生成甲醇:
反应生成甲醇: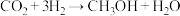 ;
;Ⅱ.新型
 水介质电池放电时,温室气体
水介质电池放电时,温室气体 被转化为储能物质
被转化为储能物质 。
。请回答下列问题:
(1)基态Cu原子的外围电子排布式为
(2)Ⅰ中涉及的
 、
、 、
、 、
、 ,属于非极性分子的是
,属于非极性分子的是(3)
 分子中碳原子的杂化轨道类型为
分子中碳原子的杂化轨道类型为 键和
键和 键数目之比为
键数目之比为(4)
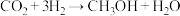 反应中,
反应中, 的立体构型为
的立体构型为 的沸点高于
的沸点高于 的原因是
的原因是(5)氧化锌(ZnO),俗称锌白,是一种常用的化学添加剂,广泛地应用于塑料、硅酸盐制品、合成橡胶等产品的制作中。一种ZnO的立方晶胞如图所示。

①
 周围距离最近且等距的
周围距离最近且等距的 数目为
数目为②设晶胞边长为anm,
 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为 。
。
您最近一年使用:0次
2023-07-30更新
|
899次组卷
|
4卷引用:内蒙古名校联盟2022-2023学年高二下学期期末考试化学试题
名校
8 . 教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
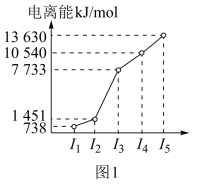
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有_______ 种不同运动状态的电子。
(2)如图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是_______ 。

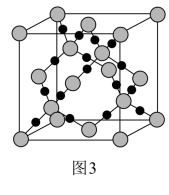
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于_______ 晶体。
(4)第一电离能介于Al、P之间的第三周期元素有_______ 种。 GaCl3原子的杂化方式为_______ 。写出与GaCl3结构相同的一种等电子体(写离子)_______ 。
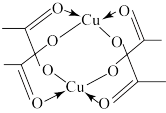
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性,而干冰、碘的晶体具有相似的结构特征,干冰分子中一个分子周围有_______ 个紧邻分子。D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是_______ (填字母标号)。
a.极性键 b.非极性键 c.配位键 d.金属键
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有

(2)如图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是

(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于

(4)第一电离能介于Al、P之间的第三周期元素有
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性,而干冰、碘的晶体具有相似的结构特征,干冰分子中一个分子周围有

a.极性键 b.非极性键 c.配位键 d.金属键
您最近一年使用:0次
名校
解题方法
9 . 回答下列问题。
(1)在H-S、H-Cl两种共价键中,键的极性较强的是_______ ,键长较长的是_______ 。在四种酸①HClO4;②H2SO4;③HNO2;④HClO中,酸性由弱到强的顺序为_______ 。(用序号表示)
(2)下列气态分子①BeCl2;②BCl3;③CCl4;④H2O中,其键角由大到小的顺序为_______ 。(用序号表示)
(3)SO2与CO2在相同条件下两者在水中的溶解度较大的是____ (写分子式),理由是_____ 。
(1)在H-S、H-Cl两种共价键中,键的极性较强的是
(2)下列气态分子①BeCl2;②BCl3;③CCl4;④H2O中,其键角由大到小的顺序为
(3)SO2与CO2在相同条件下两者在水中的溶解度较大的是
您最近一年使用:0次
名校
解题方法
10 . Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)根据对角线规则,Li的化学性质最相似的邻族元素是____ ,该元素基态原子核外M层电子的自旋状态____ (填“相同”或“相反”)。
(2)基态Fe2+与Fe3+离子中未成对的电子数之比为____ 。
(3)Co基态原子核外电子排布式为____ ,该元素位于周期表的____ 区。
(4)磷酸根离子的空间构型为____ ,其中P的价层电子对数为____ 、杂化轨道类型为____ 。
(1)根据对角线规则,Li的化学性质最相似的邻族元素是
(2)基态Fe2+与Fe3+离子中未成对的电子数之比为
(3)Co基态原子核外电子排布式为
(4)磷酸根离子的空间构型为
您最近一年使用:0次



