解题方法
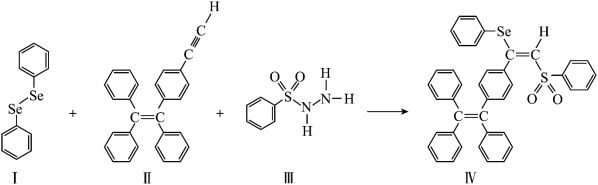
1 . AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子Ⅳ的合成路线如下:
(1)基态硫原子中,核外电子占据最高能层的符号是______ ,硫元素在周期表中位于_____ 区。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态硒原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态硒原子,其价电子自旋磁量子数的代数和为_______ 。
(3)物质Ⅰ为______ (填“极性”或“非极性”)分子。物质Ⅰ、Ⅱ、Ⅲ在水中溶解度较大的是_____ (填序号),原因是___________ 。
(4)每个物质Ⅲ分子中采取 杂化的原子有
杂化的原子有___ 个。
(1)基态硫原子中,核外电子占据最高能层的符号是
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态硒原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态硒原子,其价电子自旋磁量子数的代数和为(3)物质Ⅰ为
(4)每个物质Ⅲ分子中采取
 杂化的原子有
杂化的原子有
您最近一年使用:0次
2 . 砷化镍可用于制作发光器件、半导体激光器、太阳能电池和高速集成电路。
(1)第一电离能:As___________ (填“>”或“<”)Se.
(2)As2O3是两性氧化物,As2O3溶于盐酸生成AsCl3,AsCl3用LiAlH4还原生成AsH3。___________ (填“>”“=”或“<”)109°28′。
(3)有机砷 是治疗昏睡病的药物,它存在的化学键种类有
是治疗昏睡病的药物,它存在的化学键种类有___________ (填字母)。
a.离子键 b.σ键
c.π键 d.碳碳双键
(4)氮与砷同族,氮元素是植物生长所需的元素,常见氮肥有铵盐(NH )、尿素(
)、尿素(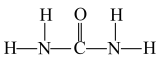 )等,NH
)等,NH 中H—N—H的键角
中H—N—H的键角___________ (填“>”“<”“=”)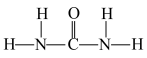 中N—C—N的键角;1 mol尿素分子含有σ键的数目为
中N—C—N的键角;1 mol尿素分子含有σ键的数目为___________ 。
(1)第一电离能:As
(2)As2O3是两性氧化物,As2O3溶于盐酸生成AsCl3,AsCl3用LiAlH4还原生成AsH3。
①AlH 的中心原子的杂化方式为
的中心原子的杂化方式为
(3)有机砷
 是治疗昏睡病的药物,它存在的化学键种类有
是治疗昏睡病的药物,它存在的化学键种类有a.离子键 b.σ键
c.π键 d.碳碳双键
(4)氮与砷同族,氮元素是植物生长所需的元素,常见氮肥有铵盐(NH
 )、尿素(
)、尿素(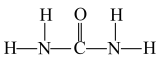 )等,NH
)等,NH 中H—N—H的键角
中H—N—H的键角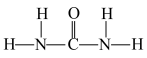 中N—C—N的键角;1 mol尿素分子含有σ键的数目为
中N—C—N的键角;1 mol尿素分子含有σ键的数目为
您最近一年使用:0次
3 . 我国科学家在月壤中发现新矿物,并命名为“嫦娥石”,其中一种物质的化学式为 。回答下列问题:
。回答下列问题: 中电负性最大的元素是
中电负性最大的元素是_______ ,该元素的原子最高能级上电子的电子云轮廓形状为_______ ,基态钙原子的核外电子排布式为_______ 。
(2)沸点: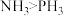 的原因是
的原因是_______ , 结构如图,则
结构如图,则 是
是_______ (填“极性”或“非极性”)分子, 中磷原子的杂化类型是
中磷原子的杂化类型是_______ ,键角:
_______ (填“>”或“<”) 。
。
(3)已知钠、镁的几组电离能(kJ∙mol−1)数据如下表所示。
第二电离能( ):
): 的原因是
的原因是_______ 。
 。回答下列问题:
。回答下列问题: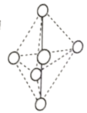
 中电负性最大的元素是
中电负性最大的元素是(2)沸点:
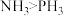 的原因是
的原因是 结构如图,则
结构如图,则 是
是 中磷原子的杂化类型是
中磷原子的杂化类型是
 。
。(3)已知钠、镁的几组电离能(kJ∙mol−1)数据如下表所示。
| 元素 |  |  |  |
| Na | 496 | 4562 | 6912 |
| Mg | 738 | 1451 | 7733 |
 ):
): 的原因是
的原因是
您最近一年使用:0次
2023-05-21更新
|
101次组卷
|
2卷引用:山西省部分学校2023-2024学年高二下学期5月质量检测化学试题
解题方法
4 . 超分子化学在识别、催化、传输等功能方面已迅速渗透到各学科领域。如图是一种由两个相同分子(a)组装形成的分子盒(b)。请回答:
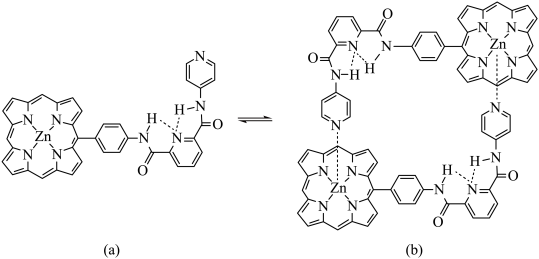
(1)两分子(a)通过______ 结合成(b)。
(2)(a)分子中C原子的杂化方式为______ ,基态Zn的价层电子轨道表示式为______ 。
(3)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态O原子,其核外电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态O原子,其核外电子自旋磁量子数的代数和为_____ 。

(1)两分子(a)通过
| A.离子键 | B.配位键 | C.氢键 | D.分子间作用力 |
(3)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+
 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态O原子,其核外电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态O原子,其核外电子自旋磁量子数的代数和为
您最近一年使用:0次
5 . 研究发现,在 低压合成甲醇反应(
低压合成甲醇反应(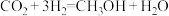 )中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)基态氧原子最高能级的原子轨道形状为___________ 。Mn与O中,电负性较大的是___________ 。
(2) 和
和 分子中C原子的杂化方式分别为
分子中C原子的杂化方式分别为___________ 和___________ 。
(3) 在水中的溶解度很大的原因是
在水中的溶解度很大的原因是___________ 。
(4)比较 和
和 沸点高低:
沸点高低:___________ ,原因是___________ 。
 低压合成甲醇反应(
低压合成甲醇反应(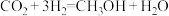 )中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:(1)基态氧原子最高能级的原子轨道形状为
(2)
 和
和 分子中C原子的杂化方式分别为
分子中C原子的杂化方式分别为(3)
 在水中的溶解度很大的原因是
在水中的溶解度很大的原因是(4)比较
 和
和 沸点高低:
沸点高低:
您最近一年使用:0次
6 . B、C、N、P、Fe、Cr是几种常见的重要元素,其形成的各种化合物在自然界中广泛存在。
(1)联氨(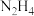 )是一种易溶于水的液体。下列因素与
)是一种易溶于水的液体。下列因素与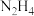 的水溶性有关系的是
的水溶性有关系的是___________ (填字母)。
a.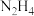 是一种液体 b.
是一种液体 b.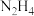 和
和 都是极性分子
都是极性分子
c.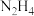 能与水发生化学反应 d.
能与水发生化学反应 d.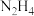 在水中易形成氢键
在水中易形成氢键
(2)金属铁粉和CO在一定温度、压力下直接反应,生成浅黄色的液体 ,呈对称三角双锥构型,熔点为-20℃,沸点为103℃。
,呈对称三角双锥构型,熔点为-20℃,沸点为103℃。 易溶于下列
易溶于下列___________ (填字母)。
a. (苯) b.水 c.
(苯) b.水 c. d.
d. 溶液
溶液
(3) 与一定量的水可形成如图所示晶体R:
与一定量的水可形成如图所示晶体R:
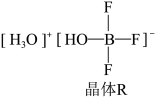
①晶体R中各种粒子间的作用力涉及___________ (填字母),
a.离子键 b.共价键 c.配位键 d.氢键 e.范德华力
②晶体R中阳离子的空间构型为___________ 。
(4)磷化铟(InP)是一种半导体材料,可用于光纤通信技术,其晶胞结构如图所示。
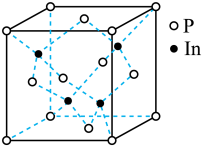
①结构化学上常用原子坐标参数表示晶胞内部各原子的相对位置,晶胞中P原子的坐标参数分别有; P(0,0,0),P( ,0,
,0, );P(0,
);P(0, ,
, )等,则距离上述三个P原子最近且等离的In原子的坐标参数为
)等,则距离上述三个P原子最近且等离的In原子的坐标参数为___________ 。
②已知晶胞参数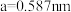 ,则InP晶体的密度为
,则InP晶体的密度为___________  (计算结果保留两位小数)。
(计算结果保留两位小数)。
(1)联氨(
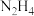 )是一种易溶于水的液体。下列因素与
)是一种易溶于水的液体。下列因素与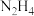 的水溶性有关系的是
的水溶性有关系的是a.
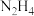 是一种液体 b.
是一种液体 b.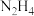 和
和 都是极性分子
都是极性分子c.
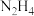 能与水发生化学反应 d.
能与水发生化学反应 d.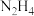 在水中易形成氢键
在水中易形成氢键(2)金属铁粉和CO在一定温度、压力下直接反应,生成浅黄色的液体
 ,呈对称三角双锥构型,熔点为-20℃,沸点为103℃。
,呈对称三角双锥构型,熔点为-20℃,沸点为103℃。 易溶于下列
易溶于下列a.
 (苯) b.水 c.
(苯) b.水 c. d.
d. 溶液
溶液(3)
 与一定量的水可形成如图所示晶体R:
与一定量的水可形成如图所示晶体R:
①晶体R中各种粒子间的作用力涉及
a.离子键 b.共价键 c.配位键 d.氢键 e.范德华力
②晶体R中阳离子的空间构型为
(4)磷化铟(InP)是一种半导体材料,可用于光纤通信技术,其晶胞结构如图所示。

①结构化学上常用原子坐标参数表示晶胞内部各原子的相对位置,晶胞中P原子的坐标参数分别有; P(0,0,0),P(
 ,0,
,0, );P(0,
);P(0, ,
, )等,则距离上述三个P原子最近且等离的In原子的坐标参数为
)等,则距离上述三个P原子最近且等离的In原子的坐标参数为②已知晶胞参数
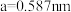 ,则InP晶体的密度为
,则InP晶体的密度为 (计算结果保留两位小数)。
(计算结果保留两位小数)。
您最近一年使用:0次
7 . C、N、O、F等元素的化合物在航天、美容、食品等多领域中有广泛的用途,请回答:
(1)OF2主要用于火箭工程液体助燃剂,该分子的空间结构为______ ;N、O、F的第一电离能由大到小的顺序为_____ (用元素符号表示)。
(2)XeF2是一种选择性很好的氟化试剂,但在室温下易升华,推测XeF2为______ 晶体(填晶体类型)。
(3)FeSO4是一种重要的食品和饲料添加剂:
①Fe在周期表中位于第______ 周期第______ 族。
②FeSO4·7H2O的结构示意图如图所示,H2O与Fe2+、SO 的作用类型分别是
的作用类型分别是______ 、______ 。
A.离子键 B.配位键 C.氢键 D.金属键 中键角的大小并解释原因:
中键角的大小并解释原因:______ 。
(1)OF2主要用于火箭工程液体助燃剂,该分子的空间结构为
(2)XeF2是一种选择性很好的氟化试剂,但在室温下易升华,推测XeF2为
(3)FeSO4是一种重要的食品和饲料添加剂:
①Fe在周期表中位于第
②FeSO4·7H2O的结构示意图如图所示,H2O与Fe2+、SO
 的作用类型分别是
的作用类型分别是A.离子键 B.配位键 C.氢键 D.金属键
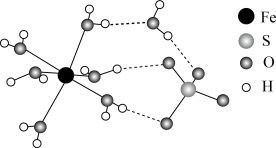
 中键角的大小并解释原因:
中键角的大小并解释原因:
您最近一年使用:0次
2023-04-20更新
|
197次组卷
|
3卷引用:山西省大同市2022-2023学年高二下学期期中考试化学试题
8 . 按要求回答下列问题
(1) 中心原子采用
中心原子采用____ 杂化,其键角比 中键角
中键角______ (填“大”或“小”),原因是:________________________ 。
(2)有如下分子:① ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥ ⑦HCl⑧
⑦HCl⑧ ⑨
⑨ ⑩
⑩
①上述分子中每个原子周围都满足8电子结构的是______ (填序号)。
② 分子中σ键和π键个数之比为
分子中σ键和π键个数之比为____________ 。
③含有极性键的极性分子有______ (填序号)。
④空间结构为三角锥形的分子是______ (填序号)。
(3)某有机物结构如图所示,下列说法正确的是______ (填序号)。

①分子中σ键和π键之比为9∶3 ②该物质中既有极性键也有非极性键
③分子中C原子的杂化方式为 杂化 ④该分子是非极性分子
杂化 ④该分子是非极性分子
(1)
 中心原子采用
中心原子采用 中键角
中键角(2)有如下分子:①
 ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥ ⑦HCl⑧
⑦HCl⑧ ⑨
⑨ ⑩
⑩
①上述分子中每个原子周围都满足8电子结构的是
②
 分子中σ键和π键个数之比为
分子中σ键和π键个数之比为③含有极性键的极性分子有
④空间结构为三角锥形的分子是
(3)某有机物结构如图所示,下列说法正确的是

①分子中σ键和π键之比为9∶3 ②该物质中既有极性键也有非极性键
③分子中C原子的杂化方式为
 杂化 ④该分子是非极性分子
杂化 ④该分子是非极性分子
您最近一年使用:0次
解题方法
9 . 回答下列问题
(1)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间结构是_______ 、中心原子的杂化类型为_______ 。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_______ 。气态三氧化硫以单分子形式存在,其分子的空间结构为_______ 形;固体三氧化硫中存在如图所示的三聚分子,该分子中S原子的杂化轨道类型为_______ 。
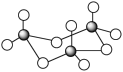
(3)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间结构为_______ ,C原子的杂化方式为_______ 。
(4)化合物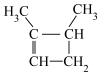
_______ (填“是”或“不是”)手性分子,碳原子的杂化类型有_______ 。
(1)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间结构是
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是

(3)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间结构为
(4)化合物

您最近一年使用:0次
名校
10 . 硝基胍是固体火箭推进剂的重要组分,其结构简式如图所示(“→”是一种特殊的共价单键)。
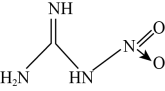
回答下列问题:
(1)硝基胍分子中C、H、O、N四种元素的电负性由小到大的顺序为_______ ,这四种元素_______ (填“能”或“不能”)形成离子化合物。
(2)硝基胍中N原子的杂化方式分别为_______ ,C-H键的极性_______ (填“强”或“弱”)于N-H键的极性。
(3)从结构上分析该物质_______ (填“易”或“不”)溶于水,原因是_______ 。
(4)下图中表示的碳原子能量最高的是_______(填字母)。
(5)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为_______ 。
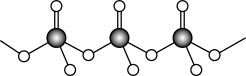

回答下列问题:
(1)硝基胍分子中C、H、O、N四种元素的电负性由小到大的顺序为
(2)硝基胍中N原子的杂化方式分别为
(3)从结构上分析该物质
(4)下图中表示的碳原子能量最高的是_______(填字母)。
A.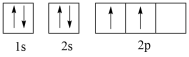 | B.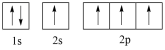 |
C.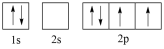 | D.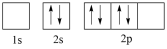 |

您最近一年使用:0次
2023-03-16更新
|
418次组卷
|
2卷引用:山西省介休市第一中学校2022-2023学年高二下学期3月月考化学试题



