解题方法
1 . 铁的多种化合物均为磁性材料,氮化铁(FexNy)是其中一种,某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe基态核外电子排布式___________ 。
(2)丙酮(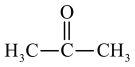 )分子中碳原子轨道的杂化类型是
)分子中碳原子轨道的杂化类型是___________ 。
(3) 与
与 同周期,
同周期, 三种元素的电负性从小到大的顺序为
三种元素的电负性从小到大的顺序为___________ ; 、
、 、
、 的第一电离能从大到小的顺序为
的第一电离能从大到小的顺序为___________ 。
(4)乙醇的沸点(78.3℃)高于丙酮的沸点(56.5℃),原因是___________ 。
(5)基态Cu原子在周期表中的位置___________ 。
(1)Fe基态核外电子排布式
(2)丙酮(
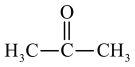 )分子中碳原子轨道的杂化类型是
)分子中碳原子轨道的杂化类型是(3)
 与
与 同周期,
同周期, 三种元素的电负性从小到大的顺序为
三种元素的电负性从小到大的顺序为 、
、 、
、 的第一电离能从大到小的顺序为
的第一电离能从大到小的顺序为(4)乙醇的沸点(78.3℃)高于丙酮的沸点(56.5℃),原因是
(5)基态Cu原子在周期表中的位置
您最近一年使用:0次
名校
解题方法
2 .  可用于印染、畜等领域。
可用于印染、畜等领域。
(1)基态 中含
中含____ 个未成对电子数,基态 价层电子排布式为
价层电子排布式为___ ,两种离子中更稳定的为____ 。
(2) 中
中 的VSEPR模型为
的VSEPR模型为___ , 分子的空间结构是
分子的空间结构是___ ,请用共价键知识解释 分子比
分子比 分子稳定的原因为
分子稳定的原因为____ 。
(3)将纯液态 冷却到
冷却到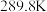 时,能凝固得到一种螺旋状单链结构的固体,其结构如图所示,此固态
时,能凝固得到一种螺旋状单链结构的固体,其结构如图所示,此固态 中S原子的杂化轨道类型与
中S原子的杂化轨道类型与 中O的杂化轨道类型
中O的杂化轨道类型____ (填“相同”或“不同”)。____ 。
A.分子的极性:
B.干冰晶体中,每个 分子周围距离相近且相等
分子周围距离相近且相等 分子共有12个
分子共有12个
C.物质的沸点:
 可用于印染、畜等领域。
可用于印染、畜等领域。(1)基态
 中含
中含 价层电子排布式为
价层电子排布式为(2)
 中
中 的VSEPR模型为
的VSEPR模型为 分子的空间结构是
分子的空间结构是 分子比
分子比 分子稳定的原因为
分子稳定的原因为(3)将纯液态
 冷却到
冷却到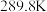 时,能凝固得到一种螺旋状单链结构的固体,其结构如图所示,此固态
时,能凝固得到一种螺旋状单链结构的固体,其结构如图所示,此固态 中S原子的杂化轨道类型与
中S原子的杂化轨道类型与 中O的杂化轨道类型
中O的杂化轨道类型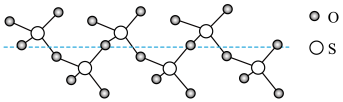
A.分子的极性:

B.干冰晶体中,每个
 分子周围距离相近且相等
分子周围距离相近且相等 分子共有12个
分子共有12个C.物质的沸点:

您最近一年使用:0次
名校
3 .  、
、 、
、 、
、 是重要的VA族化合物。回答下列问题:
是重要的VA族化合物。回答下列问题:
(1)固体 属于
属于_______ 晶体, 的VSEPR模型是
的VSEPR模型是_______ 。
(2)乙二胺( )易溶于水,可用于制造燃料、药物等。
)易溶于水,可用于制造燃料、药物等。
①C、N、O元素的第一电离能由大到小的顺序为_______ 。
②乙二胺易溶于水的原因是_______ ,其分子中采取 杂化的原子是
杂化的原子是_______ (填元素符号)。
(3) 分子中含有
分子中含有 键的数目为
键的数目为_______ ,其晶体中含有的化学键为_______ (填标号)。
a.氢键 b.离子键 c.极性键 d.范德华力
 、
、 、
、 、
、 是重要的VA族化合物。回答下列问题:
是重要的VA族化合物。回答下列问题:(1)固体
 属于
属于 的VSEPR模型是
的VSEPR模型是(2)乙二胺(
 )易溶于水,可用于制造燃料、药物等。
)易溶于水,可用于制造燃料、药物等。①C、N、O元素的第一电离能由大到小的顺序为
②乙二胺易溶于水的原因是
 杂化的原子是
杂化的原子是(3)
 分子中含有
分子中含有 键的数目为
键的数目为a.氢键 b.离子键 c.极性键 d.范德华力
您最近一年使用:0次
名校
4 .  、
、 、
、 是重要的ⅤA族化合物。回答下列问题:
是重要的ⅤA族化合物。回答下列问题:
(1)固体 属于
属于___________ 晶体, 的VSEPR模型是
的VSEPR模型是___________ 。
(2)乙二胺( )易溶于水,可用于制造燃料、药物等。
)易溶于水,可用于制造燃料、药物等。
①C、N、O元素的电负性由大到小的顺序为___________ 。
②乙二胺易溶于水的原因是___________ ,其分子中采取 杂化的原子是
杂化的原子是___________ (填元素符号)。
(3)每个 分子中含有
分子中含有 键的数目为
键的数目为___________ ,其晶体中含有的化学键为___________ (填标号)。
a.氢键 b.离子键 c.极性键 d.范德华力
 、
、 、
、 是重要的ⅤA族化合物。回答下列问题:
是重要的ⅤA族化合物。回答下列问题:(1)固体
 属于
属于 的VSEPR模型是
的VSEPR模型是(2)乙二胺(
 )易溶于水,可用于制造燃料、药物等。
)易溶于水,可用于制造燃料、药物等。①C、N、O元素的电负性由大到小的顺序为
②乙二胺易溶于水的原因是
 杂化的原子是
杂化的原子是(3)每个
 分子中含有
分子中含有 键的数目为
键的数目为a.氢键 b.离子键 c.极性键 d.范德华力
您最近一年使用:0次
名校
5 . 硼的化合物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态硼原子的电子排布式为:___________ 。
(2) 和过量NaF作用可生成
和过量NaF作用可生成 ,
, 的空间结构为
的空间结构为___________ ; 的电子式为
的电子式为___________ 。
(3)正硼酸( )是一种片层状结构的白色晶体,层内的
)是一种片层状结构的白色晶体,层内的 分子通过氢键相连(如图)。下列有关说法正确的有___________。
分子通过氢键相连(如图)。下列有关说法正确的有___________。
(4)已知硼酸为一元弱酸,写出硼酸的电离方程式___________ 。
(5)硼砂是含结晶水的四硼酸钠。硼砂中阴离子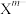 (含B、O、H三种元素)的球棍模型如图所示,则在
(含B、O、H三种元素)的球棍模型如图所示,则在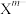 中,2号硼原子的杂化类型为
中,2号硼原子的杂化类型为___________ ;4号硼原子参与形成的化学键有___________ (填选项)。
m=___________ (填数字)。
(1)基态硼原子的电子排布式为:
(2)
 和过量NaF作用可生成
和过量NaF作用可生成 ,
, 的空间结构为
的空间结构为 的电子式为
的电子式为(3)正硼酸(
 )是一种片层状结构的白色晶体,层内的
)是一种片层状结构的白色晶体,层内的 分子通过氢键相连(如图)。下列有关说法正确的有___________。
分子通过氢键相连(如图)。下列有关说法正确的有___________。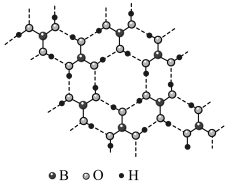
| A.正硼酸晶体属于共价晶体 | B.分子中硼原子最外层为8电子稳定结构 |
C. 分子的稳定性与氢键有关 分子的稳定性与氢键有关 | D.1mol  晶体中平均含3mol氢键 晶体中平均含3mol氢键 |
(4)已知硼酸为一元弱酸,写出硼酸的电离方程式
(5)硼砂是含结晶水的四硼酸钠。硼砂中阴离子
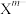 (含B、O、H三种元素)的球棍模型如图所示,则在
(含B、O、H三种元素)的球棍模型如图所示,则在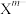 中,2号硼原子的杂化类型为
中,2号硼原子的杂化类型为 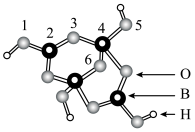
m=
您最近一年使用:0次
名校
6 . 硅材料在生活中占有重要地位。请回答:
(1)Si原子结构示意图为__________ , 受热分解生成
受热分解生成 和
和 ,
, 空间结构名称为
空间结构名称为__________ 。
(2)在硅酸盐中, 四面体(如下图(a))中Si原子的杂化形式为
四面体(如下图(a))中Si原子的杂化形式为__________ 。 通过共用顶角氧离子可形成链状结构型式。图(b)为一种无限长双链结构多硅酸根,Si与O的原子数之比为
通过共用顶角氧离子可形成链状结构型式。图(b)为一种无限长双链结构多硅酸根,Si与O的原子数之比为__________ 。
(1)Si原子结构示意图为
 受热分解生成
受热分解生成 和
和 ,
, 空间结构名称为
空间结构名称为(2)在硅酸盐中,
 四面体(如下图(a))中Si原子的杂化形式为
四面体(如下图(a))中Si原子的杂化形式为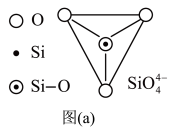
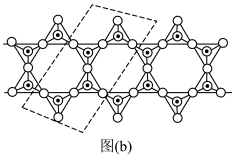
 通过共用顶角氧离子可形成链状结构型式。图(b)为一种无限长双链结构多硅酸根,Si与O的原子数之比为
通过共用顶角氧离子可形成链状结构型式。图(b)为一种无限长双链结构多硅酸根,Si与O的原子数之比为
您最近一年使用:0次
名校
解题方法
7 . 物质的结构影响物质的性质。请回答下列问题。
(1)P4S3可用于制造火柴,其分子结构如图所示。电负性:硫___________ 磷(填“>”“<”或“=”),P4S3分子中硫原子的杂化轨道类型为___________ 。1molP4S3分子中孤电子对的数目为___________ ,∠S—P—S___________ 109°28'(填“>”“<”或“=”)。

(2)化合物Cl2O的空间结构为___________ ,中心原子的价层电子对数为___________ 。
(3) 、
、 分子的空间结构和相应的键角如图甲所示。
分子的空间结构和相应的键角如图甲所示。___________ ,原因是___________ 。H2O的键角小于NH3的,分析原因:___________ 。
(4)氨气溶于水时,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子。根据氨水的性质可推知NH3·H2O的结构式为___________ 。(填序号)
(1)P4S3可用于制造火柴,其分子结构如图所示。电负性:硫

(2)化合物Cl2O的空间结构为
(3)
 、
、 分子的空间结构和相应的键角如图甲所示。
分子的空间结构和相应的键角如图甲所示。
(4)氨气溶于水时,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子。根据氨水的性质可推知NH3·H2O的结构式为
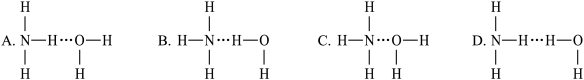
您最近一年使用:0次
2024-04-29更新
|
157次组卷
|
2卷引用:黑龙江省哈尔滨市第三十二中学校2023-2024学年高二下学期4月期中考试化学试题
名校
解题方法
8 . 原子是肉眼和一般仪器都看不到的微粒,科学家们是根据可观察、可测量的宏观实验事实,经过分析和推理,揭示了原子结构的奥秘。
(1)下列说法中正确的个数是___________。
①同一原子中,s电子的能量总是低于p电子的能量
②任何s轨道形状均是球形,只是能层不同,球的半径大小不同而己
③2p、3p、4p能级的轨道数依次增多
④原子核外电子排布,先排满K层再排L层,排满M层再排N层
(2)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为___________ 、___________ 。___________ 光谱(选填“发射”或“吸收”)。
(4)镍铬钢抗腐蚀性能强,基态铬原子的价层电子排布式为___________ 。
(5)已知维生素C的一种同分异构体结构简式如图,则该分子中碳原子的轨道杂化类型为___________ ;分子中有___________ 个σ键和___________ 个π键。
(1)下列说法中正确的个数是___________。
①同一原子中,s电子的能量总是低于p电子的能量
②任何s轨道形状均是球形,只是能层不同,球的半径大小不同而己
③2p、3p、4p能级的轨道数依次增多
④原子核外电子排布,先排满K层再排L层,排满M层再排N层
⑤基态碳原子的轨道表示式: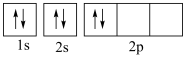
⑦用电子式表示 的形成过程:
的形成过程: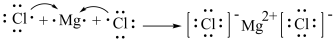
⑧基态钒原子的结构示意图为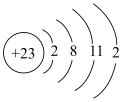
| A.2 | B.3 | C.4 | D.5 |
(2)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为
A.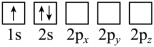 B.
B.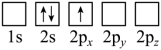
C. 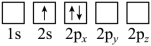 D.
D.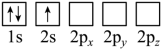
(4)镍铬钢抗腐蚀性能强,基态铬原子的价层电子排布式为
(5)已知维生素C的一种同分异构体结构简式如图,则该分子中碳原子的轨道杂化类型为
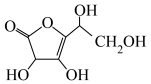
您最近一年使用:0次
解题方法
9 . 回答下列问题。
(1)基态N原子的电子排布式为___________ 。基态P原子中,电子占据的最高能级原子轨道形状为___________ 。
(2)H2O中心原子杂化轨道类型为___________ ,说明H2O沸点大于H2S的原因___________ 。
(3)基态Ca原子价层电子由4s2状态变化为4s14p1状态所得原子光谱为___________ (填“发射”或“吸收”)光谱。
(4)下列氧原子电子排布图表示的状态中,能量最高的是___________ (填标号,下同),能量最低的是___________ 。
(1)基态N原子的电子排布式为
(2)H2O中心原子杂化轨道类型为
(3)基态Ca原子价层电子由4s2状态变化为4s14p1状态所得原子光谱为
(4)下列氧原子电子排布图表示的状态中,能量最高的是
A.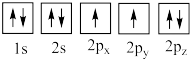 B.
B.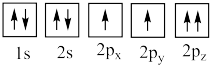
C. D.
D.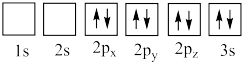
您最近一年使用:0次
2024-02-25更新
|
508次组卷
|
3卷引用:黑龙江省佳木斯市立人高级中学2023-2024学年高二下学期 期末考试
10 . 完成表中内容。
| σ数 | 孤电子对数 | 杂化方式 | VSEPR模型 | 分子空间构型 | |
| CO2 | |||||
| H2O |
您最近一年使用:0次
2024-02-24更新
|
297次组卷
|
3卷引用:黑龙江省佳木斯市三校联考2023-2024学年高二下学期4月期中考试化学试题



