解题方法
1 . 在H2O、NH3、CS2、CH4、BF3分子中:
(1)存在π键的共价化合物分子是_______ (填分子式,下同)。
(2)具有直线形结构的分子是_______ 。
(3)具有正四面体形结构的分子是_______ 。
(4)具有三角锥形结构的分子是_______ 。
(5)具有sp2杂化轨道类型的分子是_______ 。
(6)Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为_______ 。OF2分子的空间构型为_______ 。
(1)存在π键的共价化合物分子是
(2)具有直线形结构的分子是
(3)具有正四面体形结构的分子是
(4)具有三角锥形结构的分子是
(5)具有sp2杂化轨道类型的分子是
(6)Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为
您最近一年使用:0次
解题方法
2 . 回答下列问题
(1)基态Se原子的核外电子排布式为[Ar]_______ 。
(2)基态S原子的价电子中,两种自旋状态的电子数之比为_______ 。
(3)基态O原子的电子排布式_______ ,其中未成对电子有_______ 个。
(4)基态F原子的价电子排布图(轨道表示式)为_______ 。
(5)研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒。
)可减轻重金属铊引起的中毒。 的立体构型为
的立体构型为_______ 。
(6)比较 和H2O分子中的键角大小并给出相应解释:
和H2O分子中的键角大小并给出相应解释:_______ 。
(1)基态Se原子的核外电子排布式为[Ar]
(2)基态S原子的价电子中,两种自旋状态的电子数之比为
(3)基态O原子的电子排布式
(4)基态F原子的价电子排布图(轨道表示式)为
(5)研究发现,给小鼠喂食适量硒酸钠(
 )可减轻重金属铊引起的中毒。
)可减轻重金属铊引起的中毒。 的立体构型为
的立体构型为(6)比较
 和H2O分子中的键角大小并给出相应解释:
和H2O分子中的键角大小并给出相应解释:
您最近一年使用:0次
解题方法
3 . 回答下列问题。
(1) 中的化学键属于
中的化学键属于___________ (填“σ”或“π”)键。
(2) 分子中,中心原子上的σ键电子对数为
分子中,中心原子上的σ键电子对数为___________ ,孤电子对数为___________ ,价层电子对数为___________ ,中心原子的杂化方式为___________ ,VSEPR模型为___________ ,分子的空间结构为___________ 。
(3)下列分子中若有手性分子,请用“*”标出其手性碳原子;若无手性分子,此小题不必作答。
(1)
 中的化学键属于
中的化学键属于(2)
 分子中,中心原子上的σ键电子对数为
分子中,中心原子上的σ键电子对数为(3)下列分子中若有手性分子,请用“*”标出其手性碳原子;若无手性分子,此小题不必作答。

您最近一年使用:0次
名校
解题方法
4 . 如图表示不同类型共价键形成时电子云重叠情况:
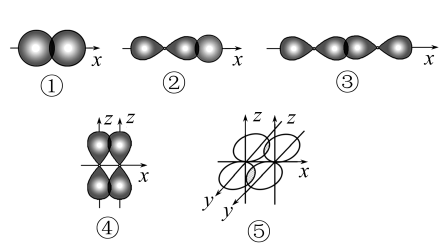
(1)其中形成的化学键属于镜面对称的有______ 。
(2)下列物质中,通过方式①化学键形成的是______ (填选项,下同);通过方式②化学键形成的是______ ;只通过方式③化学键形成的是_______ ;同时含有③、④、⑤三种方式化学键的物质是______ 。
A.Cl2 B.HCl C.N2 D.H2
(3)甲、乙、丙三种有机物的结构如图:
甲: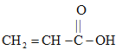 乙:CH2=CH2丙:CH2=CHCN
乙:CH2=CH2丙:CH2=CHCN
①甲分子中有______ 个σ键,______ 个π键。
②乙分子中______ (填“有”或“没有”)极性键,是______ 。(填“极性分子“”或“非极性分子”)
③丙分子中σ键与π键的数目之比为______ 。

(1)其中形成的化学键属于镜面对称的有
(2)下列物质中,通过方式①化学键形成的是
A.Cl2 B.HCl C.N2 D.H2
(3)甲、乙、丙三种有机物的结构如图:
甲:
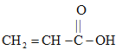 乙:CH2=CH2丙:CH2=CHCN
乙:CH2=CH2丙:CH2=CHCN①甲分子中有
②乙分子中
③丙分子中σ键与π键的数目之比为
您最近一年使用:0次
名校
5 . 回答下列问题:
(1)下列分子中若有手性原子,请用“*”标出其手性碳原子_____________ 。
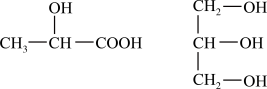
(2)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4_______ H2SO3;HClO3_______ HClO4;
(3)根据价层电子对互斥理论判断下列问题:H2S分子的VSEPR构型为____________ ,立体构型为_________________ 。
(4)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于___________________ ;H2O比H2S更稳定,这是由于________________________ 。
(1)下列分子中若有手性原子,请用“*”标出其手性碳原子
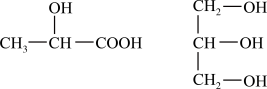
(2)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4
(3)根据价层电子对互斥理论判断下列问题:H2S分子的VSEPR构型为
(4)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于
您最近一年使用:0次
2023-04-20更新
|
209次组卷
|
2卷引用:贵州省铜仁市松桃民族中学2022-2023学年高二下学期第一次月考化学试题
解题方法
6 . 在HF、H2O、NH3、CS2、CH4、H2O2、N2分子中:
(1)以非极性键结合的非极性分子是___________ (填化学式,下同)。
(2)以极性键结合,具有直线形结构的非极性分子是___________ 。
(3)以极性键结合,具有正四面体结构的非极性分子是___________ 。
(4)以极性键结合,具有三角锥形结构的极性分子是___________ 。
(5)含有非极性键的极性分子是___________ 。
(1)以非极性键结合的非极性分子是
(2)以极性键结合,具有直线形结构的非极性分子是
(3)以极性键结合,具有正四面体结构的非极性分子是
(4)以极性键结合,具有三角锥形结构的极性分子是
(5)含有非极性键的极性分子是
您最近一年使用:0次
2023-03-27更新
|
183次组卷
|
3卷引用:贵州省贵阳清镇北大培文学校2022-2023学年高二下学期3月月考化学试题
解题方法
7 . [Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2-+4H++4H2O=[Zn(H2O)4]2++4HOCH2CN。
(1)Zn2+基态核外电子排布式为___________ 。画出配合物离子[Zn(H2O)4]2+中的配位键___________
(2)1molHCHO分子中含有σ键的数目为___________ 。
(3)HOCH2CN的结构简式 ,HOCH2CN分子中碳原子轨道的杂化类型分别是
,HOCH2CN分子中碳原子轨道的杂化类型分别是___________ 和___________ 。
(4)与H2O分子互为等电子体的阴离子为___________ 。
(5)下列一组微粒中键角由大到小顺序排列为___________ (用编号填写)
①CO2 ②SiF4 ③SCl2 ④CO ⑤H3O+
⑤H3O+
(6)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
①H、B、N中,原子半径最大的是___________ 。根据对角线规则,B的一些化学性质与元素___________ 的相似。
②NH3BH3分子中,N-B化学键称为___________ 键,其电子对由___________ 提供。氨硼烷在催化剂作用下水解释放氢气:3NH3BH3+6H2O=3NH3+ +9H2,
+9H2, 的结构如图所示:
的结构如图所示: ;在该反应中,B原子的杂化轨道类型由
;在该反应中,B原子的杂化轨道类型由___________ 变为___________ 。
(1)Zn2+基态核外电子排布式为
(2)1molHCHO分子中含有σ键的数目为
(3)HOCH2CN的结构简式
 ,HOCH2CN分子中碳原子轨道的杂化类型分别是
,HOCH2CN分子中碳原子轨道的杂化类型分别是(4)与H2O分子互为等电子体的阴离子为
(5)下列一组微粒中键角由大到小顺序排列为
①CO2 ②SiF4 ③SCl2 ④CO
 ⑤H3O+
⑤H3O+(6)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
①H、B、N中,原子半径最大的是
②NH3BH3分子中,N-B化学键称为
 +9H2,
+9H2, 的结构如图所示:
的结构如图所示: ;在该反应中,B原子的杂化轨道类型由
;在该反应中,B原子的杂化轨道类型由
您最近一年使用:0次
解题方法
8 . 钛及其化合物在人们的生活中起着十分重要的作用。尤其是二氧化钛、四氯化钛、钛酸钡等应用极广,回答下列问题:
(1)基态钛原子的价电子排布式为___________ ,该基态原子中含___________ 对电子对。
(2)二氧化钛是世界上最白的东西,1g二氧化钛可以把450多平方厘米的面积涂得雪白,是调制白油漆的最好颜料。基态Ti4+中的核外电子占据的原子轨道数为___________ 。
(3)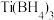 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得。
反应制得。
①LiBH4由 和
和 构成,
构成, 的空间构型是
的空间构型是___________ ,B原子的杂化轨道类型是___________ ,写出一种与该阴离子互为等电子体的微粒是___________ 。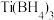 中各元素的电负性大小顺序为
中各元素的电负性大小顺序为___________ 。
②某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如表所示。M是___________ (填元素符号),判断理由为___________ 。
(1)基态钛原子的价电子排布式为
(2)二氧化钛是世界上最白的东西,1g二氧化钛可以把450多平方厘米的面积涂得雪白,是调制白油漆的最好颜料。基态Ti4+中的核外电子占据的原子轨道数为
(3)
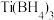 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得。
反应制得。①LiBH4由
 和
和 构成,
构成, 的空间构型是
的空间构型是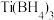 中各元素的电负性大小顺序为
中各元素的电负性大小顺序为②某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如表所示。M是
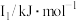 | 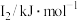 | 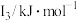 | 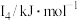 | 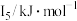 |
| 738 | 1451 | 7733 | 10540 | 13630 |
您最近一年使用:0次
名校
解题方法
9 . 世界上最早发现并使用锌的是中国,明朝末年《天工开物》一书中有世界上最早的关于炼锌技术的记载。回答下列问题:
(1)基态Zn原子的核外电子所占据的最高能层符号为___ 。
(2)硫酸锌溶于过量的氨水可形成[Zn(NH3)4]SO4溶液。
①[Zn(NH3)4]SO4中阴离子的空间构型为_______ 。
② 中,中心原子的轨道杂化类型为
中,中心原子的轨道杂化类型为________ 。
③写出一种与 互为等电子体的分子的化学式:
互为等电子体的分子的化学式:________ 。
④NH3极易溶于水,除因为它们都是极性分子外,还因为________
(1)基态Zn原子的核外电子所占据的最高能层符号为
(2)硫酸锌溶于过量的氨水可形成[Zn(NH3)4]SO4溶液。
①[Zn(NH3)4]SO4中阴离子的空间构型为
②
 中,中心原子的轨道杂化类型为
中,中心原子的轨道杂化类型为③写出一种与
 互为等电子体的分子的化学式:
互为等电子体的分子的化学式:④NH3极易溶于水,除因为它们都是极性分子外,还因为
您最近一年使用:0次
名校
10 . 叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为2NaNH2+N2O==NaN3+NaOH+NH3,3NaNH2+NaNO3==NaN3+3NaOH+NH3↑。
回答下列问题:
(1)氮元素所在的周期中,电负性最大的元素是________ ,第一电离能最小的元素是_______ 。
(2)基态氮原子的L层电子排布图为_________________ 。
(3)与N3-互为等电子体的分子为_________ (写出一种)。依据价层电子对互斥理论,NO3-的空间构型是______________ ,其中心原子杂化类型是__________ 。
(4)叠氮化钠中不含有 的化学键类型有_____________ 。
A.离子键 B.极性共价键 C.σ键 D.π键
回答下列问题:
(1)氮元素所在的周期中,电负性最大的元素是
(2)基态氮原子的L层电子排布图为
(3)与N3-互为等电子体的分子为
(4)叠氮化钠中
A.离子键 B.极性共价键 C.σ键 D.π键
您最近一年使用:0次



