解题方法
1 . 铜是重要的过渡金属元素,铜被广泛应用于电子工业和航天领域中。回答下列问题:
(1) 的价电子排布式为
的价电子排布式为________ 。
(2) 可以与乙二胺
可以与乙二胺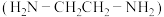 形成配离子,结构如图所示。
形成配离子,结构如图所示。________ 。
② 、
、 、
、 三种分子中,它们的键角由大到小的顺序为
三种分子中,它们的键角由大到小的顺序为________ (用分子式表示)。
(3)我国科学家制备了一种铜的配合物,结构如图所示,该配合物中四种非金属元素中第一电离能最大的是________ (填元素符号),配合物中 杂化的碳原子与
杂化的碳原子与 杂化的碳原子个数比为
杂化的碳原子个数比为________ 。________ 。
(1)
 的价电子排布式为
的价电子排布式为(2)
 可以与乙二胺
可以与乙二胺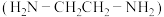 形成配离子,结构如图所示。
形成配离子,结构如图所示。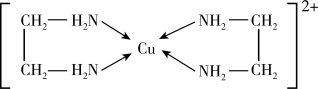
②
 、
、 、
、 三种分子中,它们的键角由大到小的顺序为
三种分子中,它们的键角由大到小的顺序为(3)我国科学家制备了一种铜的配合物,结构如图所示,该配合物中四种非金属元素中第一电离能最大的是
 杂化的碳原子与
杂化的碳原子与 杂化的碳原子个数比为
杂化的碳原子个数比为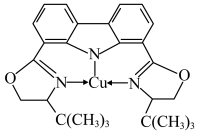
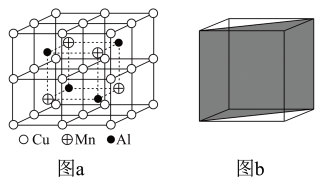
②在图c中画出Al和Mn的相对位置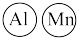 表示,不考虑各原子的大小)。
表示,不考虑各原子的大小)。
您最近一年使用:0次
23-24高三下·陕西西安·阶段练习
解题方法
2 . CdS、ZnS等硫化物与TiO2、SnO2、ZnO等进行复合,可以得到性能很好的复合半导体光催化剂。回答下列问题:
(1)Sn与C同主族,基态Sn原子的价层电子排布式为_______ ,基态Ti原子核外电子有_______ 种空间运动状态, 核外未成对电子数为
核外未成对电子数为_______ ,ZnS、ZnO中各元素的电负性由大到小的顺序为_______ 。
(2)许多具有—C═N—结构的分子及其硼配合物是较好的荧光材料,在光学探针、有机发光二极管等领域受到广泛关注,某两种含这种结构的分子如图1、图2所示。_______ ;图2中N原子会和B原子形成配位键,成键时_______ (填元素符号)原子提供空轨道。
(3)N、O、F三种元素的第一电离能由大到小的顺序为_______ (填元素符号),解释其原因:_______ 。
(4)钾冰晶石型晶体是一类新型的无机闪烁体,在核安全以及国土安全检查方面有重要的应用。如图是一种钾冰晶石型闪烁体的晶胞结构,属于立方晶系,其中A位是 、B位是
、B位是 、R位是正三价的Y(钇),X位是
、R位是正三价的Y(钇),X位是 。
。_______ 。
②若晶胞参数为anm,该晶体的密度为_______ g (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)Sn与C同主族,基态Sn原子的价层电子排布式为
 核外未成对电子数为
核外未成对电子数为(2)许多具有—C═N—结构的分子及其硼配合物是较好的荧光材料,在光学探针、有机发光二极管等领域受到广泛关注,某两种含这种结构的分子如图1、图2所示。

(3)N、O、F三种元素的第一电离能由大到小的顺序为
(4)钾冰晶石型晶体是一类新型的无机闪烁体,在核安全以及国土安全检查方面有重要的应用。如图是一种钾冰晶石型闪烁体的晶胞结构,属于立方晶系,其中A位是
 、B位是
、B位是 、R位是正三价的Y(钇),X位是
、R位是正三价的Y(钇),X位是 。
。
②若晶胞参数为anm,该晶体的密度为
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
解题方法
3 . 我国自主研发的用氟硼铍酸钾(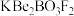 )晶体制造深紫外固体激光器技术领先世界。回答下列问题:
)晶体制造深紫外固体激光器技术领先世界。回答下列问题:
(1)基态K原子核外有_____ 种不同运动状态的电子,能量最低的空轨道的符号是_____ 。
(2)在1000℃时,氯化铍以 形式存在,该分子的空间构型为
形式存在,该分子的空间构型为_____ ;在500~600℃气相中,氯化铍则以二聚体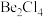 的形式存在,画出
的形式存在,画出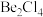 的结构:
的结构:_____ (标出配位键)。
(3)在第二周期中第一电离能介于B和O两种元素之间的元素有_____ (填元素符号)。
(4) 分子中的
分子中的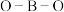 的键角大于
的键角大于 中的
中的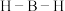 的键角,判断依据是
的键角,判断依据是_____ (从中心原子杂化方式的角度来解释)。
(5)一定条件下,实验测得的HF的相对分子质量总是大于理论值,原因是_____ 。
(6)六方氮化硼在高温高压下,可以转化为立方氮化硼,二者晶体结构如图所示: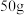 六方氮化硼晶体中含有六元环的数目为
六方氮化硼晶体中含有六元环的数目为_____  (用
(用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
②立方氮化硼晶体中,设晶胞中最近的B、N原子之间的距离为apm,晶体的密度为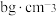 。则阿伏加德罗常数为
。则阿伏加德罗常数为_____  。(列式即可,用含a、b的代数式表示)
。(列式即可,用含a、b的代数式表示)
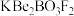 )晶体制造深紫外固体激光器技术领先世界。回答下列问题:
)晶体制造深紫外固体激光器技术领先世界。回答下列问题:(1)基态K原子核外有
(2)在1000℃时,氯化铍以
 形式存在,该分子的空间构型为
形式存在,该分子的空间构型为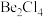 的形式存在,画出
的形式存在,画出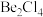 的结构:
的结构:(3)在第二周期中第一电离能介于B和O两种元素之间的元素有
(4)
 分子中的
分子中的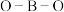 的键角大于
的键角大于 中的
中的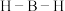 的键角,判断依据是
的键角,判断依据是(5)一定条件下,实验测得的HF的相对分子质量总是大于理论值,原因是
(6)六方氮化硼在高温高压下,可以转化为立方氮化硼,二者晶体结构如图所示:

 六方氮化硼晶体中含有六元环的数目为
六方氮化硼晶体中含有六元环的数目为 (用
(用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。②立方氮化硼晶体中,设晶胞中最近的B、N原子之间的距离为apm,晶体的密度为
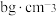 。则阿伏加德罗常数为
。则阿伏加德罗常数为 。(列式即可,用含a、b的代数式表示)
。(列式即可,用含a、b的代数式表示)
您最近一年使用:0次
解题方法
4 . 回答下列问题。
(1)白磷(P4)在氯气中燃烧可生成 PCl3 和 PCl5。
①形成 PCl5时,P 原子的一个 3s 电子激发入 3d 轨道后参与成键,该激发态的价电子排布式为___________ 。
②研究表明,在加压条件下 PCl5 于 148℃液化时能发生与水类似的自偶电离,形成一种能导电的熔体,其电离方程式为___________ ,产生的阳离子的空间结构形状为___________ 。
(2)分子中的大π键可用符号 表示,其中 m 代表参与形成大π键的原子数,n 代表参与形成大键的电子数(如苯分子中的大π键可表示为
表示,其中 m 代表参与形成大π键的原子数,n 代表参与形成大键的电子数(如苯分子中的大π键可表示为 )。一种观点认为,苯酚羟基中的 O 原子是 sp2 杂化则苯酚中的大π键可表示为
)。一种观点认为,苯酚羟基中的 O 原子是 sp2 杂化则苯酚中的大π键可表示为___________ ,一定在同一平面上的原子有___________ 个。乙醇显中性而苯酚显酸性的原因是:___________ 。
(3)硫化锌精矿是冶炼金属锌的主要原料,六方硫化锌(纤锌矿型)的平行六面体晶胞如图 2 所示,晶体中正负离子的配位数之比为___________ 。___________ g•cm-3。
(1)白磷(P4)在氯气中燃烧可生成 PCl3 和 PCl5。
①形成 PCl5时,P 原子的一个 3s 电子激发入 3d 轨道后参与成键,该激发态的价电子排布式为
②研究表明,在加压条件下 PCl5 于 148℃液化时能发生与水类似的自偶电离,形成一种能导电的熔体,其电离方程式为
(2)分子中的大π键可用符号
 表示,其中 m 代表参与形成大π键的原子数,n 代表参与形成大键的电子数(如苯分子中的大π键可表示为
表示,其中 m 代表参与形成大π键的原子数,n 代表参与形成大键的电子数(如苯分子中的大π键可表示为 )。一种观点认为,苯酚羟基中的 O 原子是 sp2 杂化则苯酚中的大π键可表示为
)。一种观点认为,苯酚羟基中的 O 原子是 sp2 杂化则苯酚中的大π键可表示为(3)硫化锌精矿是冶炼金属锌的主要原料,六方硫化锌(纤锌矿型)的平行六面体晶胞如图 2 所示,晶体中正负离子的配位数之比为


您最近一年使用:0次
解题方法
5 . 已发现的高温超导材料按成分分为含铜的和不含铜的。含铜超导材料有铋锶钙铜氧体系、铅锶钇铜氧体系等,不含铜超导体主要是钡镓铋氧体系等。回答下列问题:
(1)钇(Y)的原子序数比 大
大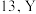 位于元素周期表的第
位于元素周期表的第___________ 族。
(2)基态铜原子的价电子排布式为___________ 。
(3)第一电离能: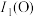
___________ (填“>”“<”或“=”)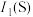 ,其原因是
,其原因是___________ 。
(4) 能与
能与 和
和 形成络合物
形成络合物 。键角:
。键角:
___________ (填“>”或“<”) ,
, 的配位数为
的配位数为___________ , 的空间构型为
的空间构型为___________ , 的杂化方式为
的杂化方式为___________ 。
(5)一种高温超导材料的晶胞结构如图所示,该立方晶胞参数为 。阿伏加德罗常数的值为NA。
。阿伏加德罗常数的值为NA。___________ 。
②晶体中与 最近且距离相等的
最近且距离相等的 有
有___________ 个。
③该晶体的密度为___________  。
。
(1)钇(Y)的原子序数比
 大
大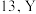 位于元素周期表的第
位于元素周期表的第(2)基态铜原子的价电子排布式为
(3)第一电离能:
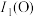
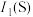 ,其原因是
,其原因是(4)
 能与
能与 和
和 形成络合物
形成络合物 。键角:
。键角:
 ,
, 的配位数为
的配位数为 的空间构型为
的空间构型为 的杂化方式为
的杂化方式为(5)一种高温超导材料的晶胞结构如图所示,该立方晶胞参数为
 。阿伏加德罗常数的值为NA。
。阿伏加德罗常数的值为NA。
②晶体中与
 最近且距离相等的
最近且距离相等的 有
有③该晶体的密度为
 。
。
您最近一年使用:0次
6 . 卤族元素的单质和化合物在生产生活中有重要的用途。请回答:
(1)卤族元素位于元素周期表的___________ 区,溴原子的M能层电子排布式为___________ 。
(2) 的VSEPR模型如图,中心I原子的杂化方式是___________。
的VSEPR模型如图,中心I原子的杂化方式是___________。
(3) 与囟素性质相似,与
与囟素性质相似,与 反应生成
反应生成 和
和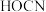 ,反应中所涉及元素的电负性由大到小的顺序为
,反应中所涉及元素的电负性由大到小的顺序为___________  的酸性
的酸性___________ (填“大于”或“小于”) 的酸性。
的酸性。
(4)一定条件下 与
与 以物质的量之比为1:1混合得到一种固态离子化合物,其结构组成可能为:(a)
以物质的量之比为1:1混合得到一种固态离子化合物,其结构组成可能为:(a)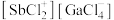 或(b)
或(b) ,该离子化合物最可能的结构组成为
,该离子化合物最可能的结构组成为___________ (填“a”或“b”),理由是___________ 。
(5)我国科研小组在全无机铅钙钛矿薄膜制备和光伏电池研究方面取得新进展。研究人员采用 和二甲基碘化铵(DMAI)作为前驱体,通过真空辅助热退火的方法制备了钙钛矿薄膜,其晶胞结构如图一,沿x、y、z轴方向的投影均为图二。
和二甲基碘化铵(DMAI)作为前驱体,通过真空辅助热退火的方法制备了钙钛矿薄膜,其晶胞结构如图一,沿x、y、z轴方向的投影均为图二。 的配位数为
的配位数为___________ 。
②设 为阿伏加德罗常数的值,晶体中相邻
为阿伏加德罗常数的值,晶体中相邻 之间的最短距离为anm,则晶体密度为
之间的最短距离为anm,则晶体密度为___________  。
。
(1)卤族元素位于元素周期表的
(2)
 的VSEPR模型如图,中心I原子的杂化方式是___________。
的VSEPR模型如图,中心I原子的杂化方式是___________。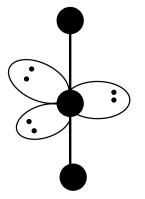
A. | B. | C. | D. |
(3)
 与囟素性质相似,与
与囟素性质相似,与 反应生成
反应生成 和
和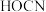 ,反应中所涉及元素的电负性由大到小的顺序为
,反应中所涉及元素的电负性由大到小的顺序为 的酸性
的酸性 的酸性。
的酸性。(4)一定条件下
 与
与 以物质的量之比为1:1混合得到一种固态离子化合物,其结构组成可能为:(a)
以物质的量之比为1:1混合得到一种固态离子化合物,其结构组成可能为:(a)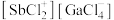 或(b)
或(b) ,该离子化合物最可能的结构组成为
,该离子化合物最可能的结构组成为(5)我国科研小组在全无机铅钙钛矿薄膜制备和光伏电池研究方面取得新进展。研究人员采用
 和二甲基碘化铵(DMAI)作为前驱体,通过真空辅助热退火的方法制备了钙钛矿薄膜,其晶胞结构如图一,沿x、y、z轴方向的投影均为图二。
和二甲基碘化铵(DMAI)作为前驱体,通过真空辅助热退火的方法制备了钙钛矿薄膜,其晶胞结构如图一,沿x、y、z轴方向的投影均为图二。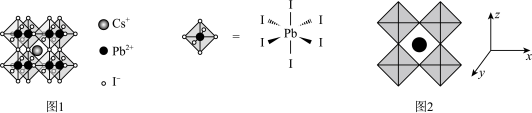
 的配位数为
的配位数为②设
 为阿伏加德罗常数的值,晶体中相邻
为阿伏加德罗常数的值,晶体中相邻 之间的最短距离为anm,则晶体密度为
之间的最短距离为anm,则晶体密度为 。
。
您最近一年使用:0次
7 . 黄铜矿(CuFeS2)是工业炼铜,炼铁和制硫酸的重要原料。回答下列问题:
(1)铜元素位于元素周期表___________ 区,基态Fe2+的价层电子排布图(轨道表示式)是___________ 。
(2)气态SO3以单分子形式存在,其分子的空间结构为___________ 。固体:SO3中存在如图1所示的三聚分子,该分子中S原子的杂化轨道类型为___________ 。___________ 。
②该配离子中H—O—H的键角___________ (填“大于”、“小于”或“等于”)单个水分子中H—O——H的键角。
(4)①改性Fe3O4是一种优良的磁性材料,Fe3O4晶胞的 的结构如图3所示,研究发现结构中的Fe2+只可能出现在图中某一“▲”所示位置上,请确定Fe2+在晶胞中的位置是
的结构如图3所示,研究发现结构中的Fe2+只可能出现在图中某一“▲”所示位置上,请确定Fe2+在晶胞中的位置是___________ (填“a”或“b”或“c”)。
②普鲁士蓝晶体属于立方晶系,晶胞结构如图4所示(CN⁻在图中省略),该晶体的化学式为___________ 。
(1)铜元素位于元素周期表
(2)气态SO3以单分子形式存在,其分子的空间结构为

②该配离子中H—O—H的键角
(4)①改性Fe3O4是一种优良的磁性材料,Fe3O4晶胞的
 的结构如图3所示,研究发现结构中的Fe2+只可能出现在图中某一“▲”所示位置上,请确定Fe2+在晶胞中的位置是
的结构如图3所示,研究发现结构中的Fe2+只可能出现在图中某一“▲”所示位置上,请确定Fe2+在晶胞中的位置是②普鲁士蓝晶体属于立方晶系,晶胞结构如图4所示(CN⁻在图中省略),该晶体的化学式为

您最近一年使用:0次
2024-05-08更新
|
226次组卷
|
2卷引用:2024届内蒙古自治区赤峰市高三下学期三模理科综合试题-高中化学
名校
解题方法
8 . 科技强国,我国科学家在诸多领域取得新突破。
(1)芯片制造会经过六个最为关键的步骤:沉积、光刻胶涂覆、光刻、刻蚀、离子注入和封装。其中“刻蚀”过程可能用到刻蚀剂 、
、 及清洗剂
及清洗剂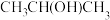 。
。
①基态F原子核外电子有_____ 种空间运动状态,下列为氟原子激发态的电子排布式的是_____ (填标号)。
A. B.
B. C.
C. D.
D.
②C、N、O、F四种元素的第一电离能由大到小的顺序为__________ 。
③氟硼酸铵( )中B的杂化方式为
)中B的杂化方式为__________ , 的空间构型为
的空间构型为__________ 。
(2)复兴号高铁车体材质用到了Mn、Co等元素。Mn的一种配合物的化学式为[Mn(CO)5(CH3CN)],CH3CN与Mn原子配位时,提供孤电子对的是__________ (填元素符号),Mn原子的配位数为__________ ,CH3CN中 键与
键与 键数目之比为
键数目之比为__________ 。
(3)超导材料 具有
具有 型结构(如图),晶胞参数(晶胞边长)为a pm,该氮化钛晶体的密度为
型结构(如图),晶胞参数(晶胞边长)为a pm,该氮化钛晶体的密度为__________ (列出计算式即可) 。
。
(1)芯片制造会经过六个最为关键的步骤:沉积、光刻胶涂覆、光刻、刻蚀、离子注入和封装。其中“刻蚀”过程可能用到刻蚀剂
 、
、 及清洗剂
及清洗剂 。
。①基态F原子核外电子有
A.
 B.
B. C.
C. D.
D.
②C、N、O、F四种元素的第一电离能由大到小的顺序为
③氟硼酸铵(
 )中B的杂化方式为
)中B的杂化方式为 的空间构型为
的空间构型为(2)复兴号高铁车体材质用到了Mn、Co等元素。Mn的一种配合物的化学式为[Mn(CO)5(CH3CN)],CH3CN与Mn原子配位时,提供孤电子对的是
 键与
键与 键数目之比为
键数目之比为(3)超导材料
 具有
具有 型结构(如图),晶胞参数(晶胞边长)为a pm,该氮化钛晶体的密度为
型结构(如图),晶胞参数(晶胞边长)为a pm,该氮化钛晶体的密度为 。
。
您最近一年使用:0次
2024-04-11更新
|
271次组卷
|
4卷引用:2024届内蒙古锡林郭勒盟高三第三次模拟考试理综试卷-高中化学
2024届内蒙古锡林郭勒盟高三第三次模拟考试理综试卷-高中化学(已下线)化学(上海卷03)-2024年高考押题预测卷2024届青海省部分学校高三下学期模拟考试理综试题-高中化学2024届宁夏回族自治区石嘴山市平罗中学高三下学期模拟预测理综试题-高中化学
9 . N、P、As为第VA族元素,该族元素及其化合物在生产、生活中有广泛应用。回答下列问题:
(1)基态As原子核外有______ 个未成对电子,N、P、As电负性由大到小的顺序为______ 。
(2)已知:4AsH3 As4+6H2↑,AsH3的空间结构为
As4+6H2↑,AsH3的空间结构为______ ,已知As4为正四面体结构,则1molAs4中含______ molσ键。
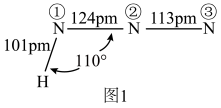
(3)氨、肼(N2H4)和叠氮酸(HN3)都是氮元素的重要氢化物,肼的相对分子质量与乙烷(C2H6)接近,但沸点远高于乙烷的原因是______ 。叠氮酸的结构如图1所示,分子中②号N原子的杂化方式为_______ 。_______ ,该晶体的密度为______ g cm3。
cm3。
(1)基态As原子核外有
(2)已知:4AsH3
 As4+6H2↑,AsH3的空间结构为
As4+6H2↑,AsH3的空间结构为(3)氨、肼(N2H4)和叠氮酸(HN3)都是氮元素的重要氢化物,肼的相对分子质量与乙烷(C2H6)接近,但沸点远高于乙烷的原因是
 cm3。
cm3。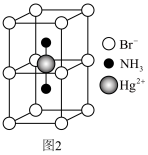
您最近一年使用:0次
名校
10 . 我国在新材料领域研究的重大突破,为“天宫”空间站的建设提供了坚实的物质基础。“天宫”空间站使用的材料中含有B、C、N、Ni等元素。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是_______ (填标号,下同),用光谱仪可捕捉到发射光谱的是_______ 。
A. B.
B. 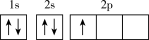
C.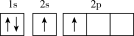 D.
D. 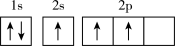
(2)镍能形成多种配合物,其中 是无色挥发性液体,
是无色挥发性液体,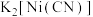 是红黄色单斜晶体。
是红黄色单斜晶体。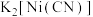 的熔点高于
的熔点高于 的原因是
的原因是_______ 。
(3)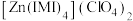 是
是 的一种配合物,IMI的结构为
的一种配合物,IMI的结构为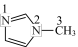 ,其中碳原子杂化方式为
,其中碳原子杂化方式为_______ ,所含元素电负性由大到小的顺序是_______ 。IMI中大π键可表示为_______ (已知苯中的大π键可表示为 ),该配合物的配位原子为
),该配合物的配位原子为_______ (填序号)。
(4)氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,质地软,可作润滑剂。立方相氮化硼与金刚石相似,是超硬材料,有优异的耐磨性。它们的晶体结构及晶胞如图所示。
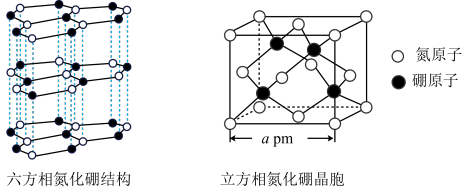
①石墨能导电,六方相氮化硼结构与石墨相似却不导电,原因是_______ 。
②立方相氮化硼晶体中“一般共价键”与配位键的数目之比为_______ 。
(5)红银矿NiAs晶体结构如图所示:
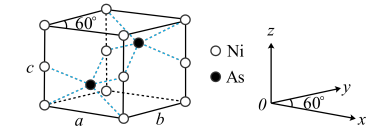
①两个As原子的原子分数坐标依次为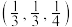 和
和_______ 。
②已知 为阿伏加德罗常数的值,X射线光谱测算出的晶胞参数为a=b=mpm、c=npm,则该晶体的密度为
为阿伏加德罗常数的值,X射线光谱测算出的晶胞参数为a=b=mpm、c=npm,则该晶体的密度为_______  (用含m、n的代数式表示)。
(用含m、n的代数式表示)。
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是
A.
 B.
B. 
C.
 D.
D. 
(2)镍能形成多种配合物,其中
 是无色挥发性液体,
是无色挥发性液体,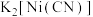 是红黄色单斜晶体。
是红黄色单斜晶体。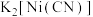 的熔点高于
的熔点高于 的原因是
的原因是(3)
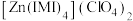 是
是 的一种配合物,IMI的结构为
的一种配合物,IMI的结构为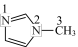 ,其中碳原子杂化方式为
,其中碳原子杂化方式为 ),该配合物的配位原子为
),该配合物的配位原子为(4)氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,质地软,可作润滑剂。立方相氮化硼与金刚石相似,是超硬材料,有优异的耐磨性。它们的晶体结构及晶胞如图所示。

①石墨能导电,六方相氮化硼结构与石墨相似却不导电,原因是
②立方相氮化硼晶体中“一般共价键”与配位键的数目之比为
(5)红银矿NiAs晶体结构如图所示:

①两个As原子的原子分数坐标依次为
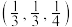 和
和②已知
 为阿伏加德罗常数的值,X射线光谱测算出的晶胞参数为a=b=mpm、c=npm,则该晶体的密度为
为阿伏加德罗常数的值,X射线光谱测算出的晶胞参数为a=b=mpm、c=npm,则该晶体的密度为 (用含m、n的代数式表示)。
(用含m、n的代数式表示)。
您最近一年使用:0次



