名校
解题方法
1 . 元素周期表中第VIIA族元素包括氟(F)、氯(C1)、溴(Br)、碘(I)、砹(At),简称卤素。卤素及其化合物在生产生活中的应用非常广泛。回答下列问题:
(1)氯原子的核外电子排布式为_______ 。
(2)为了延长液氯的杀菌时间,某些自来水厂在用液氯进行消毒处理时还加入了液氨,其反应的化学方程式为NH3+HClO=H2O+NH2Cl,其中N、O、H的电负性由小到大的顺序为_______ (用元素符号表示);HClO中氧原子的杂化方式为_______ :NH3分子的VSEPR模型为_______ ;在水和苯两种溶剂中,NH2Cl更易溶于_______ 。
(3)卤素单质的化学键的键参数如表所示:
从物质结构角度分析,F—F键的键能反常的原因是_______ 。
(4)AgCl的晶胞与NaCl的类似,AgCl的晶胞结构如图所示,已知晶胞边长为 a pm,则晶胞内Ag+的配位数为_______ ,晶胞的6个面心围成的正八面体的边长为_______ pm,设阿伏加德罗常数的值为NA,则该晶体的密度为_______ (列出计算表达式)g·cm-3。

(1)氯原子的核外电子排布式为
(2)为了延长液氯的杀菌时间,某些自来水厂在用液氯进行消毒处理时还加入了液氨,其反应的化学方程式为NH3+HClO=H2O+NH2Cl,其中N、O、H的电负性由小到大的顺序为
(3)卤素单质的化学键的键参数如表所示:
| 化学键 | F-F | Cl-Cl | Br-Br | I-I |
| 键长/pm | 141 | 198 | 228 | 267 |
| 键能/(kJ·mol-1) | 157 | 242.7 | 193.7 | 152.7 |
从物质结构角度分析,F—F键的键能反常的原因是
(4)AgCl的晶胞与NaCl的类似,AgCl的晶胞结构如图所示,已知晶胞边长为 a pm,则晶胞内Ag+的配位数为

您最近一年使用:0次
2022-05-25更新
|
302次组卷
|
3卷引用:内蒙古赤峰市2022届高三下学期5月模拟考试理科综合化学试题
2 . 磷及其化合物在电池、催化等领域有重要应用。黑磷与石墨类似,也具有层状结构(如图1)。为大幅度提高锂电池的充电速率,科学家最近研发了黑磷-石墨复合负极材料,其单层结构俯视图如图2所示。

回答下列问题:
(1)Li 、C、P三种元素中,电负性最小的是_______ (用元素符号作答)。
(2)基态磷原子的电子排布式为_______ 。
(3)图2中,黑磷区P原子的杂化方式为_______ ,石墨区C原子的杂化方式为_______ 。
(4)氢化物PH3、CH4、NH3的沸点最高的是_______ ,原因是_______ 。
(5)根据图1和图2的信息,下列说法正确的有_______ (填字母)。
a.黑磷区P- P键的键能不完全相同
b.黑磷与石墨都属于混合型晶体
c.复合材料单层中,P原子与C原子之间的作用力属范德华力
(6)LiPF6、LiAsF6.等也可作为聚乙二醇锂离子电池的电极材料。电池放电时, Li+沿聚乙二醇分子中的碳氧链向正极迁移的过程如图所示(图中阴离子未画出)。

①从化学键角度看, Li+迁移过程发生_______ (填“物理”或“化学” )变化。
②相同条件下,电极材料_______ ( 填“LiPF6”或“LiAsF6”)中的Li+迁移较快,原因是_______ 。
(7)贵金属磷化物Rh2P(化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图3所示。已知晶胞参数为anm,晶体中与P距离最近的Rh的数目为_______ ,晶体的密度为_______ g·cm-3(列出计算式)。
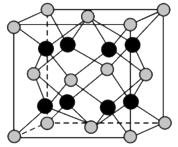
图3

回答下列问题:
(1)Li 、C、P三种元素中,电负性最小的是
(2)基态磷原子的电子排布式为
(3)图2中,黑磷区P原子的杂化方式为
(4)氢化物PH3、CH4、NH3的沸点最高的是
(5)根据图1和图2的信息,下列说法正确的有
a.黑磷区P- P键的键能不完全相同
b.黑磷与石墨都属于混合型晶体
c.复合材料单层中,P原子与C原子之间的作用力属范德华力
(6)LiPF6、LiAsF6.等也可作为聚乙二醇锂离子电池的电极材料。电池放电时, Li+沿聚乙二醇分子中的碳氧链向正极迁移的过程如图所示(图中阴离子未画出)。

①从化学键角度看, Li+迁移过程发生
②相同条件下,电极材料
(7)贵金属磷化物Rh2P(化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图3所示。已知晶胞参数为anm,晶体中与P距离最近的Rh的数目为

图3
您最近一年使用:0次
解题方法
3 . 含铜物质在生产生活中有着广泛应用回答下列问题:
(1)基态Cu原子最高能层的电子排布式为___ 。
(2)CuCl2稀溶液中存[Cu(H2O)6]2+。已知d轨道也可以参与杂化,则[Cu(H2O)6]2+中Cu的杂化方式为___ (填选项字母)。
(3)铜盐属于重金属盐,铜盐中毒可用青霉胺解毒,解毒原理如下:Cu2+能与青霉胺形成环状络合物,该环状络合物无毒、易溶于水,可经尿液排出。
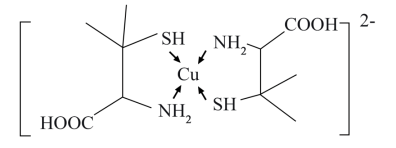
①比较硫化氢与氨气键角的大小:H2S___ NH3(填“>”或“<”) 。
②第二周期元素中,第一电离能大于N的元素有___ (用元素符号表示)。
③请解释该化合物易溶于水的主要原因:___ 。
④该环状络合物中,VSEPR模型为四面体或正四面体的非金属原子共有___ 个。
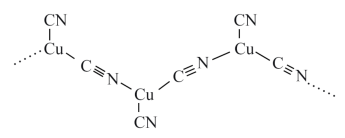
(4)Cu+与CN-形成长链阴离子,其结构片段如图所示,该阴离子中σ键与π键数目之比为___ 。
(5)一种由Cu、In、Te组成的高熵合金具有优良的热电性能,其四方晶胞如图所示:

①In的配位数为___ ;晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为___ 。
②若晶胞底边正方形的边长均为anm,高为cnm,阿伏加德罗常数的值为NA设晶体的最简式的式量为Mr,则该晶体的密度为____ g·cm-3(列出计算式)。
(1)基态Cu原子最高能层的电子排布式为
(2)CuCl2稀溶液中存[Cu(H2O)6]2+。已知d轨道也可以参与杂化,则[Cu(H2O)6]2+中Cu的杂化方式为
| A.sp3 | B.sp3d | C.d2sp3 | D.dsp2 |

①比较硫化氢与氨气键角的大小:H2S
②第二周期元素中,第一电离能大于N的元素有
③请解释该化合物易溶于水的主要原因:
④该环状络合物中,VSEPR模型为四面体或正四面体的非金属原子共有
(4)Cu+与CN-形成长链阴离子,其结构片段如图所示,该阴离子中σ键与π键数目之比为

(5)一种由Cu、In、Te组成的高熵合金具有优良的热电性能,其四方晶胞如图所示:

①In的配位数为
②若晶胞底边正方形的边长均为anm,高为cnm,阿伏加德罗常数的值为NA设晶体的最简式的式量为Mr,则该晶体的密度为
您最近一年使用:0次
解题方法
4 . (NH4)3[Fe(SCN)6]、[Fe(TCNE)(NCCH3)2][FeCl4] 、K4[Fe(CN)6]·3H2O等铁的配合物用途非常广泛。回答下列问题:
(1)基态Fe原子价层电子的电子排布式为_______ 。
(2)Fe与Ca位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是_______ 。
(3)配合物(NH4)3[Fe(SCN)6]中的H、S、N的电负性从大到小的顺序是_______ 。
(4)[Fe(TCNE)(NCCH3)2][FeCl4]中,配体为CH3CN和TCNE(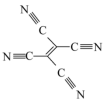 )。
)。
①CH3CN中碳原子的杂化方式是_______ 。
②TCNE中第一电离能较大的是_______ (填元素符号),分子中所有原子_______ (填“在”或“不在”)同一平面,分子中σ 键与π键的数目之比是_______ 。
(5)K4[Fe(CN)6]·3H2O是食盐的抗结剂,强热分解有Fe3C生成,Fe3C的晶胞结构如图所示(NA代表阿伏加德罗常数的数值):

Fe3C的密度为_______ (列出计算式)g·cm-3(1Å=10-8 cm)。
(1)基态Fe原子价层电子的电子排布式为
(2)Fe与Ca位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是
(3)配合物(NH4)3[Fe(SCN)6]中的H、S、N的电负性从大到小的顺序是
(4)[Fe(TCNE)(NCCH3)2][FeCl4]中,配体为CH3CN和TCNE(
 )。
)。①CH3CN中碳原子的杂化方式是
②TCNE中第一电离能较大的是
(5)K4[Fe(CN)6]·3H2O是食盐的抗结剂,强热分解有Fe3C生成,Fe3C的晶胞结构如图所示(NA代表阿伏加德罗常数的数值):

Fe3C的密度为
您最近一年使用:0次
解题方法
5 . 在元素周期表中,铜副族(IB族)包括铜、银、金等元素,在生产、生活和科研中都有着广泛用途和重要的研究价值。
(1)Ag元素在元素周期表分区中属于_______ 区,基态Ag原子的价电子排布式为_______ 。
(2)硫代硫酸银(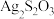 )是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠(
)是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠( )溶液生成
)溶液生成 等络阴离子。
等络阴离子。
①依据 理论推测
理论推测 的空间构型为
的空间构型为_______ ,中心原子S的杂化方式为_______ 。
②在 中配位原子是S原子而非O原子,其原因是
中配位原子是S原子而非O原子,其原因是_______ 。
(3)碘化银常用于做人工增雨剂。其中碘元素形成的最高价氧化物对应水化物有 (偏高碘酸,不稳定)和
(偏高碘酸,不稳定)和 (正高碘酸)等多种形式,它们的酸性
(正高碘酸)等多种形式,它们的酸性
_______  (填“弱于”、“等于”或“强于”)。而
(填“弱于”、“等于”或“强于”)。而 、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是
、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是_______ 。
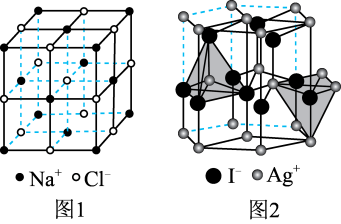
(4)在离子晶体中,当 (阳离子)∶r(阴离子)
(阳离子)∶r(阴离子) 时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知
时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知 ,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为
,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为_______ ,造成AgI晶体结构不同于NaCl晶体结构的原因不可能是_______ (填标号)。
a.几何因素 b.电荷因素 c.键性因素
(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体(密度为 ),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为
),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为_______ ;若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______ (储氢能力 )
)
(1)Ag元素在元素周期表分区中属于
(2)硫代硫酸银(
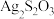 )是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠(
)是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠( )溶液生成
)溶液生成 等络阴离子。
等络阴离子。①依据
 理论推测
理论推测 的空间构型为
的空间构型为②在
 中配位原子是S原子而非O原子,其原因是
中配位原子是S原子而非O原子,其原因是(3)碘化银常用于做人工增雨剂。其中碘元素形成的最高价氧化物对应水化物有
 (偏高碘酸,不稳定)和
(偏高碘酸,不稳定)和 (正高碘酸)等多种形式,它们的酸性
(正高碘酸)等多种形式,它们的酸性
 (填“弱于”、“等于”或“强于”)。而
(填“弱于”、“等于”或“强于”)。而 、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是
、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是(4)在离子晶体中,当
 (阳离子)∶r(阴离子)
(阳离子)∶r(阴离子) 时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知
时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知 ,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为
,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为a.几何因素 b.电荷因素 c.键性因素

(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体(密度为
 ),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为
),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为 )
)
您最近一年使用:0次
2022-04-25更新
|
1264次组卷
|
4卷引用:内蒙古包头市2022届高三第二次模拟考试理综试卷化学试题
内蒙古包头市2022届高三第二次模拟考试理综试卷化学试题(已下线)押全国卷理综第35题 物质结构与性质-备战2022年高考化学临考题号押题(课标全国卷)(已下线)【直抵名校】01-备战2022年高考化学名校进阶模拟卷(通用版)河南省南阳市2021-2022学年高二下学期期末考试化学试题
解题方法
6 . 铁及含铁的化合物在生产生活中的应用广泛。回答下列问题:
(1)基态铁原子的核外电子排布式为___________ 。前四周期元素中,基态原子未成对电子数比铁原子多的元素有___________ 种。
(2)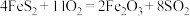 是工业制硫酸的主要反应,
是工业制硫酸的主要反应, 的VSEPR模型名称是
的VSEPR模型名称是___________ ; 分子中
分子中 键与
键与 键的数目之比为
键的数目之比为___________ 。
(3)血红素是血红蛋白的辅基,其结构如图1所示,结构中C原子的杂化方式为___________ ,所含非金属原子的电负性由大到小的顺序为___________ ;所含化学键的类型有___________ (填标号)。
a.极性键 b.非极性键 c.氢键 d.配位键 e.金属键
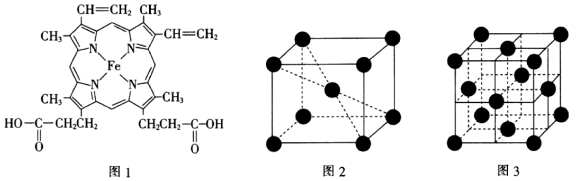
(4)温度在1183K以下,纯铁晶体(甲)的晶胞结构如图2所示,温度在1183K以上,纯铁晶体(乙)的晶胞结构如图3所示,两种晶体中铁原子之间的最短距离相等,甲晶体中铁原子的配位数与乙晶体中铁原子的配位数之比为___________ ;甲晶体的晶胞边长与乙晶体的晶胞边长之比为___________ ;甲晶体的密度与乙晶体的密度之比为___________ 。
(1)基态铁原子的核外电子排布式为
(2)
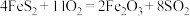 是工业制硫酸的主要反应,
是工业制硫酸的主要反应, 的VSEPR模型名称是
的VSEPR模型名称是 分子中
分子中 键与
键与 键的数目之比为
键的数目之比为(3)血红素是血红蛋白的辅基,其结构如图1所示,结构中C原子的杂化方式为
a.极性键 b.非极性键 c.氢键 d.配位键 e.金属键

(4)温度在1183K以下,纯铁晶体(甲)的晶胞结构如图2所示,温度在1183K以上,纯铁晶体(乙)的晶胞结构如图3所示,两种晶体中铁原子之间的最短距离相等,甲晶体中铁原子的配位数与乙晶体中铁原子的配位数之比为
您最近一年使用:0次
2022-03-17更新
|
661次组卷
|
4卷引用:内蒙古呼伦贝尔市 2022届高三一模理科综合化学试题
名校
解题方法
7 . 碳、氮、氟、硅、铜等元素的化合物广泛存在于自然界,回答下列问题:
(1)基态氟原子核外电子的运动状态有_______ 种;氟原子的价电子排布式为_______ 。
(2)NF3是微电子工业中优良的等离子刻蚀气体,NF3分子的空间构型为_______ ;写出与N2互为等电子体的一种离子的化学式_______ 。
(3)已知金刚石中的C-C键键长为154.45pm,C60中C-C键键长为145~140pm,而金刚石的熔点远远高于C60,其理由是_______ 。
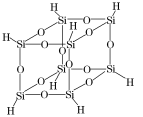
(4)氢基倍半硅氧烷的分子结构如图所示,该分子的分子式为_______ ,Si原子采用_______ 杂化。
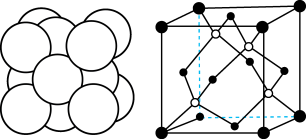
(5)Cu的某种晶体晶胞为面心立方结构,晶胞边长为acm,原子的半径为rcm。该晶体中铜原子的堆积方式为_______ (填“A1”“A2”或“A3”),该晶体的密度为_______ g/cm3(用含a和NA的代数式表示),该晶体中铜原子的空间利用率为_______ (用含a和r的代数式表达)。
(1)基态氟原子核外电子的运动状态有
(2)NF3是微电子工业中优良的等离子刻蚀气体,NF3分子的空间构型为
(3)已知金刚石中的C-C键键长为154.45pm,C60中C-C键键长为145~140pm,而金刚石的熔点远远高于C60,其理由是
(4)氢基倍半硅氧烷的分子结构如图所示,该分子的分子式为

(5)Cu的某种晶体晶胞为面心立方结构,晶胞边长为acm,原子的半径为rcm。该晶体中铜原子的堆积方式为
您最近一年使用:0次
2022-03-06更新
|
260次组卷
|
2卷引用:内蒙古包钢第一中学2021-2022学年高三下学期一模检测(B)化学试题
解题方法
8 . 铜是人类知道最早的金属之一,也是广泛使用的第一种金属。回答下列问题:
(1)镍白铜(铜镍合金)可用于制作仿银饰品。第二电离能I2(Cu)___________ (填“>”或“<”)I2(Ni),其原因为___________ 。
(2)向[Cu(NH3)2]Cl溶液中通入乙炔(C2H2)气体,可生成红棕色沉淀Cu2C2。
①C2H2分子中σ键与π键的数目之比为___________ ;碳原子的杂化方式为___________ ;
②写出与Cu2C2中阴离子C 互为等电子体的一种分子:
互为等电子体的一种分子:___________ 。
(3)在弱碱性环境中,EDTA( )易与Cu2+形成如图所示配离子,常用于Cu2+的定量测定。
)易与Cu2+形成如图所示配离子,常用于Cu2+的定量测定。
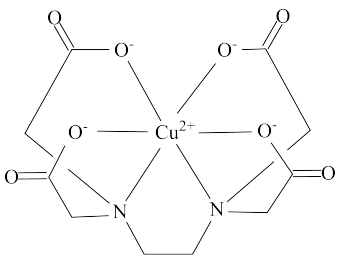
①1mol该配离子中配体数目为___________ (阿伏加德罗常数的值为NA)。
②EDTA能溶于水的原因为___________ 。
(4)铜与氧构成的某种化合物的立方晶胞如图甲所示,图乙是沿晶胞对角面取得的截图,晶胞中所有原子均在对角面上。该化合物的化学式为___________ ,若Cu原子之间最短距离为dpm,阿伏加德罗常数的值为NA,该晶体的密度为___________ g•cm-3(列出计算式即可)。

(1)镍白铜(铜镍合金)可用于制作仿银饰品。第二电离能I2(Cu)
(2)向[Cu(NH3)2]Cl溶液中通入乙炔(C2H2)气体,可生成红棕色沉淀Cu2C2。
①C2H2分子中σ键与π键的数目之比为
②写出与Cu2C2中阴离子C
 互为等电子体的一种分子:
互为等电子体的一种分子:(3)在弱碱性环境中,EDTA(
 )易与Cu2+形成如图所示配离子,常用于Cu2+的定量测定。
)易与Cu2+形成如图所示配离子,常用于Cu2+的定量测定。
①1mol该配离子中配体数目为
②EDTA能溶于水的原因为
(4)铜与氧构成的某种化合物的立方晶胞如图甲所示,图乙是沿晶胞对角面取得的截图,晶胞中所有原子均在对角面上。该化合物的化学式为

您最近一年使用:0次
9-10高二下·辽宁锦州·期末
名校
解题方法
9 . 如图所示,在乙烯分子中有5个σ键和一个π键,它们分别是
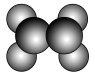
| A.sp2杂化轨道形成σ键,未杂化的2p轨道形成π键 |
| B.sp2杂化轨道形成π键,未杂化的2p轨道形成σ键 |
| C.C—H之间是sp2形成σ键,C—C之间是未参加杂化的2p轨道形成π键 |
| D.C—C之间是sp2形成σ键,C—H之间是未参加杂化的2p轨道形成π键 |
您最近一年使用:0次
2021-12-25更新
|
1596次组卷
|
67卷引用:内蒙古赤峰第二实验中学2021届高三模拟考试(一)化学试题
内蒙古赤峰第二实验中学2021届高三模拟考试(一)化学试题(已下线)2015届西藏拉萨中学高三第一次月考化学试卷2015届西藏拉萨中学高三第一次月考化学试卷2内蒙古包头市第三十三中学2016-2017学年高二下学期期末考试化学试题(已下线)2019年11月26日《每日一题》2020年高考化学一轮复习—— 共价键的分类与判断2020届高三化学二轮物质结构题型专攻——分子结构与性质【选择基础专练】天津市和平区2020届高三一模化学试题(已下线)第39练 共价键-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第40练 分子的空间结构-2023年高考化学一轮复习小题多维练(全国通用)(已下线)09—10年锦州市高二下学期期末考试化学卷(已下线)09~10年银川一中高二下学期期末考试化学卷(已下线)2010-2011学年山东省兖州市高二下学期期中考试化学试卷(已下线)2011-2012学年陕西省师大附中高二下学期期中考试化学试卷(已下线)2012--2013学年新疆乌鲁木齐市一中高二下学期期中考试化学试卷(平行班)(已下线)2012-2013学年宁夏银川一中高二下学期期末考试化学试卷(已下线)2014年高二鲁科版选修3化学规范训练2.2.1典型分子空间构型练习卷(已下线)2013届新疆乌鲁木齐市一中高二第二学期期中考试化学试卷2014-2015江苏省南通中学高二上学期期末化学(理)试卷2014-2015学年辽宁实验分校高二下6月阶段测试化学试卷2014-2015学年吉林省吉林市第一中学高二下期末化学试卷2015-2016学年西藏日喀则一中高二10月月考化学试卷2015-2016学年吉林省吉林五十五中高二下3月月考化学试卷2015-2016学年陕西西藏民族学院附中高二4月月考化学卷2015-2016学年广东汕头金山中学高二下第十二周练化学卷2015-2016学年山西省右玉一中高二5月月考化学试卷2015-2016学年河南省三门峡市灵宝一中高二下第一次月考化学试卷2015-2016学年山西省朔州市右玉一中高二下5月月考化学试卷河北省蠡县中学2016-2017学年高二6月月考化学试题河南省焦作市博爱一中2016-2017学年高二下学期第一次月考化学试题河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:2.2 第2课时人教版2017-2018学年高二化学选修三同步训练:2.2 分子的立体构型(第2课时)河北省石家庄市鹿泉一中2017-2018学年高二3月月考化学试题山东省单县五中2017-2018学年高二下学期第一次月考化学试题【全国百强校】宁夏吴忠中学2017-2018学年高二6月月考化学试题新疆兵团八师一四三团一中2018-2019学年高二下学期期中考试化学试题河南省林州市第一中学2019-2020学年高二3月线上调研考试化学试题山东省泰安市新泰市第二中学2019-2020学年高二下期中考试化学试题宁夏育才中学2019-2020学年高二下学期开学检测化学试题山西省太原市实验中学校2019-2020学年高二下学期期中考试化学试题河北省邯郸市大名县第一中学2019-2020学年高二下学期第四次半月考化学试题(清北班)甘肃省庆阳市镇原中学2019-2020学年高二下学期期末考试化学试题四川省自贡市田家炳中学2020-2021学年高二上学期开学考试化学试题安徽省蚌埠第三中学2019-2020学年高二下学期期末考试化学试题新疆哈密市第八中学2019-2020学年高二下学期期中考试化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 第二节 分子的空间结构高二选择性必修3(人教版2019)第一章 有机化合物的结构特点与研究方法 第一节 有机化合物的结构特点 课时2 有机化合物中的共价键(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 第2节 共价键与分子的空间结构(人教版2019)选择性必修2 第二章 分子结构与性质 第二节 分子的空间结构 课时2 杂化轨道理论鲁科版2019选择性必修2第2章 微粒间相互作用与物质性质 第2节 共价键与分子的空间结构 第1课时 分子空间结构的理论分析高二选择性必修2(人教版2019)第二章 分子结构与性质 第二节 分子的空间结构 课时2 杂化轨道理论(已下线)2.2.1 分子空间结构的理论分析-2020-2021学年高二化学课时同步练(鲁科2019选择性必修2)河南省汤阴县五一中学2019-2020学年高二下学期期中考试化学试题宁夏青铜峡市高级中学2020-2021学年高二下学期第一次月考化学试题河南省开封市五县2020-2021学年高二下学期月考化学试题(已下线)2.2.2 杂化轨道理论简介-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)(已下线)2.2.2 杂化轨道理论(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)2.2.2 杂化轨道理论-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)课中-1.1.2 有机化合物中的共价键和有机化合物的同分异构现象-人教2019选择性必修3云南省楚雄彝族自治州民族中学2021-2022学年高二下学期3月月考化学试题陕西省宝鸡市长岭中学2021-2022学年高二下学期期中考试化学试题北京交通大学附属中学2020-2021学年高二下学期期末考试化学试题安徽省滁州市定远县育才学校2021-2022学年高二分层班下学期期中考试化学试题山东省菏泽市单县二中2021-2022学年高二下学期开学考试 化学试题四川省宜宾市南溪区第二中学校2021-2022学年高二上学期12月月考化学试题2.2.2 杂化轨道理论-随堂练习(已下线)猜想02 分子结构与性质【考题猜想】)(9大题型)-2023-2024学年高二化学下学期期末考点大串讲(人教版2019)(已下线)题型02 分子的空间构型及杂化类型的判断-备战2023-2024学年高二化学下学期期末真题分类汇编(辽宁、黑龙江、吉林专用)
名校
解题方法
10 . 金属钛(Ti)及化合物在化工、医药、材料等领域具有广泛应用。回答下列问题:
(1)Li4Ti5O12是电池的电极材料。与Li不同族但性质相似的元素是___________ ,其电子占据最高能级的电子云轮廓图是___________
(2)K与Ti位于同一周期,K和Ti的第一电离能(I1)较大的是___________ ,它们的第二电离能(I2)分别为3051kJ/mol、1310kJ/mol,其原因是___________ 。
(3)钛与卤素形成的化合物TiX4熔点如下表
它们熔点差异的原因___________
(4)Ti(IV)的某配合物可用于催化环烯烃聚合,其结构如图所示,该配合物中:Ti的配位数为___________ ,与Ti形成配位键的元素是___________ ,碳碳键类型是___________ ;所含非金属元素的含氧酸根离子中心原子杂化轨道类型是sp2的是___________ 、立体构型是V形的是___________
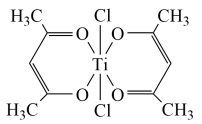
(5)已知N与Ti形成的化合物的晶胞结构如图所示,晶胞中Ti原子与N原子的最近距离为apm;晶胞的密度为p=___________ g/cm3(阿伏加德罗常数值为NA,N、Ti的相对原子质量分别用Ar(N)和Ar(Ti)表示)

(1)Li4Ti5O12是电池的电极材料。与Li不同族但性质相似的元素是
(2)K与Ti位于同一周期,K和Ti的第一电离能(I1)较大的是
(3)钛与卤素形成的化合物TiX4熔点如下表
| TiX4 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点℃ | 377 | -24 | 38.3 | 153 |
(4)Ti(IV)的某配合物可用于催化环烯烃聚合,其结构如图所示,该配合物中:Ti的配位数为

(5)已知N与Ti形成的化合物的晶胞结构如图所示,晶胞中Ti原子与N原子的最近距离为apm;晶胞的密度为p=

您最近一年使用:0次
2021-12-11更新
|
1037次组卷
|
6卷引用:内蒙古自治区霍林郭勒市第一中学2022-203学年高三上学期9月月考化学试题
内蒙古自治区霍林郭勒市第一中学2022-203学年高三上学期9月月考化学试题四川省达州市2021-2022学年高三上学期第一次诊断考试理科综合化学试题(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)四川省达州市普通高中2022届高三第一次诊断性测试理综化学试题广东省韶关市武江区广东北江实验中学2021-2022学年高三下学期适应性考试(四)化学试题宁夏银川市唐徕中学2022-2023学年高二下学期期中考试化学试题



