名校
1 . 锌在生产生活中应用广泛,同时,锌也是人体必需的微量元素之一,起着极其重要的作用。
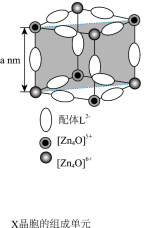
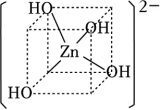
(1)配位化合物X由配体L2-(如图)和具有正四面体结构的[Zn4O]6+构成。_______ 。
②L2-所含元素中,第一电离能从小到大的顺序为_______ ;每个L2-中采取sp2杂化的C原子数目为_______ 个。
③X晶体内部空腔可吸附小分子,要增强X与H2O的吸附作用,可在L2-上引入_______ 。(假设X晶胞形状不变)。
A.-Cl B.-OH C.-NH2 D.-CH3
④X晶体具有面心立方结构,其晶胞由8个结构相似的组成单元(如图)构成。_______ g•cm-3(列出化简的计算式)。
(2)复兴号高铁车体材质用到Zn、Co等元素,已知r(Co2+) =65 pm,r(Zn2+) =74 pm,推测ZnCO3比CoCO3的分解温度_______ (填“高”或“低”),解释原因:_______ 。
(3)H3PO3和H3AsO3的形式一样,但酸性强弱相差很大。已知H3PO3为中强酸,H3AsO3为弱酸,试推断H3PO3和H3AsO3的分子结构_______ 。
(1)配位化合物X由配体L2-(如图)和具有正四面体结构的[Zn4O]6+构成。

②L2-所含元素中,第一电离能从小到大的顺序为
③X晶体内部空腔可吸附小分子,要增强X与H2O的吸附作用,可在L2-上引入
A.-Cl B.-OH C.-NH2 D.-CH3
④X晶体具有面心立方结构,其晶胞由8个结构相似的组成单元(如图)构成。
(2)复兴号高铁车体材质用到Zn、Co等元素,已知r(Co2+) =65 pm,r(Zn2+) =74 pm,推测ZnCO3比CoCO3的分解温度
(3)H3PO3和H3AsO3的形式一样,但酸性强弱相差很大。已知H3PO3为中强酸,H3AsO3为弱酸,试推断H3PO3和H3AsO3的分子结构
您最近一年使用:0次
名校
解题方法
2 . Si、S、Se在自然界中形成多种多样的物质结构。回答下列问题:
(1)Se与O同族,电负性较大的是______ ;基态Se原子的价电子运动状态有____ 种。
(2)已知液态的二氧化硫可以发生类似水的自电离: 。
。 中各原子满足8电子结构,则其
中各原子满足8电子结构,则其 键和
键和 键数目之比为
键数目之比为_______ , 的空间结构为
的空间结构为_______ 。
(3)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物 和
和 的结构如图所示,
的结构如图所示, 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为________ ,二者中更易与 形成配位键的是
形成配位键的是________ 。 熔点(>1700℃)明显高于
熔点(>1700℃)明显高于 (315℃),原因是
(315℃),原因是______ 。
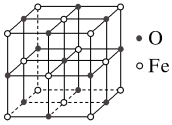
(5)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρ g·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与O2-紧邻且等距离的Fe2+数目为______ ,Fe2+与O2-最短核间距为_____ pm。
(1)Se与O同族,电负性较大的是
(2)已知液态的二氧化硫可以发生类似水的自电离:
 。
。 中各原子满足8电子结构,则其
中各原子满足8电子结构,则其 键和
键和 键数目之比为
键数目之比为 的空间结构为
的空间结构为(3)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物
 和
和 的结构如图所示,
的结构如图所示, 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为 形成配位键的是
形成配位键的是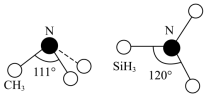
 熔点(>1700℃)明显高于
熔点(>1700℃)明显高于 (315℃),原因是
(315℃),原因是(5)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρ g·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与O2-紧邻且等距离的Fe2+数目为
您最近一年使用:0次
名校
解题方法
3 . 卤素可形成许多结构和性质特殊的化合物。回答下列问题:
(1)-40 ℃时,F2与冰反应生成HOF和HF.常温常压下,HOF为无色气体,固态HOF的晶体类型为___________ ,HOF水解反应的产物为___________ (填化学式)。
(2)ClO2中心原子为Cl,Cl2O中心原子为O,二者均为V形结构,但ClO2中存在大π键_______________________________ ;O—Cl—O键角___________ Cl—O—Cl键角(填“>”“<”或“=”)。比较ClO2与Cl2O中Cl—O键的键长并说明原因___________ 。
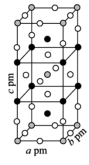
(3)一定条件下,CuCl2、K和F2反应生成KCl和化合物X。已知X属于四方晶系,晶胞结构如图所示(晶胞参数a=b≠c,α=β=γ=90°),其中Cu化合价为+2.上述反应的化学方程式为___________ 。 若阿伏加德罗常数的值为NA,化合物X的密度ρ=___________ g·cm-3(用含NA的代数式表示)。
(1)-40 ℃时,F2与冰反应生成HOF和HF.常温常压下,HOF为无色气体,固态HOF的晶体类型为
(2)ClO2中心原子为Cl,Cl2O中心原子为O,二者均为V形结构,但ClO2中存在大π键
(3)一定条件下,CuCl2、K和F2反应生成KCl和化合物X。已知X属于四方晶系,晶胞结构如图所示(晶胞参数a=b≠c,α=β=γ=90°),其中Cu化合价为+2.上述反应的化学方程式为
您最近一年使用:0次
名校
解题方法
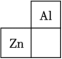
4 . 锌在工业中有重要作用,也是人体必需的微量元素。锌元素在周期表中的位置如图所示。___________ ,其核外电子共占据 ___________ 条轨道。
(2)自然界中共存在五种常见的锌的稳定同位素,其中丰度最高的核素含有34个中子,该核素可以表示为 ___________。
(3)中医典籍中记载了炉甘石(ZnCO3)可用于治疗皮肤炎症或表面创伤。ZnCO3中,负离子的空间构型为 ___________ ,Zn、C、O的电负性由小到大的顺序是 ___________ 。
(4)锌的氢氧化物既能溶于强酸,又能溶于强碱。Zn(OH)2溶于强碱生成[Zn(OH)4]2﹣,结构如图所示。该微粒中OH﹣提供孤电子对,Zn2+提供___________ ,Zn2+的杂化方式为 ___________ 。
解释ZnCl2与ZnBr2熔点存在差异的原因 ___________ 。
(6)ZnF2晶胞如图所示,一个晶胞中含有___________ 个F﹣。若NA表示阿伏加德罗常数的值,则ZnF2晶体(摩尔质量为M)的密度为 ___________ g•cm-3(用含a、c、M、NA的代数式表示)。
(2)自然界中共存在五种常见的锌的稳定同位素,其中丰度最高的核素含有34个中子,该核素可以表示为 ___________。
| A.34Zn | B.34Zn | C.64Zn | D.64Zn |
(4)锌的氢氧化物既能溶于强酸,又能溶于强碱。Zn(OH)2溶于强碱生成[Zn(OH)4]2﹣,结构如图所示。该微粒中OH﹣提供孤电子对,Zn2+提供
| 卤化锌 | ZnCl2 | ZnBr2 |
| 熔点/℃ | 283 | 394 |
(6)ZnF2晶胞如图所示,一个晶胞中含有

您最近一年使用:0次
名校
解题方法
5 . 碳、硅元素及其化合物在生产生活中应用广泛。请回答:
(1)基态硅原子核外电子排布式:_______ 。该基态原子占据最高能级的电子云轮廓图形状为_______ 。
(2)C60晶体采用面心立方堆积,C60晶体中存在的作用力有_______ (填字母)
A.共价键 B.离子键 C.氢键 D.范德华力 E.配位键 F.金属键
(3)与碳的氢化物类似,硅元素的氢化物硅烷的通式为:SinH2n+2。下列有关说法不正确的是_______。
(4)硅酸盐是地壳中的主要成分。硅酸盐的最简单阴离子为SiO ,为硅氧四面体,结构如图1。SiO
,为硅氧四面体,结构如图1。SiO 在溶液中形成的分子形态脱水易形成凝胶状的固体物质—硅胶。硅胶继续脱水,形成了共用氧原子的硅氧四面体骨架—SiO2(硅石)。联系相关信息,解释硅胶转变为硅石后,硬度变大的原因:
在溶液中形成的分子形态脱水易形成凝胶状的固体物质—硅胶。硅胶继续脱水,形成了共用氧原子的硅氧四面体骨架—SiO2(硅石)。联系相关信息,解释硅胶转变为硅石后,硬度变大的原因:_______ 。 ,KCx晶胞结构如图2(碳原子省略),如图3是晶胞沿y轴方向的投影。
,KCx晶胞结构如图2(碳原子省略),如图3是晶胞沿y轴方向的投影。_______ 。
②若石墨层内的大π键可表示为 (上标表示电子总数,下标表示原子数),则平均每个KCx单元中的大π键可表示为
(上标表示电子总数,下标表示原子数),则平均每个KCx单元中的大π键可表示为_______ (用具体的数据表示)。
(6)已知 晶体的密度为ρg· cm-3,其晶胞结构如图所示。阿伏加德罗常数值为NA,则晶胞中两个
晶体的密度为ρg· cm-3,其晶胞结构如图所示。阿伏加德罗常数值为NA,则晶胞中两个 原子之间的距离为
原子之间的距离为_______  。
。
(1)基态硅原子核外电子排布式:
(2)C60晶体采用面心立方堆积,C60晶体中存在的作用力有
A.共价键 B.离子键 C.氢键 D.范德华力 E.配位键 F.金属键
(3)与碳的氢化物类似,硅元素的氢化物硅烷的通式为:SinH2n+2。下列有关说法不正确的是_______。
| A.Si3H8没有同分异构体 |
| B.Si-Si键能比C-C键能小,故热稳定性:SinH2n+2>CnH2n+2 |
| C.SinH2n+2中Si原子杂化方式均为sp3 |
| D.SinH2n+2可与水反应生成氢气 |
 ,为硅氧四面体,结构如图1。SiO
,为硅氧四面体,结构如图1。SiO 在溶液中形成的分子形态脱水易形成凝胶状的固体物质—硅胶。硅胶继续脱水,形成了共用氧原子的硅氧四面体骨架—SiO2(硅石)。联系相关信息,解释硅胶转变为硅石后,硬度变大的原因:
在溶液中形成的分子形态脱水易形成凝胶状的固体物质—硅胶。硅胶继续脱水,形成了共用氧原子的硅氧四面体骨架—SiO2(硅石)。联系相关信息,解释硅胶转变为硅石后,硬度变大的原因: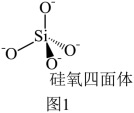
 ,KCx晶胞结构如图2(碳原子省略),如图3是晶胞沿y轴方向的投影。
,KCx晶胞结构如图2(碳原子省略),如图3是晶胞沿y轴方向的投影。
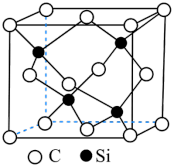
②若石墨层内的大π键可表示为
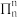 (上标表示电子总数,下标表示原子数),则平均每个KCx单元中的大π键可表示为
(上标表示电子总数,下标表示原子数),则平均每个KCx单元中的大π键可表示为(6)已知
 晶体的密度为ρg· cm-3,其晶胞结构如图所示。阿伏加德罗常数值为NA,则晶胞中两个
晶体的密度为ρg· cm-3,其晶胞结构如图所示。阿伏加德罗常数值为NA,则晶胞中两个 原子之间的距离为
原子之间的距离为 。
。
您最近一年使用:0次
名校
解题方法
6 . 铬是人体内微量元素之一,是重要的血糖调节剂。
(1)铬在元素周期表中的位置为___________ ,其基态原子核外电子占据的原子轨道数为___________ 。
(2)已知 半径小,正电场较强,容易与
半径小,正电场较强,容易与 、
、 、
、 等分子或离子形成多种配合物,
等分子或离子形成多种配合物, 是其中的一种。
是其中的一种。
①该配合物中提供孤电子对形成配位键的原子是___________ 。
②配体中中心原子的杂化方式为___________ (填字母)。
a. b.
b. c.sp d.
c.sp d.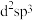
③该物质中, 的键角比独立存在的气态氨气分子中键角略大,其原因是
的键角比独立存在的气态氨气分子中键角略大,其原因是___________ 。
(3)钛铬合金是一种高温结构材料,第二电离能
___________ (填“ ”或“
”或“ ”)
”)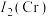 ,原因是
,原因是___________ 。
(4)铬的一种氮化物晶体立方晶胞结构如图所示,A点分数坐标为 ,则B点分数坐标为
,则B点分数坐标为___________ ,已知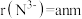 ,
,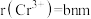 ,则AB间距离为
,则AB间距离为___________ nm。
(1)铬在元素周期表中的位置为
(2)已知
 半径小,正电场较强,容易与
半径小,正电场较强,容易与 、
、 、
、 等分子或离子形成多种配合物,
等分子或离子形成多种配合物, 是其中的一种。
是其中的一种。①该配合物中提供孤电子对形成配位键的原子是
②配体中中心原子的杂化方式为
a.
 b.
b. c.sp d.
c.sp d.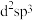
③该物质中,
 的键角比独立存在的气态氨气分子中键角略大,其原因是
的键角比独立存在的气态氨气分子中键角略大,其原因是(3)钛铬合金是一种高温结构材料,第二电离能

 ”或“
”或“ ”)
”)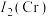 ,原因是
,原因是(4)铬的一种氮化物晶体立方晶胞结构如图所示,A点分数坐标为
 ,则B点分数坐标为
,则B点分数坐标为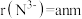 ,
,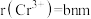 ,则AB间距离为
,则AB间距离为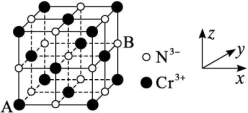
您最近一年使用:0次
解题方法
7 . 我国在新材料领域研究的重大突破,为“天宫”空间站的建设提供了坚实的物质基础。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是___________ (填标号,下同),用光谱仪可捕捉到发射光谱的是___________ 。 中心原子为
中心原子为 ,
, 中心原子为O,二者均为V形结构,但
中心原子为O,二者均为V形结构,但 中存在大
中存在大 键(
键( )。
)。 中
中 原子的轨道杂化方式为
原子的轨道杂化方式为___________ ; 键角
键角___________ 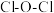 键角(填“>”“<”或“=”)。
键角(填“>”“<”或“=”)。
(3)镍能形成多种配合物,其中 是无色挥发性液体,
是无色挥发性液体,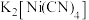 是红黄色单斜晶体。
是红黄色单斜晶体。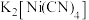 的熔点高于
的熔点高于 的原因是
的原因是___________ 。
(4)水催化氧化是“分子人工光合作用”的关键步骤。水的晶体有普通冰和重冰等不同类型。普通冰的晶胞结构与水分子间的氢键如图甲、乙所示。晶胞参数 ;标注为1、2、3的氧原子在Z轴的分数坐标分别为:
;标注为1、2、3的氧原子在Z轴的分数坐标分别为: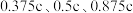 。晶胞中氢键的长度为
。晶胞中氢键的长度为___________  (列出数学表达式,不必计算出结果)。
(列出数学表达式,不必计算出结果)。 是重要的稀土抛光材料,图甲为理想的
是重要的稀土抛光材料,图甲为理想的 的立方晶胞模型,但是几乎不存在完美的晶型,实际晶体中常存在缺陷(如图乙)。
的立方晶胞模型,但是几乎不存在完美的晶型,实际晶体中常存在缺陷(如图乙)。 缺陷晶型中X处原子的分数坐标为(0,0,0),Y处原子的分数坐标为(
缺陷晶型中X处原子的分数坐标为(0,0,0),Y处原子的分数坐标为(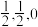 ),则氧空位处原子的分数坐标为
),则氧空位处原子的分数坐标为___________ ,该缺陷晶型的化学式可表示为___________ 。设阿伏加德罗常数的值为 ,
, 理想晶型的密度为
理想晶型的密度为 ,则
,则 原子与O原子的最近距离为
原子与O原子的最近距离为___________  (列出表达式)。
(列出表达式)。
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是
A.  B.
B.
C. D.
D.
 中心原子为
中心原子为 ,
, 中心原子为O,二者均为V形结构,但
中心原子为O,二者均为V形结构,但 中存在大
中存在大 键(
键( )。
)。 中
中 原子的轨道杂化方式为
原子的轨道杂化方式为 键角
键角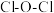 键角(填“>”“<”或“=”)。
键角(填“>”“<”或“=”)。(3)镍能形成多种配合物,其中
 是无色挥发性液体,
是无色挥发性液体,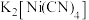 是红黄色单斜晶体。
是红黄色单斜晶体。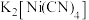 的熔点高于
的熔点高于 的原因是
的原因是(4)水催化氧化是“分子人工光合作用”的关键步骤。水的晶体有普通冰和重冰等不同类型。普通冰的晶胞结构与水分子间的氢键如图甲、乙所示。晶胞参数
 ;标注为1、2、3的氧原子在Z轴的分数坐标分别为:
;标注为1、2、3的氧原子在Z轴的分数坐标分别为: 。晶胞中氢键的长度为
。晶胞中氢键的长度为 (列出数学表达式,不必计算出结果)。
(列出数学表达式,不必计算出结果)。
 是重要的稀土抛光材料,图甲为理想的
是重要的稀土抛光材料,图甲为理想的 的立方晶胞模型,但是几乎不存在完美的晶型,实际晶体中常存在缺陷(如图乙)。
的立方晶胞模型,但是几乎不存在完美的晶型,实际晶体中常存在缺陷(如图乙)。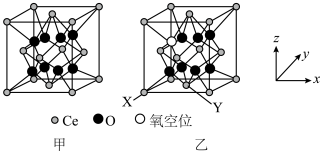
 缺陷晶型中X处原子的分数坐标为(0,0,0),Y处原子的分数坐标为(
缺陷晶型中X处原子的分数坐标为(0,0,0),Y处原子的分数坐标为(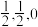 ),则氧空位处原子的分数坐标为
),则氧空位处原子的分数坐标为 ,
, 理想晶型的密度为
理想晶型的密度为 ,则
,则 原子与O原子的最近距离为
原子与O原子的最近距离为 (列出表达式)。
(列出表达式)。
您最近一年使用:0次
名校
8 . 铜及其化合物在生活、生产中用途广泛。以黄铜矿为原料冶炼铜涉及多个反应,其中一个反应为
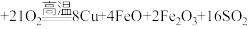 。回答下列问题:
。回答下列问题:
(1)基态铜原子的价层电子的轨道表示式(电子排布图)为___________ ,基态铜原子核外电子的空间运动状态(原子轨道)有___________ 种。
(2)高温下CuO能转化为 的原因是
的原因是___________ (从原子结构角度分析)。
(3) 、
、 、
、 、
、 四种含硫微粒中,中心原子为
四种含硫微粒中,中心原子为 杂化的是
杂化的是___________ ,属于极性分子的是___________ 。
(4) 、FeO的熔点是下列两个数值中的一个:1360℃、1565℃。
、FeO的熔点是下列两个数值中的一个:1360℃、1565℃。 、FeO两种氧化物的晶体类型都是
、FeO两种氧化物的晶体类型都是___________ ,1360℃是___________ 的熔点。
(5) 晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(硫原子)的分数坐标为
晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(硫原子)的分数坐标为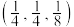 ,则原子2(铁原子)的分数坐标为
,则原子2(铁原子)的分数坐标为___________ 。晶胞参数分别为a pm,a pm、2a pm, 晶体的密度为
晶体的密度为___________  (列出计算表达式,设阿伏加德罗常数的值为
(列出计算表达式,设阿伏加德罗常数的值为 )。
)。

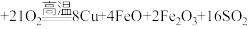 。回答下列问题:
。回答下列问题:(1)基态铜原子的价层电子的轨道表示式(电子排布图)为
(2)高温下CuO能转化为
 的原因是
的原因是(3)
 、
、 、
、 、
、 四种含硫微粒中,中心原子为
四种含硫微粒中,中心原子为 杂化的是
杂化的是(4)
 、FeO的熔点是下列两个数值中的一个:1360℃、1565℃。
、FeO的熔点是下列两个数值中的一个:1360℃、1565℃。 、FeO两种氧化物的晶体类型都是
、FeO两种氧化物的晶体类型都是(5)
 晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(硫原子)的分数坐标为
晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(硫原子)的分数坐标为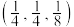 ,则原子2(铁原子)的分数坐标为
,则原子2(铁原子)的分数坐标为 晶体的密度为
晶体的密度为 (列出计算表达式,设阿伏加德罗常数的值为
(列出计算表达式,设阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
名校
解题方法
9 . 钛硅分子筛是一种新型固体催化剂,可催化合成重要有机合成活性试剂甲乙酮肟(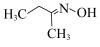 )。回答下列问题:
)。回答下列问题:
(2)甲乙酮肟中同周期三种元素电负性由大到小的顺序为
(3)TiO2和TiCl4均是制备钛硅分子筛的重要中间体。
①TiO2与光气COCl2反应可用于制取四氯化钛。COCl2中σ键和π键的数目比为
②TiCl4与金属Ti在高温条件下可反应生成TiCl3,TiCl3中Ti3+极易被氧化,还原性很强。试解释Ti3+还原性强的原因
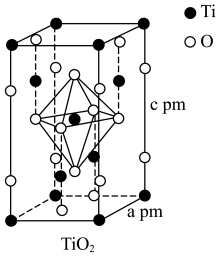
(4)TiO2晶胞如图所示,若其晶体密度为ρg·cm-3,则阿伏加德罗常数的值NA=
您最近一年使用:0次
名校
解题方法
10 . 科技强国,我国科学家在诸多领域取得新突破。
(1)芯片制造会经过六个最为关键的步骤:沉积、光刻胶涂覆、光刻、刻蚀、离子注入和封装。其中“刻蚀”过程可能用到刻蚀剂 、
、 及清洗剂
及清洗剂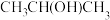 。
。
①基态F原子核外电子有_____ 种空间运动状态,下列为氟原子激发态的电子排布式的是_____ (填标号)。
A. B.
B. C.
C. D.
D.
②C、N、O、F四种元素的第一电离能由大到小的顺序为__________ 。
③氟硼酸铵( )中B的杂化方式为
)中B的杂化方式为__________ , 的空间构型为
的空间构型为__________ 。
(2)复兴号高铁车体材质用到了Mn、Co等元素。Mn的一种配合物的化学式为[Mn(CO)5(CH3CN)],CH3CN与Mn原子配位时,提供孤电子对的是__________ (填元素符号),Mn原子的配位数为__________ ,CH3CN中 键与
键与 键数目之比为
键数目之比为__________ 。
(3)超导材料 具有
具有 型结构(如图),晶胞参数(晶胞边长)为a pm,该氮化钛晶体的密度为
型结构(如图),晶胞参数(晶胞边长)为a pm,该氮化钛晶体的密度为__________ (列出计算式即可) 。
。
(1)芯片制造会经过六个最为关键的步骤:沉积、光刻胶涂覆、光刻、刻蚀、离子注入和封装。其中“刻蚀”过程可能用到刻蚀剂
 、
、 及清洗剂
及清洗剂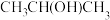 。
。①基态F原子核外电子有
A.
 B.
B. C.
C. D.
D.
②C、N、O、F四种元素的第一电离能由大到小的顺序为
③氟硼酸铵(
 )中B的杂化方式为
)中B的杂化方式为 的空间构型为
的空间构型为(2)复兴号高铁车体材质用到了Mn、Co等元素。Mn的一种配合物的化学式为[Mn(CO)5(CH3CN)],CH3CN与Mn原子配位时,提供孤电子对的是
 键与
键与 键数目之比为
键数目之比为(3)超导材料
 具有
具有 型结构(如图),晶胞参数(晶胞边长)为a pm,该氮化钛晶体的密度为
型结构(如图),晶胞参数(晶胞边长)为a pm,该氮化钛晶体的密度为 。
。
您最近一年使用:0次
2024-04-11更新
|
325次组卷
|
6卷引用:2024届宁夏回族自治区石嘴山市平罗中学高三下学期模拟预测理综试题-高中化学
2024届宁夏回族自治区石嘴山市平罗中学高三下学期模拟预测理综试题-高中化学2024届内蒙古锡林郭勒盟高三第三次模拟考试理综试卷-高中化学(已下线)化学(上海卷03)-2024年高考押题预测卷2024届青海省部分学校高三下学期模拟考试理综试题-高中化学(已下线)T16-结构与性质四川省雅安市2023-2024学年高三下学期4月月考理综试题-高中化学



