1 . 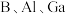 处于同一主族,相关化合物应用广泛。
处于同一主族,相关化合物应用广泛。
(1)基态 原子的简化电子排布式是
原子的简化电子排布式是___________ 。
(2)下列说法不正确 的是___________ 。
A. 是含有极性键的非极性分子
是含有极性键的非极性分子
B. 原子由
原子由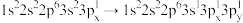 能形成原子发射光谱
能形成原子发射光谱
C.硼氢化钠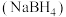 中元素电负性大小依次为
中元素电负性大小依次为
D.键的极性: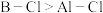
(3)硼酸 为一元弱酸,晶体结构为层状,其二维平面结构如图所示:
为一元弱酸,晶体结构为层状,其二维平面结构如图所示: 硼酸晶体中存在
硼酸晶体中存在___________  氢键。
氢键。
②硼酸晶体在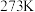 时溶解度为
时溶解度为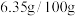 水,加热至
水,加热至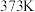 时,溶解度增大至
时,溶解度增大至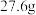 ,加热时溶解度增大的原因可能是
,加热时溶解度增大的原因可能是___________ 。
③已知常温下, 在水中存在平衡:
在水中存在平衡: 。硼砂的化学式为
。硼砂的化学式为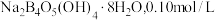 的硼砂溶液中,
的硼砂溶液中, 水解生成等物质的量浓度的
水解生成等物质的量浓度的 和
和 ,该溶液的
,该溶液的
___________ , 中硼原子的杂化轨道类型是
中硼原子的杂化轨道类型是___________ 。
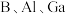 处于同一主族,相关化合物应用广泛。
处于同一主族,相关化合物应用广泛。(1)基态
 原子的简化电子排布式是
原子的简化电子排布式是(2)下列说法
A.
 是含有极性键的非极性分子
是含有极性键的非极性分子B.
 原子由
原子由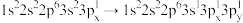 能形成原子发射光谱
能形成原子发射光谱C.硼氢化钠
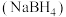 中元素电负性大小依次为
中元素电负性大小依次为
D.键的极性:
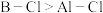
(3)硼酸
 为一元弱酸,晶体结构为层状,其二维平面结构如图所示:
为一元弱酸,晶体结构为层状,其二维平面结构如图所示: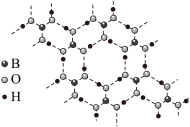
 硼酸晶体中存在
硼酸晶体中存在 氢键。
氢键。②硼酸晶体在
 时溶解度为
时溶解度为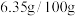 水,加热至
水,加热至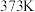 时,溶解度增大至
时,溶解度增大至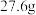 ,加热时溶解度增大的原因可能是
,加热时溶解度增大的原因可能是③已知常温下,
 在水中存在平衡:
在水中存在平衡: 。硼砂的化学式为
。硼砂的化学式为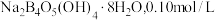 的硼砂溶液中,
的硼砂溶液中, 水解生成等物质的量浓度的
水解生成等物质的量浓度的 和
和 ,该溶液的
,该溶液的
 中硼原子的杂化轨道类型是
中硼原子的杂化轨道类型是
您最近一年使用:0次
2024-02-23更新
|
128次组卷
|
2卷引用:内蒙古通辽市科尔沁左翼中旗实验高级中学2023-2024学年高三下学期4月月考理综试题-高中化学
解题方法
2 . 铬及其化合物被广泛应用于冶金、化工、铸铁、耐火及高科技等领域。
(1)基态铬原子的价电子排布式为_______ 。
(2)CrO2Cl2是重要的氯化剂。制备CrO2Cl2的反应为K2Cr2O7+3CC14=2KC1+2CrO2Cl2+3COCl2↑。
①COCl2中C、O和Cl元素的电负性由大到小的顺序是________ (用元素符号表示)。
②CrO2Cl2常温下为深红色液体,能与 CC14、CS2等互溶,据此可判断CrO2Cl2分子空间构型是_______ 。(填“平面四边形”或“四面体形”)。
(3)三价铬丙二酸配合物具有优良的催化性能,其中阴离子的结构如图甲所示:

①阴离子中碳原子的杂化轨道类型是______ ,中心铬的配位数为_______ 。
②在丙二酸根与Cr3+配位时,配位原子为1号氧而不是2号氧的原因是___________ 。
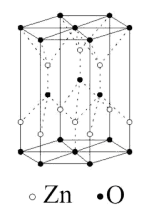
(4)Cr—N系列涂层具有良好的耐磨和耐腐蚀性。某氮化铬的晶胞结构与氯化钠的相同,已知N原子在晶胞中的位置如图乙所示:
①下列为晶胞中 Cr 原子沿x轴方向的投影的是______ (填字母)。
a.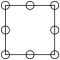 b.
b. 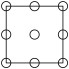 c.
c. 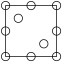 d.
d.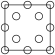
②晶胞中 N 原子的坐标是 A(0,0,0),B( ,
, ,0),则距A和B最近的 Cr 原子的坐标是
,0),则距A和B最近的 Cr 原子的坐标是_______ 。
(1)基态铬原子的价电子排布式为
(2)CrO2Cl2是重要的氯化剂。制备CrO2Cl2的反应为K2Cr2O7+3CC14=2KC1+2CrO2Cl2+3COCl2↑。
①COCl2中C、O和Cl元素的电负性由大到小的顺序是
②CrO2Cl2常温下为深红色液体,能与 CC14、CS2等互溶,据此可判断CrO2Cl2分子空间构型是
(3)三价铬丙二酸配合物具有优良的催化性能,其中阴离子的结构如图甲所示:

①阴离子中碳原子的杂化轨道类型是
②在丙二酸根与Cr3+配位时,配位原子为1号氧而不是2号氧的原因是
(4)Cr—N系列涂层具有良好的耐磨和耐腐蚀性。某氮化铬的晶胞结构与氯化钠的相同,已知N原子在晶胞中的位置如图乙所示:
①下列为晶胞中 Cr 原子沿x轴方向的投影的是
a.
 b.
b.  c.
c.  d.
d.
②晶胞中 N 原子的坐标是 A(0,0,0),B(
 ,
, ,0),则距A和B最近的 Cr 原子的坐标是
,0),则距A和B最近的 Cr 原子的坐标是
您最近一年使用:0次
名校
解题方法
3 . 碳族元素的单质和化合物在化工、医药、材料等领域有着广泛的应用。
(1)锗是重要半导体材料,基态Ge原子中,核外电子占据的最高能级是___________ ,该能级的电子云轮廓图为___________ 。Ge与C同族,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键,从原子结构角度分析,原因是_______________________________ 。
(2)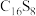 是新型环烯类储氢材料,研究证明其分子呈平面结构(如图所示)。
是新型环烯类储氢材料,研究证明其分子呈平面结构(如图所示)。

①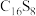 分子中C原子和S原子的杂化轨道类型分别为
分子中C原子和S原子的杂化轨道类型分别为_______________ 。
②测得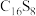 中碳硫键的键长介于C─S和C=S之间,其原因可能是
中碳硫键的键长介于C─S和C=S之间,其原因可能是_______________ 。
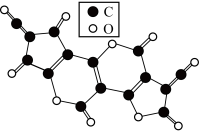
(3)X是碳的一种氧化物,X的五聚合体结构如图所示。X分子中每个原子都满足最外层8电子结构,X分子的电子式为___________ 。X分子中碳碳键的夹角为___________ 。
(4)有机卤化铅晶体具有独特的光电性能,图为其晶胞结构示意图。
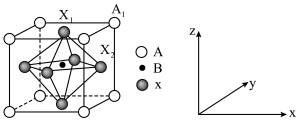
A为 ,B为
,B为 ,X为
,X为
①若该晶胞的边长为a ,则最近的两个
,则最近的两个 中心间的距离是
中心间的距离是__________ 。
②在该晶胞的另一种表达方式中,若图中 处于顶点位置,则
处于顶点位置,则 处于
处于__________ 位置。原子坐标参数B为 ;
; 为
为 ,则
,则 为
为__________ 。
(1)锗是重要半导体材料,基态Ge原子中,核外电子占据的最高能级是
(2)
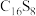 是新型环烯类储氢材料,研究证明其分子呈平面结构(如图所示)。
是新型环烯类储氢材料,研究证明其分子呈平面结构(如图所示)。
①
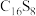 分子中C原子和S原子的杂化轨道类型分别为
分子中C原子和S原子的杂化轨道类型分别为②测得
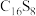 中碳硫键的键长介于C─S和C=S之间,其原因可能是
中碳硫键的键长介于C─S和C=S之间,其原因可能是(3)X是碳的一种氧化物,X的五聚合体结构如图所示。X分子中每个原子都满足最外层8电子结构,X分子的电子式为

(4)有机卤化铅晶体具有独特的光电性能,图为其晶胞结构示意图。

A为
 ,B为
,B为 ,X为
,X为
①若该晶胞的边长为a
 ,则最近的两个
,则最近的两个 中心间的距离是
中心间的距离是②在该晶胞的另一种表达方式中,若图中
 处于顶点位置,则
处于顶点位置,则 处于
处于 ;
; 为
为 ,则
,则 为
为
您最近一年使用:0次
名校
解题方法
4 . 完成下列问题。
(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、 (PAN)等二次污染物。
(PAN)等二次污染物。
①PAN中除H外其余三种元素的第一电离能由大到小的顺序为___________ 。1molPAN中含有的σ键数目为___________ 。
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中中心离子的配位数为_________ ,中心离子的外围电子排布图___________ 。
③相同压强下,HCOOH的沸点比CH3OCH3___________ (填高或低),其原因是___________ 。
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
①(NH4)2SO4晶体中各种微粒间的作用力不涉及___________ (填序号)。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
②NH4NO3中阳离子的中心原子轨道采用___________ 杂化,阴离子的空间构型为___________ 。
(3)测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则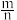 =
=___________ (填数字)。已知:该晶胞边长为bpm,NA代表阿伏伽德罗常数,则该晶体的密度为___________ g/cm3(写出计算式即可)。

(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、
 (PAN)等二次污染物。
(PAN)等二次污染物。①PAN中除H外其余三种元素的第一电离能由大到小的顺序为
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中中心离子的配位数为
③相同压强下,HCOOH的沸点比CH3OCH3
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
①(NH4)2SO4晶体中各种微粒间的作用力不涉及
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
②NH4NO3中阳离子的中心原子轨道采用
(3)测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则
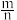 =
=
您最近一年使用:0次
2023-11-21更新
|
125次组卷
|
2卷引用:内蒙古赤峰二中2023-2024学年高三上学期10月月考化学试题
解题方法
5 . 钙钛矿型材料具有与天然钙矿( )相同的晶体结构,其化学通式为ABX3
)相同的晶体结构,其化学通式为ABX3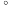 通过元素的替换和掺杂,可以调控钙钛矿型材料的催化性能。
通过元素的替换和掺杂,可以调控钙钛矿型材料的催化性能。
(1)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是___________ 。
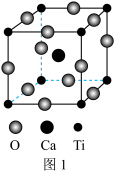
(2)CaTiO3的晶胞如图1所示,其组成元素的电负性大小顺序是___________ ;与每个Ti4+距离最近且相等的 的个数为
的个数为___________ ;金属离子与氧离子间的作用力为___________ ,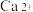 的配位数是
的配位数是___________ 。
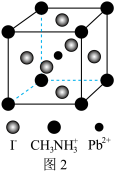
(3)一种立方钙钛矿结构的金属卤化物光电材料的组成为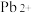 、I-和有机碱离子
、I-和有机碱离子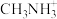
 其晶胞如图2所示。其中
其晶胞如图2所示。其中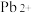 与图1中
与图1中___________ 的空间位置相同,有机碱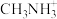 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是___________ ;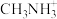 与
与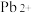 是否形成配位键?
是否形成配位键?___________ 。为什么?___________ 。若晶胞参数为anm,则晶体密度为___________ g∙cm−3(列出计算式)。
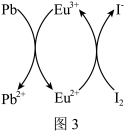
(4)用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了器件效率和使用寿命,我国科学家巧妙地在此材料中引入稀土铕(Eu)盐,提升了太阳能电池的效率和使用寿命,其作用原理如图3所示,用离子方程式表示该原理:___________ 。
 )相同的晶体结构,其化学通式为ABX3
)相同的晶体结构,其化学通式为ABX3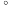 通过元素的替换和掺杂,可以调控钙钛矿型材料的催化性能。
通过元素的替换和掺杂,可以调控钙钛矿型材料的催化性能。(1)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | -2412 | 38.3 | 155 |
 的个数为
的个数为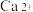 的配位数是
的配位数是
(3)一种立方钙钛矿结构的金属卤化物光电材料的组成为
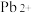 、I-和有机碱离子
、I-和有机碱离子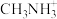
 其晶胞如图2所示。其中
其晶胞如图2所示。其中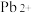 与图1中
与图1中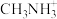 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是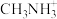 与
与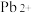 是否形成配位键?
是否形成配位键?
(4)用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了器件效率和使用寿命,我国科学家巧妙地在此材料中引入稀土铕(Eu)盐,提升了太阳能电池的效率和使用寿命,其作用原理如图3所示,用离子方程式表示该原理:

您最近一年使用:0次
名校
解题方法
6 . 2022年春晚中舞蹈诗剧《只此青绿》生动还原了北宋名画《千里江山图》,画之所以色彩艳丽,璀璨夺目,与所使用矿物颜料有关。回答下列问题:
(1)石青,又名蓝矿石,化学式为Cu3(CO3)2(OH)2,基态Cu2+核外电子的空间运动状态有_____ 种,CO 的空间构型为
的空间构型为_____ 。原子中电子有两种相反的自旋状态,分别用+ 和-
和- 表示,称为电子的自旋磁量子数,则Cu2+中电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则Cu2+中电子自旋磁量子数的代数和为_____ 。
(2)亚铁氰化钾,化学式为K4[Fe(CN)6],呈黄色结晶性粉末。[Fe(CN)6]4-中配体CN-的配位原子是_____ (填元素符号),与CN-互为等电子体的分子______ ,[Fe(CN)6]4-中σ键和π键的数目之比为_____ 。
(3)Cu2S呈黑色或灰黑色,已知:晶胞中S2-的位置如图1所示,Cu+位于S2-所构成的四面体中心,晶胞的侧视图如图2所示。
Cu+填充了晶胞中四面体空隙的百分率是_____ ,S2-配位数为______ 。已知图1中A原子的原子分数坐标为(0,0,0),则与A原子距离最近的Cu+的原子分数坐标为______ 。若晶胞参数为anm,晶体的密度为dg/cm3,则阿伏加德罗常数的值为______ (用含a和d的代数式表示)。
(1)石青,又名蓝矿石,化学式为Cu3(CO3)2(OH)2,基态Cu2+核外电子的空间运动状态有
 的空间构型为
的空间构型为 和-
和- 表示,称为电子的自旋磁量子数,则Cu2+中电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则Cu2+中电子自旋磁量子数的代数和为(2)亚铁氰化钾,化学式为K4[Fe(CN)6],呈黄色结晶性粉末。[Fe(CN)6]4-中配体CN-的配位原子是
(3)Cu2S呈黑色或灰黑色,已知:晶胞中S2-的位置如图1所示,Cu+位于S2-所构成的四面体中心,晶胞的侧视图如图2所示。

Cu+填充了晶胞中四面体空隙的百分率是
您最近一年使用:0次
2023-05-03更新
|
164次组卷
|
2卷引用:内蒙古赤峰市2022-2023学年高三上学期期末模拟考试化学试题
解题方法
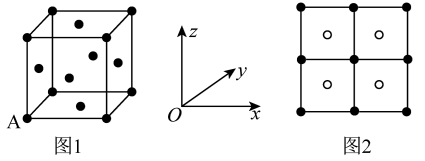
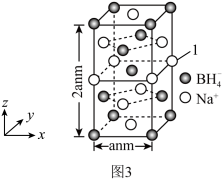
7 . 硼及其化合物在材料制造、有机合成等方面用途非常广泛,硼的一些化合物表现出缺电子特征。回答下列问题:
(1)基态硼原子的电子排布式为_______ ;B和Al的第一电离能I1(B)_______ I1(Al)(填“>”或“=”或“<”)。
(2)H3BO3(层状结构)的结构示意图如下,在硼酸的层状结构中O的杂化类型是_______ ,层内存在的作用力有_______ 。硼酸显弱酸性与[B(OH)4]-配离子有关,硼酸的电离方程式:_______ 。

(3)自然界中不存在单质硼,硼的氢化物也很少,主要存在的是硼的含氧化合物,根据表中数据分析其原因是_______ 。
(4)已知晶体硼的熔、沸点及硬度数据和基本结构单元(由硼原子组成的正二十面体如图1所示,每个三角形均为正三角形,每个顶点为一个硼原子)如下:

①晶体硼属于原子(共价)晶体,其理由是_______ 。
②每一个硼基本单元由_______ 个原子组成;
③碳化硼,别名黑钻石,是已知最坚硬的三种材料之一,仅次于金刚石和立方氮化硼,图2为碳化硼晶胞,其化学式为_______ ;
(5)硼氢化钠是一种常用的还原剂。其晶胞结构如图3所示,标注为“1”的Na+坐标参数为_______ 。已知NA代表阿伏加德罗常数的值,则硼氢化钠晶体的密度为ρ=_______ g·cm-3(用含NA的代数式表示)。
(1)基态硼原子的电子排布式为
(2)H3BO3(层状结构)的结构示意图如下,在硼酸的层状结构中O的杂化类型是

(3)自然界中不存在单质硼,硼的氢化物也很少,主要存在的是硼的含氧化合物,根据表中数据分析其原因是
| 化学键 | B-H | B-O | B-B |
| 键能(kJ·mol-1) | 389 | 561 | 293 |
| 晶体 | 金刚石 | 晶体硅 | 晶体硼 |
| 熔点(K) | 3832 | 1683 | 2573 |
| 沸点(K) | 5100 | 2628 | 3823 |
| 硬度 | 10 | 7.0 | 9.6 |

①晶体硼属于原子(共价)晶体,其理由是
②每一个硼基本单元由
③碳化硼,别名黑钻石,是已知最坚硬的三种材料之一,仅次于金刚石和立方氮化硼,图2为碳化硼晶胞,其化学式为
(5)硼氢化钠是一种常用的还原剂。其晶胞结构如图3所示,标注为“1”的Na+坐标参数为

您最近一年使用:0次
2023-03-12更新
|
754次组卷
|
3卷引用:内蒙古呼和浩特市2023届高三第一次质量数据监测理科综合化学试题
名校
解题方法
8 . Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为____ 。
A. B.
B.
C.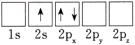 D.
D.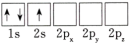
(2)Li+与H-具有相同的电子构型,但r(Li+)小于r(H-),原因是____ 。
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是____ ,中心原子的杂化形式为____ 。LiAlH4中,存在下列给出的____ 。
A.离子键 B.σ键 C.π键 D.氢键
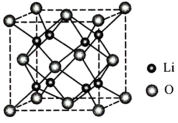
(4)Li2O是离子晶体,其晶格能可通过图中的循环计算得到,由数据可知Li原子的第一电离能为____ kJ/mol,O=O键能为____ kJ/mol,Li2O晶格能为____ kJ/mol。
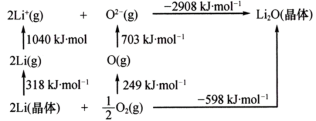
(5)Li2O具有反萤石结构,晶胞如图所示。已知晶胞参数为anm,阿伏加德罗常数的值为NA,则Li2O的密度为____ g•cm-3(列出计算式即可)。
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为
A.
 B.
B.
C.
 D.
D.
(2)Li+与H-具有相同的电子构型,但r(Li+)小于r(H-),原因是
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是
A.离子键 B.σ键 C.π键 D.氢键
(4)Li2O是离子晶体,其晶格能可通过图中的循环计算得到,由数据可知Li原子的第一电离能为
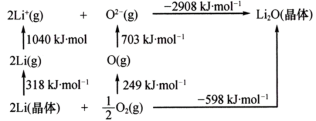
(5)Li2O具有反萤石结构,晶胞如图所示。已知晶胞参数为anm,阿伏加德罗常数的值为NA,则Li2O的密度为

您最近一年使用:0次
2022-09-19更新
|
159次组卷
|
2卷引用:内蒙古达拉特旗第一中学2022-2023学年高三上学期开学考试理综化学试题
解题方法
9 . 芳香胺是多种染料产品的中间体,也是农药、除草剂和多种橡胶防老剂的主要原料。
I.制备 萘胺:
萘胺:
(1)溶剂 的结构简式为
的结构简式为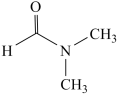 ,则
,则 中碳原子的杂化类型有
中碳原子的杂化类型有____________ ,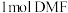 中所含有的
中所含有的 键数目为
键数目为____________ ,分子中第一电离能最大的元素是____________ (填元素符号)。
(2)萘胺的水溶性比硝基萘的强,原因是____________ 。
Ⅱ.制备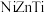 催化剂:向按比例配置的
催化剂:向按比例配置的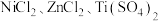 混合溶液中加入碱液,调节
混合溶液中加入碱液,调节 至9~11,使其沉淀。将沉淀分离出来后焙烧并进一步还原,可得最终产物
至9~11,使其沉淀。将沉淀分离出来后焙烧并进一步还原,可得最终产物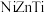 。制备过程中,会生成
。制备过程中,会生成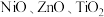 等中间产物。
等中间产物。
(3) 的基态原子价层电子排布式为
的基态原子价层电子排布式为_______________ 。
(4) 的空间构型为
的空间构型为______________ 。
(5) 的熔点为
的熔点为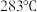 ,验证
,验证 晶体类型的实验方案为
晶体类型的实验方案为____________ 。
(6)若要确定中间产物 是晶体还是非晶体,最科学的方法是对它进行
是晶体还是非晶体,最科学的方法是对它进行____________ 实验; 的一种晶体结构如图所示,由图可知,
的一种晶体结构如图所示,由图可知, 原子位于O原子所围成的
原子位于O原子所围成的____________ 空隙中(填“四面体”或“八面体”),已知晶胞参数为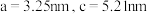 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞密度为
,则晶胞密度为____________  。(列出计算式,晶胞参数用字母a、c表示)
。(列出计算式,晶胞参数用字母a、c表示)
I.制备
 萘胺:
萘胺:
(1)溶剂
 的结构简式为
的结构简式为 ,则
,则 中碳原子的杂化类型有
中碳原子的杂化类型有 中所含有的
中所含有的 键数目为
键数目为(2)萘胺的水溶性比硝基萘的强,原因是
Ⅱ.制备
 催化剂:向按比例配置的
催化剂:向按比例配置的 混合溶液中加入碱液,调节
混合溶液中加入碱液,调节 至9~11,使其沉淀。将沉淀分离出来后焙烧并进一步还原,可得最终产物
至9~11,使其沉淀。将沉淀分离出来后焙烧并进一步还原,可得最终产物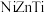 。制备过程中,会生成
。制备过程中,会生成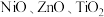 等中间产物。
等中间产物。(3)
 的基态原子价层电子排布式为
的基态原子价层电子排布式为(4)
 的空间构型为
的空间构型为(5)
 的熔点为
的熔点为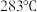 ,验证
,验证 晶体类型的实验方案为
晶体类型的实验方案为(6)若要确定中间产物
 是晶体还是非晶体,最科学的方法是对它进行
是晶体还是非晶体,最科学的方法是对它进行 的一种晶体结构如图所示,由图可知,
的一种晶体结构如图所示,由图可知, 原子位于O原子所围成的
原子位于O原子所围成的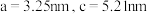 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞密度为
,则晶胞密度为 。(列出计算式,晶胞参数用字母a、c表示)
。(列出计算式,晶胞参数用字母a、c表示)
您最近一年使用:0次
名校
10 . 教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
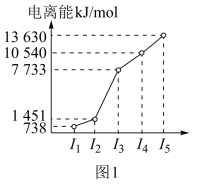
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有_______ 种不同运动状态的电子。
(2)如图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是_______ 。

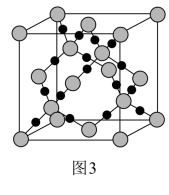
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于_______ 晶体。
(4)第一电离能介于Al、P之间的第三周期元素有_______ 种。 GaCl3原子的杂化方式为_______ 。写出与GaCl3结构相同的一种等电子体(写离子)_______ 。
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性,而干冰、碘的晶体具有相似的结构特征,干冰分子中一个分子周围有_______ 个紧邻分子。D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是_______ (填字母标号)。
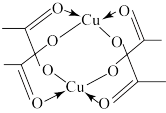
a.极性键 b.非极性键 c.配位键 d.金属键
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有

(2)如图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是

(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于

(4)第一电离能介于Al、P之间的第三周期元素有
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性,而干冰、碘的晶体具有相似的结构特征,干冰分子中一个分子周围有

a.极性键 b.非极性键 c.配位键 d.金属键
您最近一年使用:0次



