解题方法
1 . 铜及其化合物在生产生活中有着广泛的应用。回答下列问题:
(1)在元素周期表的分区中,铜属于_______ 区,与铜处于同一周期且最外层电子数相同的元素的基态原子共有_______ 种。
(2)过渡金属与O形成羰基配合物时,每个CO分子向中心原子提供2个电子,最终使中心原子的电子总数与同周期的稀有气体原子相同,称为有效原子序数规则。根据此规则推断,镍与CO形成的羰基配合物Ni(CO)x中,x=_______ 。
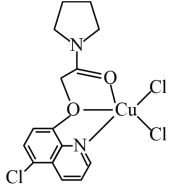
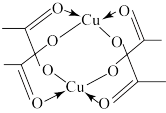
(3)CuCl2可与某有机多齿配体形成具有较强荧光性能的配合物,其结构简式如图所示。该配合物分子中N原子的杂化类型为_______ ,1mol 该有机配体与Cu( II )形成的配位键为_______ mol。
(4)铜催化烯烃硝化反应时会产生 。键角:
。键角:
_______  (填“<” 或“=”或“>”),其原因是
(填“<” 或“=”或“>”),其原因是_______ 。
(5)近期我国科学家合成了一种电化学性能优异的铜硒化合物,其晶胞结构如图所示。该铜硒化合物的化学式为_______ ,其中Cu 元素以Cu+和Cu2+存在,则_______ (填“①”或“②”)为Cu2+,该晶体的密度_______ g/cm3 (用含a和c的式子表示,设阿伏伽德罗常数为NA)。

(1)在元素周期表的分区中,铜属于
(2)过渡金属与O形成羰基配合物时,每个CO分子向中心原子提供2个电子,最终使中心原子的电子总数与同周期的稀有气体原子相同,称为有效原子序数规则。根据此规则推断,镍与CO形成的羰基配合物Ni(CO)x中,x=
(3)CuCl2可与某有机多齿配体形成具有较强荧光性能的配合物,其结构简式如图所示。该配合物分子中N原子的杂化类型为

(4)铜催化烯烃硝化反应时会产生
 。键角:
。键角:
 (填“<” 或“=”或“>”),其原因是
(填“<” 或“=”或“>”),其原因是(5)近期我国科学家合成了一种电化学性能优异的铜硒化合物,其晶胞结构如图所示。该铜硒化合物的化学式为

您最近一年使用:0次
2 . 铜及其化合物在生产生活中有着广泛的应用。请回答:
(1)已知Cu第一电离能I1(Cu)=746 kJ·mol-1,Zn第一电离能I1(Zn)=906 kJ·mol-1;则第二电离能大小关系为I2(Cu)___________ I2(Zn)(填“>”、“=”或“<”)。。
(2)在碱性条件下CuSO4与双缩脲[HN(CONH2)2]生成紫色的配位化合物,该原理可用于检验蛋白质。该配位化合物的阴离子结构如图所示:
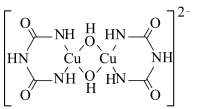
①该阴离子中所有元素的电负性从大到小的顺序为___________ 。
②该阴离子中氧原子的杂化方式为___________ ;
③lmol该阴离子含有σ键的数目为___________ ;
④该配合物中心铜离子的外围电子排布图为___________ ;
(3)磁性形状记忆材料Cu-Mn-Al合金的晶胞如图a所示(Mn、Al位于Cu形成的立方体体心位置),图b是沿立方格子对角面取得的截图,Cu在沿立方格子对角面取得截图中的相对位置如图c所示。

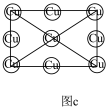
①该合金随温度升高,电导率_______ (填“升高”或“降低”或“不变”) ,原因为________ ;
②在图c中画出上图b切面上的Al和Mn的相对位置___________ (不考虑各原子的大小)。
(1)已知Cu第一电离能I1(Cu)=746 kJ·mol-1,Zn第一电离能I1(Zn)=906 kJ·mol-1;则第二电离能大小关系为I2(Cu)
(2)在碱性条件下CuSO4与双缩脲[HN(CONH2)2]生成紫色的配位化合物,该原理可用于检验蛋白质。该配位化合物的阴离子结构如图所示:

①该阴离子中所有元素的电负性从大到小的顺序为
②该阴离子中氧原子的杂化方式为
③lmol该阴离子含有σ键的数目为
④该配合物中心铜离子的外围电子排布图为
(3)磁性形状记忆材料Cu-Mn-Al合金的晶胞如图a所示(Mn、Al位于Cu形成的立方体体心位置),图b是沿立方格子对角面取得的截图,Cu在沿立方格子对角面取得截图中的相对位置如图c所示。


①该合金随温度升高,电导率
②在图c中画出上图b切面上的Al和Mn的相对位置
您最近一年使用:0次
名校
解题方法
3 . 2022年春晚中舞蹈诗剧《只此青绿》生动还原了北宋名画《千里江山图》,画之所以色彩艳丽,璀璨夺目,与所使用矿物颜料有关。回答下列问题:
(1)石青,又名蓝矿石,化学式为Cu3(CO3)2(OH)2,基态Cu2+核外电子的空间运动状态有_____ 种,CO 的空间构型为
的空间构型为_____ 。原子中电子有两种相反的自旋状态,分别用+ 和-
和- 表示,称为电子的自旋磁量子数,则Cu2+中电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则Cu2+中电子自旋磁量子数的代数和为_____ 。
(2)亚铁氰化钾,化学式为K4[Fe(CN)6],呈黄色结晶性粉末。[Fe(CN)6]4-中配体CN-的配位原子是_____ (填元素符号),与CN-互为等电子体的分子______ ,[Fe(CN)6]4-中σ键和π键的数目之比为_____ 。
(3)Cu2S呈黑色或灰黑色,已知:晶胞中S2-的位置如图1所示,Cu+位于S2-所构成的四面体中心,晶胞的侧视图如图2所示。
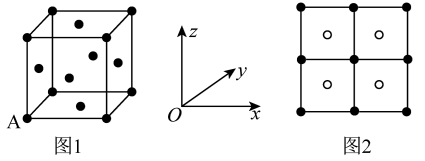
Cu+填充了晶胞中四面体空隙的百分率是_____ ,S2-配位数为______ 。已知图1中A原子的原子分数坐标为(0,0,0),则与A原子距离最近的Cu+的原子分数坐标为______ 。若晶胞参数为anm,晶体的密度为dg/cm3,则阿伏加德罗常数的值为______ (用含a和d的代数式表示)。
(1)石青,又名蓝矿石,化学式为Cu3(CO3)2(OH)2,基态Cu2+核外电子的空间运动状态有
 的空间构型为
的空间构型为 和-
和- 表示,称为电子的自旋磁量子数,则Cu2+中电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则Cu2+中电子自旋磁量子数的代数和为(2)亚铁氰化钾,化学式为K4[Fe(CN)6],呈黄色结晶性粉末。[Fe(CN)6]4-中配体CN-的配位原子是
(3)Cu2S呈黑色或灰黑色,已知:晶胞中S2-的位置如图1所示,Cu+位于S2-所构成的四面体中心,晶胞的侧视图如图2所示。

Cu+填充了晶胞中四面体空隙的百分率是
您最近一年使用:0次
2023-05-03更新
|
164次组卷
|
2卷引用:内蒙古赤峰市2022-2023学年高三上学期期末模拟考试化学试题
名校
4 . X、Y、Z、V、W五种短周期元素,原子序数依次增大,其中Z的原子半径最大,Z的单质在W的单质中燃烧产生黄色火焰,生成ZW型化合物;五种元素可以组成一种有机盐(如图所示)。下列说法正确的是
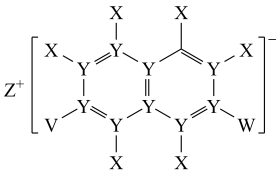

| A.Y与W形成的分子空间结构为三角锥 |
| B.V单质微溶于Y与V组成的二元化合物 |
| C.原子半径的大小关系为:Z>V>W |
| D.热稳定性:X与V组成的二元化合物>X与W组成的二元化合物 |
您最近一年使用:0次
2023-03-22更新
|
419次组卷
|
4卷引用:内蒙古阿拉善盟2023届高三第一次模拟考试理科综合化学试题
内蒙古阿拉善盟2023届高三第一次模拟考试理科综合化学试题宁夏中卫市2022届高三下学期二模理综化学试题(已下线)专题07 突破原子结构和元素周期表(律)(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)河北省张家口市宣化第一中学2022-2023学年高二下学期5月期中化学试题
解题方法
5 . 某些过渡金属(如钛、铜)及其化合物,以其高导电性和丰富的物理化学性质在材料领域大放异彩。
(1)钛比钢轻、比铝硬。基态钛原子的价层电子排布式为_______ :钛原子核外电子占据的轨道数_______ 。
(2)铜的下列状态中,失去最外层一个电子所需能量最小的是_______。
(3)二氧化钛是良好的光催化剂,可催化转化多种有毒物质,如:可将水中的 转化为
转化为 ,将甲基橙、亚甲基蓝、HCHO转化为CO2等。
,将甲基橙、亚甲基蓝、HCHO转化为CO2等。
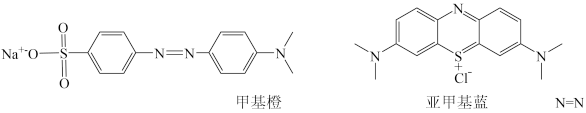
① 的空间构型是
的空间构型是_______ 。
②甲基橙、亚甲基蓝中C原子的杂化类型有_______ ,
③常温下,CO2、HCHO在水中溶解度之比大约是1:500,其主要原因是_______ 。
(4)黄铜矿炼铜过程中会产生SO2,与SO2互为等电子体的分子和阴离子分别为_______ (各写一种即可)。
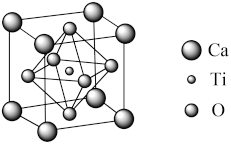
(5)钙钛矿型太阳能电池近年越来越受到科学界的关注,其效率提升速度超越过去任何一类电池。某种钙钛矿晶胞如图所示,则钙原子的配位数是_______ ,若阿伏加德罗常数的值为NA,晶胞中钙原子与氧原子的最近距离为a pm。则该晶胞的密度为_______ g/cm3.(列出计算式)
(1)钛比钢轻、比铝硬。基态钛原子的价层电子排布式为
(2)铜的下列状态中,失去最外层一个电子所需能量最小的是_______。
| A.[Ar]3dl04pl | B.[Ar]3d10 | C.[Ar]3d94s1 | D.[Ar]3d104s1 |
 转化为
转化为 ,将甲基橙、亚甲基蓝、HCHO转化为CO2等。
,将甲基橙、亚甲基蓝、HCHO转化为CO2等。
①
 的空间构型是
的空间构型是②甲基橙、亚甲基蓝中C原子的杂化类型有
③常温下,CO2、HCHO在水中溶解度之比大约是1:500,其主要原因是
(4)黄铜矿炼铜过程中会产生SO2,与SO2互为等电子体的分子和阴离子分别为
(5)钙钛矿型太阳能电池近年越来越受到科学界的关注,其效率提升速度超越过去任何一类电池。某种钙钛矿晶胞如图所示,则钙原子的配位数是

您最近一年使用:0次
2023-03-16更新
|
786次组卷
|
4卷引用:内蒙古自治区包头市2024届高三二模理科综合-化学试题
内蒙古自治区包头市2024届高三二模理科综合-化学试题河南省平许济洛四市2023届高三下学期第二次质量检测理科综合化学试题(已下线)狂飙卷 04-【热题狂飙】2023年高考化学样卷(全国卷专用)陕西省铜川市2023届高三下学期第二次模拟考试理综化学试题
解题方法
6 . 硼及其化合物在材料制造、有机合成等方面用途非常广泛,硼的一些化合物表现出缺电子特征。回答下列问题:
(1)基态硼原子的电子排布式为_______ ;B和Al的第一电离能I1(B)_______ I1(Al)(填“>”或“=”或“<”)。
(2)H3BO3(层状结构)的结构示意图如下,在硼酸的层状结构中O的杂化类型是_______ ,层内存在的作用力有_______ 。硼酸显弱酸性与[B(OH)4]-配离子有关,硼酸的电离方程式:_______ 。

(3)自然界中不存在单质硼,硼的氢化物也很少,主要存在的是硼的含氧化合物,根据表中数据分析其原因是_______ 。
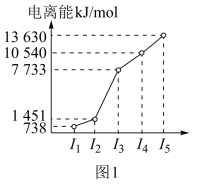
(4)已知晶体硼的熔、沸点及硬度数据和基本结构单元(由硼原子组成的正二十面体如图1所示,每个三角形均为正三角形,每个顶点为一个硼原子)如下:

①晶体硼属于原子(共价)晶体,其理由是_______ 。
②每一个硼基本单元由_______ 个原子组成;
③碳化硼,别名黑钻石,是已知最坚硬的三种材料之一,仅次于金刚石和立方氮化硼,图2为碳化硼晶胞,其化学式为_______ ;
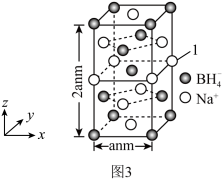
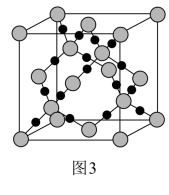
(5)硼氢化钠是一种常用的还原剂。其晶胞结构如图3所示,标注为“1”的Na+坐标参数为_______ 。已知NA代表阿伏加德罗常数的值,则硼氢化钠晶体的密度为ρ=_______ g·cm-3(用含NA的代数式表示)。
(1)基态硼原子的电子排布式为
(2)H3BO3(层状结构)的结构示意图如下,在硼酸的层状结构中O的杂化类型是

(3)自然界中不存在单质硼,硼的氢化物也很少,主要存在的是硼的含氧化合物,根据表中数据分析其原因是
| 化学键 | B-H | B-O | B-B |
| 键能(kJ·mol-1) | 389 | 561 | 293 |
| 晶体 | 金刚石 | 晶体硅 | 晶体硼 |
| 熔点(K) | 3832 | 1683 | 2573 |
| 沸点(K) | 5100 | 2628 | 3823 |
| 硬度 | 10 | 7.0 | 9.6 |

①晶体硼属于原子(共价)晶体,其理由是
②每一个硼基本单元由
③碳化硼,别名黑钻石,是已知最坚硬的三种材料之一,仅次于金刚石和立方氮化硼,图2为碳化硼晶胞,其化学式为
(5)硼氢化钠是一种常用的还原剂。其晶胞结构如图3所示,标注为“1”的Na+坐标参数为

您最近一年使用:0次
2023-03-12更新
|
754次组卷
|
3卷引用:内蒙古呼和浩特市2023届高三第一次质量数据监测理科综合化学试题
名校
解题方法
7 . Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为____ 。
A. B.
B.
C.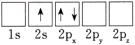 D.
D.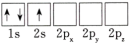
(2)Li+与H-具有相同的电子构型,但r(Li+)小于r(H-),原因是____ 。
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是____ ,中心原子的杂化形式为____ 。LiAlH4中,存在下列给出的____ 。
A.离子键 B.σ键 C.π键 D.氢键
(4)Li2O是离子晶体,其晶格能可通过图中的循环计算得到,由数据可知Li原子的第一电离能为____ kJ/mol,O=O键能为____ kJ/mol,Li2O晶格能为____ kJ/mol。
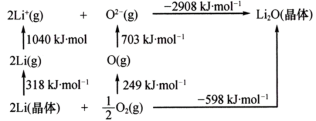
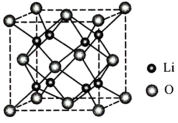
(5)Li2O具有反萤石结构,晶胞如图所示。已知晶胞参数为anm,阿伏加德罗常数的值为NA,则Li2O的密度为____ g•cm-3(列出计算式即可)。
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为
A.
 B.
B.
C.
 D.
D.
(2)Li+与H-具有相同的电子构型,但r(Li+)小于r(H-),原因是
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是
A.离子键 B.σ键 C.π键 D.氢键
(4)Li2O是离子晶体,其晶格能可通过图中的循环计算得到,由数据可知Li原子的第一电离能为
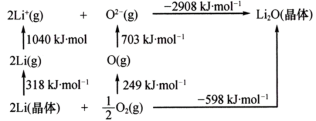
(5)Li2O具有反萤石结构,晶胞如图所示。已知晶胞参数为anm,阿伏加德罗常数的值为NA,则Li2O的密度为

您最近一年使用:0次
2022-09-19更新
|
159次组卷
|
2卷引用:内蒙古达拉特旗第一中学2022-2023学年高三上学期开学考试理综化学试题
解题方法
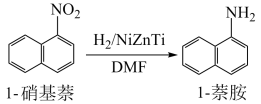
8 . 芳香胺是多种染料产品的中间体,也是农药、除草剂和多种橡胶防老剂的主要原料。
I.制备 萘胺:
萘胺:
(1)溶剂 的结构简式为
的结构简式为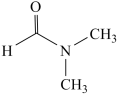 ,则
,则 中碳原子的杂化类型有
中碳原子的杂化类型有____________ , 中所含有的
中所含有的 键数目为
键数目为____________ ,分子中第一电离能最大的元素是____________ (填元素符号)。
(2)萘胺的水溶性比硝基萘的强,原因是____________ 。
Ⅱ.制备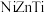 催化剂:向按比例配置的
催化剂:向按比例配置的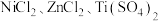 混合溶液中加入碱液,调节
混合溶液中加入碱液,调节 至9~11,使其沉淀。将沉淀分离出来后焙烧并进一步还原,可得最终产物
至9~11,使其沉淀。将沉淀分离出来后焙烧并进一步还原,可得最终产物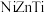 。制备过程中,会生成
。制备过程中,会生成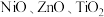 等中间产物。
等中间产物。
(3) 的基态原子价层电子排布式为
的基态原子价层电子排布式为_______________ 。
(4) 的空间构型为
的空间构型为______________ 。
(5) 的熔点为
的熔点为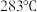 ,验证
,验证 晶体类型的实验方案为
晶体类型的实验方案为____________ 。
(6)若要确定中间产物 是晶体还是非晶体,最科学的方法是对它进行
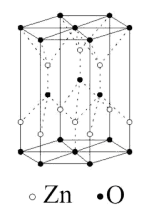
是晶体还是非晶体,最科学的方法是对它进行____________ 实验; 的一种晶体结构如图所示,由图可知,
的一种晶体结构如图所示,由图可知, 原子位于O原子所围成的
原子位于O原子所围成的____________ 空隙中(填“四面体”或“八面体”),已知晶胞参数为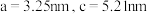 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞密度为
,则晶胞密度为____________  。(列出计算式,晶胞参数用字母a、c表示)
。(列出计算式,晶胞参数用字母a、c表示)
I.制备
 萘胺:
萘胺:
(1)溶剂
 的结构简式为
的结构简式为 ,则
,则 中碳原子的杂化类型有
中碳原子的杂化类型有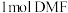 中所含有的
中所含有的 键数目为
键数目为(2)萘胺的水溶性比硝基萘的强,原因是
Ⅱ.制备
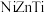 催化剂:向按比例配置的
催化剂:向按比例配置的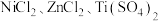 混合溶液中加入碱液,调节
混合溶液中加入碱液,调节 至9~11,使其沉淀。将沉淀分离出来后焙烧并进一步还原,可得最终产物
至9~11,使其沉淀。将沉淀分离出来后焙烧并进一步还原,可得最终产物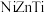 。制备过程中,会生成
。制备过程中,会生成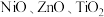 等中间产物。
等中间产物。(3)
 的基态原子价层电子排布式为
的基态原子价层电子排布式为(4)
 的空间构型为
的空间构型为(5)
 的熔点为
的熔点为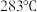 ,验证
,验证 晶体类型的实验方案为
晶体类型的实验方案为(6)若要确定中间产物
 是晶体还是非晶体,最科学的方法是对它进行
是晶体还是非晶体,最科学的方法是对它进行 的一种晶体结构如图所示,由图可知,
的一种晶体结构如图所示,由图可知, 原子位于O原子所围成的
原子位于O原子所围成的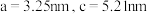 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞密度为
,则晶胞密度为 。(列出计算式,晶胞参数用字母a、c表示)
。(列出计算式,晶胞参数用字母a、c表示)
您最近一年使用:0次
名校
9 . 教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有_______ 种不同运动状态的电子。
(2)如图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是_______ 。

(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于_______ 晶体。
(4)第一电离能介于Al、P之间的第三周期元素有_______ 种。 GaCl3原子的杂化方式为_______ 。写出与GaCl3结构相同的一种等电子体(写离子)_______ 。
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性,而干冰、碘的晶体具有相似的结构特征,干冰分子中一个分子周围有_______ 个紧邻分子。D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是_______ (填字母标号)。
a.极性键 b.非极性键 c.配位键 d.金属键
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有

(2)如图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是

(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于

(4)第一电离能介于Al、P之间的第三周期元素有
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性,而干冰、碘的晶体具有相似的结构特征,干冰分子中一个分子周围有

a.极性键 b.非极性键 c.配位键 d.金属键
您最近一年使用:0次
10 . 锌是一种重要金属,原子序数为30.回答下列问题:
(1)锌元素位于元素周期表_______ 区,Zn的价层电子排布式为_______ 。
(2)Zn2+能形成多种配位化合物,在[Zn(NH3)4]2+中,提供电子对形成配位键的原子是_______ ,中心离子的配位数为_______ 。
(3)一种锌的配合物结构简式如图所示,结构中的C原子有_______ 种杂化方式,其中标注“★”的C原子为_______ 杂化。

(4)已知NH3和H2O的空间结构和相应键角如图所示,试解释H2O的键角小于NH3键角的原因:_______ 。

(5)立方闪锌矿(ZnO)的晶胞结构如图所示,若晶体密度为dg·cm-3,则距离最近的氧原子与锌原子核间距离为_______ cm(用含d和NA的代数式表示)。

(1)锌元素位于元素周期表
(2)Zn2+能形成多种配位化合物,在[Zn(NH3)4]2+中,提供电子对形成配位键的原子是
(3)一种锌的配合物结构简式如图所示,结构中的C原子有

(4)已知NH3和H2O的空间结构和相应键角如图所示,试解释H2O的键角小于NH3键角的原因:

(5)立方闪锌矿(ZnO)的晶胞结构如图所示,若晶体密度为dg·cm-3,则距离最近的氧原子与锌原子核间距离为

您最近一年使用:0次



