解题方法
1 . 铜是重要的过渡金属元素,铜被广泛应用于电子工业和航天领域中。回答下列问题:
(1) 的价电子排布式为
的价电子排布式为________ 。
(2) 可以与乙二胺
可以与乙二胺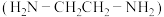 形成配离子,结构如图所示。
形成配离子,结构如图所示。________ 。
② 、
、 、
、 三种分子中,它们的键角由大到小的顺序为
三种分子中,它们的键角由大到小的顺序为________ (用分子式表示)。
(3)我国科学家制备了一种铜的配合物,结构如图所示,该配合物中四种非金属元素中第一电离能最大的是________ (填元素符号),配合物中 杂化的碳原子与
杂化的碳原子与 杂化的碳原子个数比为
杂化的碳原子个数比为________ 。________ 。
(1)
 的价电子排布式为
的价电子排布式为(2)
 可以与乙二胺
可以与乙二胺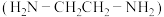 形成配离子,结构如图所示。
形成配离子,结构如图所示。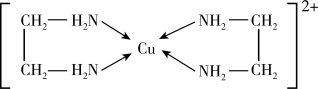
②
 、
、 、
、 三种分子中,它们的键角由大到小的顺序为
三种分子中,它们的键角由大到小的顺序为(3)我国科学家制备了一种铜的配合物,结构如图所示,该配合物中四种非金属元素中第一电离能最大的是
 杂化的碳原子与
杂化的碳原子与 杂化的碳原子个数比为
杂化的碳原子个数比为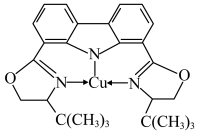
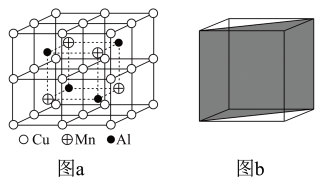
②在图c中画出Al和Mn的相对位置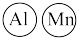 表示,不考虑各原子的大小)。
表示,不考虑各原子的大小)。
您最近一年使用:0次
解题方法
2 . 我国自主研发的用氟硼铍酸钾(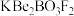 )晶体制造深紫外固体激光器技术领先世界。回答下列问题:
)晶体制造深紫外固体激光器技术领先世界。回答下列问题:
(1)基态K原子核外有_____ 种不同运动状态的电子,能量最低的空轨道的符号是_____ 。
(2)在1000℃时,氯化铍以 形式存在,该分子的空间构型为
形式存在,该分子的空间构型为_____ ;在500~600℃气相中,氯化铍则以二聚体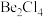 的形式存在,画出
的形式存在,画出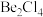 的结构:
的结构:_____ (标出配位键)。
(3)在第二周期中第一电离能介于B和O两种元素之间的元素有_____ (填元素符号)。
(4) 分子中的
分子中的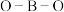 的键角大于
的键角大于 中的
中的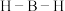 的键角,判断依据是
的键角,判断依据是_____ (从中心原子杂化方式的角度来解释)。
(5)一定条件下,实验测得的HF的相对分子质量总是大于理论值,原因是_____ 。
(6)六方氮化硼在高温高压下,可以转化为立方氮化硼,二者晶体结构如图所示: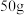 六方氮化硼晶体中含有六元环的数目为
六方氮化硼晶体中含有六元环的数目为_____  (用
(用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
②立方氮化硼晶体中,设晶胞中最近的B、N原子之间的距离为apm,晶体的密度为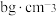 。则阿伏加德罗常数为
。则阿伏加德罗常数为_____  。(列式即可,用含a、b的代数式表示)
。(列式即可,用含a、b的代数式表示)
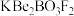 )晶体制造深紫外固体激光器技术领先世界。回答下列问题:
)晶体制造深紫外固体激光器技术领先世界。回答下列问题:(1)基态K原子核外有
(2)在1000℃时,氯化铍以
 形式存在,该分子的空间构型为
形式存在,该分子的空间构型为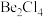 的形式存在,画出
的形式存在,画出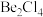 的结构:
的结构:(3)在第二周期中第一电离能介于B和O两种元素之间的元素有
(4)
 分子中的
分子中的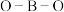 的键角大于
的键角大于 中的
中的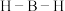 的键角,判断依据是
的键角,判断依据是(5)一定条件下,实验测得的HF的相对分子质量总是大于理论值,原因是
(6)六方氮化硼在高温高压下,可以转化为立方氮化硼,二者晶体结构如图所示:

 六方氮化硼晶体中含有六元环的数目为
六方氮化硼晶体中含有六元环的数目为 (用
(用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。②立方氮化硼晶体中,设晶胞中最近的B、N原子之间的距离为apm,晶体的密度为
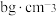 。则阿伏加德罗常数为
。则阿伏加德罗常数为 。(列式即可,用含a、b的代数式表示)
。(列式即可,用含a、b的代数式表示)
您最近一年使用:0次
解题方法
3 . 已发现的高温超导材料按成分分为含铜的和不含铜的。含铜超导材料有铋锶钙铜氧体系、铅锶钇铜氧体系等,不含铜超导体主要是钡镓铋氧体系等。回答下列问题:
(1)钇(Y)的原子序数比 大
大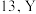 位于元素周期表的第
位于元素周期表的第___________ 族。
(2)基态铜原子的价电子排布式为___________ 。
(3)第一电离能: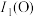
___________ (填“>”“<”或“=”)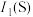 ,其原因是
,其原因是___________ 。
(4) 能与
能与 和
和 形成络合物
形成络合物 。键角:
。键角:
___________ (填“>”或“<”) ,
, 的配位数为
的配位数为___________ ,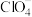 的空间构型为
的空间构型为___________ , 的杂化方式为
的杂化方式为___________ 。
(5)一种高温超导材料的晶胞结构如图所示,该立方晶胞参数为 。阿伏加德罗常数的值为NA。
。阿伏加德罗常数的值为NA。___________ 。
②晶体中与 最近且距离相等的
最近且距离相等的 有
有___________ 个。
③该晶体的密度为___________  。
。
(1)钇(Y)的原子序数比
 大
大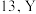 位于元素周期表的第
位于元素周期表的第(2)基态铜原子的价电子排布式为
(3)第一电离能:
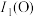
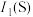 ,其原因是
,其原因是(4)
 能与
能与 和
和 形成络合物
形成络合物 。键角:
。键角:
 ,
, 的配位数为
的配位数为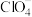 的空间构型为
的空间构型为 的杂化方式为
的杂化方式为(5)一种高温超导材料的晶胞结构如图所示,该立方晶胞参数为
 。阿伏加德罗常数的值为NA。
。阿伏加德罗常数的值为NA。
②晶体中与
 最近且距离相等的
最近且距离相等的 有
有③该晶体的密度为
 。
。
您最近一年使用:0次
解题方法
4 . 青蒿素 是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。
是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。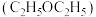 提取,效果更好。
提取,效果更好。
①乙醚沸点低于乙醇,原因是_____ 。
②用乙醚提取效果更好,原因是_____ 。
(2)确定结构
①青蒿素分子中含有_____ 个不对称碳原子。
②能确定晶体中哪些原子间存在化学键、并能确定键长和键角,从而得出分子空间结构的一种方法是_____ 。
a.质谱法 b.X射线衍射 c.核磁共振氢谱 d.红外光谱
(3)修饰结构,提高疗效:一定条件下,用 将青蒿素选择性还原生成双氢青蒿素。
将青蒿素选择性还原生成双氢青蒿素。_____ 。
②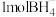 中有
中有_____  σ键,
σ键, 的空间结构为
的空间结构为_____ 。
③比较水溶性:双氢青蒿素_____ (填“ ”)青蒿素。
”)青蒿素。
 是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。
是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。
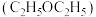 提取,效果更好。
提取,效果更好。①乙醚沸点低于乙醇,原因是
②用乙醚提取效果更好,原因是
(2)确定结构
①青蒿素分子中含有
②能确定晶体中哪些原子间存在化学键、并能确定键长和键角,从而得出分子空间结构的一种方法是
a.质谱法 b.X射线衍射 c.核磁共振氢谱 d.红外光谱
(3)修饰结构,提高疗效:一定条件下,用
 将青蒿素选择性还原生成双氢青蒿素。
将青蒿素选择性还原生成双氢青蒿素。
②
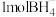 中有
中有 σ键,
σ键, 的空间结构为
的空间结构为③比较水溶性:双氢青蒿素
 ”)青蒿素。
”)青蒿素。
您最近一年使用:0次
5 . I.按构成晶体的粒子和粒子间作用力的不同,将以下晶体进行分类:
①氯化钡、②石英、③金刚砂、④水、⑤乙醇、⑥铜、⑦氯酸钾、⑧高锰酸钾、⑨稀有气体的晶体、⑩干冰
(1)属于共价晶体的有:___________ ;属于分子晶体的有:___________ ;属于离子晶体的有:___________ ;属于金属晶体的有:___________ 。
Ⅱ.比较:
(2)熔点:金刚石___________ 干冰(填“>”或“<”),原因是___________ 。
(3)键角:CH4___________ H2O(填“>”或“<”),原因是___________ 。
Ⅲ.请回答:
(4)黄铜合金采取面心立方堆积,其晶胞结构如图所示:___________ 。
②与Cu原子等距离且最近的Cu原子有___________ 个。
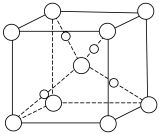
(5)甲醛与新制Cu(OH)2悬浊液加热可得砖红色沉淀Cu2O,已知Cu2O晶胞的结构如图所示:___________ 。
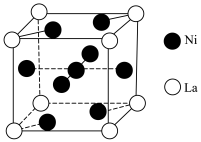
(6)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构如图。___________ 。
①氯化钡、②石英、③金刚砂、④水、⑤乙醇、⑥铜、⑦氯酸钾、⑧高锰酸钾、⑨稀有气体的晶体、⑩干冰
(1)属于共价晶体的有:
Ⅱ.比较:
(2)熔点:金刚石
(3)键角:CH4
Ⅲ.请回答:
(4)黄铜合金采取面心立方堆积,其晶胞结构如图所示:

②与Cu原子等距离且最近的Cu原子有
(5)甲醛与新制Cu(OH)2悬浊液加热可得砖红色沉淀Cu2O,已知Cu2O晶胞的结构如图所示:
(6)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构如图。
您最近一年使用:0次
解题方法
6 . 生产生活中处处有化学,结合物质与结构的相关知识,回答下列问题:
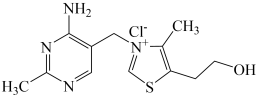
(1)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用,该物质的结构简式如图所示:___________ 。
a.离子键、共价键 b.离子键、氢键、共价键
c.氢键、范德华力 d.离子键、氢键、范德华力
②维生素B1燃烧可生成N2、NH3、CO2、SO2、H2O、HCl等物质,这些物质中属于非极性分子的化合物有___________ 。
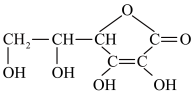
(2)维生素C的结构简式如下,它能防治坏血病,该分子中有___________ 个手性碳原子。___________ (填标号)。
a.原子轨道电子排布半充满时体系能量最低,电子排布式为[Ne]3s13p3
b.3p轨道的电子总是比3s轨道的电子在离核更远的区域运动
c.电负性比Al高,原子对键合电子的吸引力比Al大
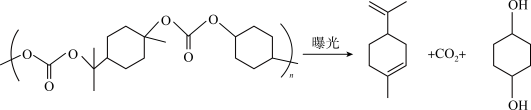
(4)近年来美国为了遏制中国发展,对我国发起了以封锁“芯片”为核心的全方位打压,此举激发了中国科技人员自研的决心。2022年10月宁波南大光电ArF光刻胶生产线正式投产,国内7 nm芯片制造材料获得重大突破。一种聚碳酸酯胶的曝光分解原理如下:___________ 。
②聚碳酸酯膜曝光后的产物加热可汽化或溶于水,加热汽化或溶于水克服的作用力有___________ 。
(5)金属钛密度小、强度高、抗腐蚀性能好,是应用广泛的金属。含钛的矿石主要有金红石和钛铁矿。将1 mol TiCl3∙4H2O溶于水,加入足量AgNO3溶液,得到1 mol AgCl沉淀,已知Ti3+的配位数为6,TiCl3∙4H2O的化学式用配合物的形式表示为___________ 。
(1)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用,该物质的结构简式如图所示:
a.离子键、共价键 b.离子键、氢键、共价键
c.氢键、范德华力 d.离子键、氢键、范德华力
②维生素B1燃烧可生成N2、NH3、CO2、SO2、H2O、HCl等物质,这些物质中属于非极性分子的化合物有
(2)维生素C的结构简式如下,它能防治坏血病,该分子中有
a.原子轨道电子排布半充满时体系能量最低,电子排布式为[Ne]3s13p3
b.3p轨道的电子总是比3s轨道的电子在离核更远的区域运动
c.电负性比Al高,原子对键合电子的吸引力比Al大
(4)近年来美国为了遏制中国发展,对我国发起了以封锁“芯片”为核心的全方位打压,此举激发了中国科技人员自研的决心。2022年10月宁波南大光电ArF光刻胶生产线正式投产,国内7 nm芯片制造材料获得重大突破。一种聚碳酸酯胶的曝光分解原理如下:
②聚碳酸酯膜曝光后的产物加热可汽化或溶于水,加热汽化或溶于水克服的作用力有
(5)金属钛密度小、强度高、抗腐蚀性能好,是应用广泛的金属。含钛的矿石主要有金红石和钛铁矿。将1 mol TiCl3∙4H2O溶于水,加入足量AgNO3溶液,得到1 mol AgCl沉淀,已知Ti3+的配位数为6,TiCl3∙4H2O的化学式用配合物的形式表示为
您最近一年使用:0次
名校
7 . 我国在新材料领域研究的重大突破,为“天宫”空间站的建设提供了坚实的物质基础。“天宫”空间站使用的材料中含有B、C、N、Ni等元素。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是_______ (填标号,下同),用光谱仪可捕捉到发射光谱的是_______ 。
A. B.
B. 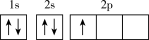
C.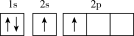 D.
D. 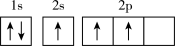
(2)镍能形成多种配合物,其中 是无色挥发性液体,
是无色挥发性液体,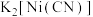 是红黄色单斜晶体。
是红黄色单斜晶体。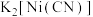 的熔点高于
的熔点高于 的原因是
的原因是_______ 。
(3)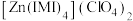 是
是 的一种配合物,IMI的结构为
的一种配合物,IMI的结构为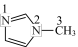 ,其中碳原子杂化方式为
,其中碳原子杂化方式为_______ ,所含元素电负性由大到小的顺序是_______ 。IMI中大π键可表示为_______ (已知苯中的大π键可表示为 ),该配合物的配位原子为
),该配合物的配位原子为_______ (填序号)。
(4)氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,质地软,可作润滑剂。立方相氮化硼与金刚石相似,是超硬材料,有优异的耐磨性。它们的晶体结构及晶胞如图所示。
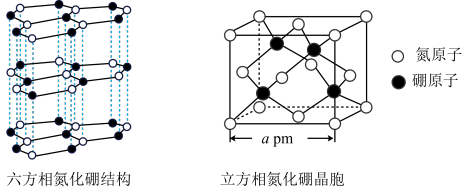
①石墨能导电,六方相氮化硼结构与石墨相似却不导电,原因是_______ 。
②立方相氮化硼晶体中“一般共价键”与配位键的数目之比为_______ 。
(5)红银矿NiAs晶体结构如图所示:
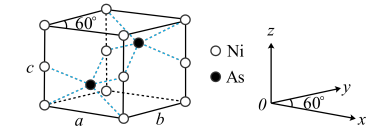
①两个As原子的原子分数坐标依次为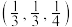 和
和_______ 。
②已知 为阿伏加德罗常数的值,X射线光谱测算出的晶胞参数为a=b=mpm、c=npm,则该晶体的密度为
为阿伏加德罗常数的值,X射线光谱测算出的晶胞参数为a=b=mpm、c=npm,则该晶体的密度为_______  (用含m、n的代数式表示)。
(用含m、n的代数式表示)。
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是
A.
 B.
B. 
C.
 D.
D. 
(2)镍能形成多种配合物,其中
 是无色挥发性液体,
是无色挥发性液体,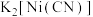 是红黄色单斜晶体。
是红黄色单斜晶体。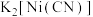 的熔点高于
的熔点高于 的原因是
的原因是(3)
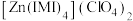 是
是 的一种配合物,IMI的结构为
的一种配合物,IMI的结构为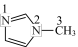 ,其中碳原子杂化方式为
,其中碳原子杂化方式为 ),该配合物的配位原子为
),该配合物的配位原子为(4)氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,质地软,可作润滑剂。立方相氮化硼与金刚石相似,是超硬材料,有优异的耐磨性。它们的晶体结构及晶胞如图所示。

①石墨能导电,六方相氮化硼结构与石墨相似却不导电,原因是
②立方相氮化硼晶体中“一般共价键”与配位键的数目之比为
(5)红银矿NiAs晶体结构如图所示:

①两个As原子的原子分数坐标依次为
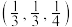 和
和②已知
 为阿伏加德罗常数的值,X射线光谱测算出的晶胞参数为a=b=mpm、c=npm,则该晶体的密度为
为阿伏加德罗常数的值,X射线光谱测算出的晶胞参数为a=b=mpm、c=npm,则该晶体的密度为 (用含m、n的代数式表示)。
(用含m、n的代数式表示)。
您最近一年使用:0次
名校
解题方法
8 . 下列对分子性质的解释中,不正确的是
| A.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 |
| B.NF3和BF3的中心原子杂化方式均为sp3杂化 |
| C.SO3为非极性分子 |
| D.金刚石的熔点比干冰的熔点高 |
您最近一年使用:0次
2024-03-15更新
|
149次组卷
|
2卷引用:内蒙古师范大学锦山实验中学2023-2024学年高二下学期一调考试化学试题
名校
解题方法
9 . 某种镁盐具有良好的电化学性能,其阴离子结构如下图所示。W、X、Y、Z、Q是核电荷数依次增大的短周期元素,W、Y原子序数之和等于Z,Y原子价电子数是Q原子价电子数的2倍。下列说法错误的是
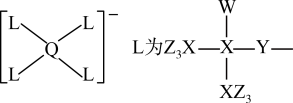
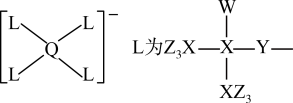
| A.W与X的化合物,其分子空间构型为正四面体 |
| B.第一电离能Z>Y>X |
| C.Q的氧化物是两性氧化物 |
| D.该阴离子中含有配位键 |
您最近一年使用:0次
名校
解题方法
10 . 甲醛是家庭装修常见的污染物。一种催化氧化甲醛的反应:HCHO+O2 H2O+CO2.下列有关叙述正确的是
H2O+CO2.下列有关叙述正确的是
 H2O+CO2.下列有关叙述正确的是
H2O+CO2.下列有关叙述正确的是| A.HCHO分子中σ键和π键的数目之比为2:1 |
| B.HCHO分子中存在分子间氢键 |
| C.H2O是由极性键构成的非极性分子 |
| D.CO2中碳原子的杂化方式为sp |
您最近一年使用:0次
2024-03-08更新
|
248次组卷
|
4卷引用:内蒙古师范大学锦山实验中学2023-2024学年高二下学期一调考试化学试题



