解题方法
1 . 航空材料、医药、电池工业的发展都离不开化学。砷化镓(GaAs)、碳化硅等是制作半导体芯片的关键材料,磷酸铁锂( )和三元锂电池(正极含有Ni、Co、Mn三种元素)是新能源汽车的常用电池。回答以下问题:
)和三元锂电池(正极含有Ni、Co、Mn三种元素)是新能源汽车的常用电池。回答以下问题:
(1)基态Ga原子的价层电子排布式为________ 。
(2)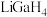 是一种温和的还原剂,可通过反应:
是一种温和的还原剂,可通过反应: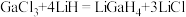 制得。已知
制得。已知 的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为
的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为________ 。 在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:
在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:________ 。
(3) 中四种元素的第一电离能由大到小的顺序是
中四种元素的第一电离能由大到小的顺序是________ (填元素符号),其阴离子的立体构型名称是________ 。
(4)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物 和
和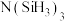 的结构如图所示,
的结构如图所示,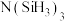 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为________ ,二者中更易与 形成配位键的是
形成配位键的是________ 。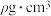 ,晶胞中原子的空间利用率(即晶胞中原子体积占空间体积的百分率为
,晶胞中原子的空间利用率(即晶胞中原子体积占空间体积的百分率为________ 。(用含a、b、p、 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
 )和三元锂电池(正极含有Ni、Co、Mn三种元素)是新能源汽车的常用电池。回答以下问题:
)和三元锂电池(正极含有Ni、Co、Mn三种元素)是新能源汽车的常用电池。回答以下问题:(1)基态Ga原子的价层电子排布式为
(2)
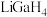 是一种温和的还原剂,可通过反应:
是一种温和的还原剂,可通过反应: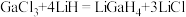 制得。已知
制得。已知 的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为
的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为 在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:
在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:(3)
 中四种元素的第一电离能由大到小的顺序是
中四种元素的第一电离能由大到小的顺序是(4)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物
 和
和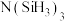 的结构如图所示,
的结构如图所示,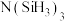 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为 形成配位键的是
形成配位键的是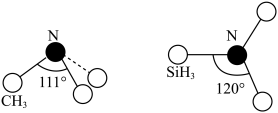
 ,晶胞中原子的空间利用率(即晶胞中原子体积占空间体积的百分率为
,晶胞中原子的空间利用率(即晶胞中原子体积占空间体积的百分率为 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。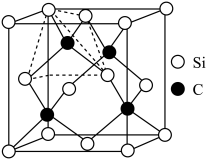
您最近一年使用:0次
解题方法
2 . 元素周期表中第四周期的某些元素在生产、生活中有着广泛的应用。回答下列问题:
(1)砷在自然界中分布广泛,主要用于制砷铅合金、砷铜合金。基态砷原子的价电子排布式为___________ ,砷、硒、溴三种元素电负性由小到大的顺序为___________ (填元素符号), 的空间构型是
的空间构型是___________ 形。
(2)科学家在研究金属矿物质组分的过程中,发现了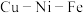 等多种金属互化物。确定某种金属互化物是晶体还是非晶体的实验是
等多种金属互化物。确定某种金属互化物是晶体还是非晶体的实验是___________ 。
(3) 能与
能与 反应生成
反应生成 ,其中碳原子的杂化方式是
,其中碳原子的杂化方式是___________ , 键和
键和 键数目之比为
键数目之比为___________ 。
(4) 是钴的一种配合物,向
是钴的一种配合物,向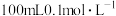 该配合物的溶液中加入足量
该配合物的溶液中加入足量 溶液,生成
溶液,生成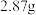 白色沉淀,则该配合物的化学式为
白色沉淀,则该配合物的化学式为___________ ,中心离子的配位数为___________ 。
(5)某离子型铁的氧化物晶胞如图所示,它由X、Y组成,则该氧化物的化学式为___________ 。已知该晶体的密度为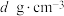 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体的晶胞参数
,则该晶体的晶胞参数
___________  (用含
(用含 和
和 的代数式表示)。
的代数式表示)。
(1)砷在自然界中分布广泛,主要用于制砷铅合金、砷铜合金。基态砷原子的价电子排布式为
 的空间构型是
的空间构型是(2)科学家在研究金属矿物质组分的过程中,发现了
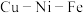 等多种金属互化物。确定某种金属互化物是晶体还是非晶体的实验是
等多种金属互化物。确定某种金属互化物是晶体还是非晶体的实验是(3)
 能与
能与 反应生成
反应生成 ,其中碳原子的杂化方式是
,其中碳原子的杂化方式是 键和
键和 键数目之比为
键数目之比为(4)
 是钴的一种配合物,向
是钴的一种配合物,向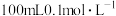 该配合物的溶液中加入足量
该配合物的溶液中加入足量 溶液,生成
溶液,生成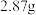 白色沉淀,则该配合物的化学式为
白色沉淀,则该配合物的化学式为(5)某离子型铁的氧化物晶胞如图所示,它由X、Y组成,则该氧化物的化学式为
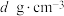 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体的晶胞参数
,则该晶体的晶胞参数
 (用含
(用含 和
和 的代数式表示)。
的代数式表示)。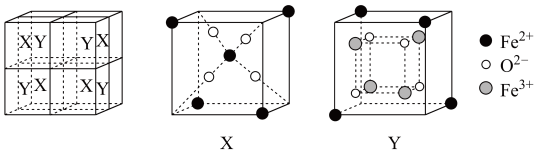
您最近一年使用:0次
解题方法
3 . 氮族元素包括氮(N)、磷(P)、砷( )、锑(
)、锑( )、铋(
)、铋( )和镆(
)和镆( )六种,它们的单质及其化合物在工农业生产中有着重要的用途。回答下列问题:
)六种,它们的单质及其化合物在工农业生产中有着重要的用途。回答下列问题:
(1) 基态原子核外电子排布式为
基态原子核外电子排布式为___________ , 基态原子核外有
基态原子核外有___________ 个未成对电子。
(2) 与同周期元素
与同周期元素 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为___________ 。
(3)氮气分子内存在氮氮三键,性质稳定,试从分子结构的角度解释P、 的单质化学性质比
的单质化学性质比 活泼的原因是
活泼的原因是___________ 。
(4) 离子中P的杂化类型为
离子中P的杂化类型为___________ , 分子的空间构型均为
分子的空间构型均为___________ ,其键角依次减小的原因是___________ 。
(5)氮和铜形成的一种二元化合物具有良好的电学和光学性能,其晶胞结构如图所示,则N的配位数为___________ ,该晶体密度为___________  (列出计算式,
(列出计算式, 代表阿伏加德罗常数的值)。
代表阿伏加德罗常数的值)。
 )、锑(
)、锑( )、铋(
)、铋( )和镆(
)和镆( )六种,它们的单质及其化合物在工农业生产中有着重要的用途。回答下列问题:
)六种,它们的单质及其化合物在工农业生产中有着重要的用途。回答下列问题:(1)
 基态原子核外电子排布式为
基态原子核外电子排布式为 基态原子核外有
基态原子核外有(2)
 与同周期元素
与同周期元素 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为(3)氮气分子内存在氮氮三键,性质稳定,试从分子结构的角度解释P、
 的单质化学性质比
的单质化学性质比 活泼的原因是
活泼的原因是(4)
 离子中P的杂化类型为
离子中P的杂化类型为 分子的空间构型均为
分子的空间构型均为(5)氮和铜形成的一种二元化合物具有良好的电学和光学性能,其晶胞结构如图所示,则N的配位数为
 (列出计算式,
(列出计算式, 代表阿伏加德罗常数的值)。
代表阿伏加德罗常数的值)。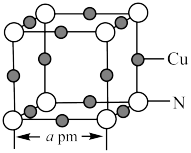
您最近一年使用:0次
2024-04-19更新
|
136次组卷
|
2卷引用:2024届青海省西宁市大通县高三下学期第二次模拟考试理科综合试题-高中化学
4 . 中国科学家合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料: ,并获得该化合物的LED器件,为白光的应用提供新材料支持。
,并获得该化合物的LED器件,为白光的应用提供新材料支持。
(1)已知 与
与 同族,基态
同族,基态 原子价层电子的运动状态有
原子价层电子的运动状态有__________ 种,基态O原子的电子排布式不能表示为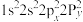 ,因为这违背了
,因为这违背了__________ (填选项)。
A.能量最低原理 B.泡利不相容原理 C.洪特规则
(2) 、P与S是同周期中相邻的元素,
、P与S是同周期中相邻的元素, 、P、S的电负性由大到小的顺序是
、P、S的电负性由大到小的顺序是__________ ,第一电离能由大到小的顺序是__________ .
(3)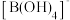 中硼原子的杂化轨道类型为
中硼原子的杂化轨道类型为__________ 。 中,
中, 与0之间不存在的化学键是
与0之间不存在的化学键是__________ (填选项)。
A. 键 B.
键 B. 键 C.配位键 D.极性键
键 C.配位键 D.极性键
(4)碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较低的是__________ ,其原因是_______________ 。
(5)超高热导率半导体材料砷化硼(BAs)的晶胞结构如图所示,则1号砷原子的原子坐标为__________ 。已知阿伏加德罗常数的值为 ,若晶胞中
,若晶胞中 原子到B原子最近距离为
原子到B原子最近距离为 ,则该晶体的密度为
,则该晶体的密度为__________ (列出含a、 的计算式即可)。
的计算式即可)。
 ,并获得该化合物的LED器件,为白光的应用提供新材料支持。
,并获得该化合物的LED器件,为白光的应用提供新材料支持。(1)已知
 与
与 同族,基态
同族,基态 原子价层电子的运动状态有
原子价层电子的运动状态有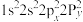 ,因为这违背了
,因为这违背了A.能量最低原理 B.泡利不相容原理 C.洪特规则
(2)
 、P与S是同周期中相邻的元素,
、P与S是同周期中相邻的元素, 、P、S的电负性由大到小的顺序是
、P、S的电负性由大到小的顺序是(3)
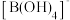 中硼原子的杂化轨道类型为
中硼原子的杂化轨道类型为 中,
中, 与0之间不存在的化学键是
与0之间不存在的化学键是A.
 键 B.
键 B. 键 C.配位键 D.极性键
键 C.配位键 D.极性键(4)碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较低的是
(5)超高热导率半导体材料砷化硼(BAs)的晶胞结构如图所示,则1号砷原子的原子坐标为
 ,若晶胞中
,若晶胞中 原子到B原子最近距离为
原子到B原子最近距离为 ,则该晶体的密度为
,则该晶体的密度为 的计算式即可)。
的计算式即可)。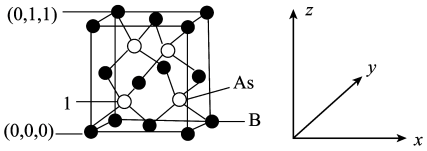
您最近一年使用:0次
5 . 有机合成中离不开各种催化剂的使用,开发各种针对性的、专用的催化剂一直是市场的迫切需求,如CuO-ZnO、 、
、 、Cu-cat-2500T等具备催化功能的高效催化剂产品。回答下列问题:
、Cu-cat-2500T等具备催化功能的高效催化剂产品。回答下列问题:
(1)基态铜原子的核外电子排布式为___________ 。
(2)催化剂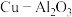 可专用于醛酮的加氢,如反应:
可专用于醛酮的加氢,如反应:
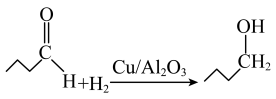
①该反应中断裂和形成的化学键有___________ (填字母)。
a.极性共价键 b.非极性共价键 c.σ键 d.π键 e.氢键 f.配位键
②该反应涉及的所有元素中,电负性最大的元素为___________ (填元素符号,下同),第一电离能最小的是___________ 。
③反应物正丁醛的熔、沸点均比产物正丁醇的熔、沸点低,其主要原因是___________ 。
(3)在硫酸锌溶液中加入氨水,先生成沉淀,后沉淀溶解,生成四氨合锌离子。
① 的空间结构为
的空间结构为___________ ,其配体的中心原子的杂化轨道类型是___________ 。
②在 和
和 中两个N-H键之间的夹角,
中两个N-H键之间的夹角, 中的
中的___________ (填“更大”“更小”或“一样大”)。
(4)催化剂Cu-cat-2500T中Cu形成的晶胞如图所示,图中位于晶胞内的原子与位于晶胞面上的原子数之比为2:9,该晶胞参数分别为apm、2apm、2apm。设 为阿伏加德罗常数的值,则该晶胞中含
为阿伏加德罗常数的值,则该晶胞中含___________ 个Cu,由该晶胞形成的晶体的密度为___________  。
。

 、
、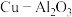 、Cu-cat-2500T等具备催化功能的高效催化剂产品。回答下列问题:
、Cu-cat-2500T等具备催化功能的高效催化剂产品。回答下列问题:(1)基态铜原子的核外电子排布式为
(2)催化剂
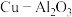 可专用于醛酮的加氢,如反应:
可专用于醛酮的加氢,如反应: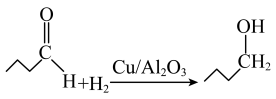
①该反应中断裂和形成的化学键有
a.极性共价键 b.非极性共价键 c.σ键 d.π键 e.氢键 f.配位键
②该反应涉及的所有元素中,电负性最大的元素为
③反应物正丁醛的熔、沸点均比产物正丁醇的熔、沸点低,其主要原因是
(3)在硫酸锌溶液中加入氨水,先生成沉淀,后沉淀溶解,生成四氨合锌离子。
①
 的空间结构为
的空间结构为②在
 和
和 中两个N-H键之间的夹角,
中两个N-H键之间的夹角, 中的
中的(4)催化剂Cu-cat-2500T中Cu形成的晶胞如图所示,图中位于晶胞内的原子与位于晶胞面上的原子数之比为2:9,该晶胞参数分别为apm、2apm、2apm。设
 为阿伏加德罗常数的值,则该晶胞中含
为阿伏加德罗常数的值,则该晶胞中含 。
。
您最近一年使用:0次
名校
解题方法
6 . 铜是人类最早使用的金属之一,铜的使用对早期人类文明的进步影响深远。回答下列问题:
(1)基态Cu2+的价电子排布式为___________ 。
(2)已知铜的某种配合物A的结构如图所示:
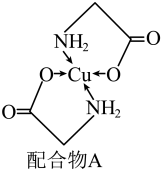
①A中所含的三种元素C、N、O的电负性由大到小的顺序为___________ 。
②配合物中氮原子的杂化轨道类型为___________ 。
③配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,CO2是___________ (填“极性”或“非极性”)分子。
(3)铜盐是自然界中重要的盐,CuSO4中SO 的立体构型为
的立体构型为___________ ;Cu(NO3)2中的化学键类型为___________ 。
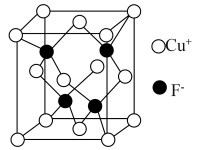
(4)CuF的晶胞结构如图所示。在CuF晶体中距离Cu+最近的F-有___________ 个。已知CuF的密度为7.1g/cm3,则CuF的晶胞参数a=___________ nm(列出计算式)。
(1)基态Cu2+的价电子排布式为
(2)已知铜的某种配合物A的结构如图所示:

①A中所含的三种元素C、N、O的电负性由大到小的顺序为
②配合物中氮原子的杂化轨道类型为
③配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,CO2是
(3)铜盐是自然界中重要的盐,CuSO4中SO
 的立体构型为
的立体构型为(4)CuF的晶胞结构如图所示。在CuF晶体中距离Cu+最近的F-有

您最近一年使用:0次
2023-12-31更新
|
143次组卷
|
2卷引用:2024届青海省协作联考高三上学期一模理综试题
名校
解题方法
7 . 四氟化硅、二氟甲烷(CH2F2)等含氟化合物在生产、生活中有重要的应用。回答下列问题:
(1)基态氟原子核外电子的空间运动状态有___________ 种,核外电子的最高能级符号为___________ ,最高能级电子的电子云形状为___________ 。
(2)F与N可形成化合物N2F2,分子中各原子均满足8电子稳定结构。
①分子中氮原子的杂化方式为___________ 。
②N2F2结构式为___________ ,其分子中。σ键与π键的数目之比为___________ 。
(3)氢氟酸能腐蚀玻璃生成SiF4,SiF4中Si的杂化方式为___________ ,SiF4的空间构型为___________ 。
(4) CH2F2难溶于水,而三氟甲烷(CHF3)可溶于水,其可能的原因是___________ 。
(1)基态氟原子核外电子的空间运动状态有
(2)F与N可形成化合物N2F2,分子中各原子均满足8电子稳定结构。
①分子中氮原子的杂化方式为
②N2F2结构式为
(3)氢氟酸能腐蚀玻璃生成SiF4,SiF4中Si的杂化方式为
(4) CH2F2难溶于水,而三氟甲烷(CHF3)可溶于水,其可能的原因是
您最近一年使用:0次
2023-12-26更新
|
208次组卷
|
5卷引用:青海省海南州高级中学、共和县高级中学2023-2024学年高二上学期期中联考化学试题
名校
解题方法
8 . 下列说法正确的是
A.基态 的核外电子排布式为 的核外电子排布式为 |
B. 中心原子为 中心原子为 杂化,空间构型为三角锥形 杂化,空间构型为三角锥形 |
C. 和 和 都是正四面体形微粒,其键角都为 都是正四面体形微粒,其键角都为 |
D. 分子中所有原子的最外层都满足8电子稳定结构 分子中所有原子的最外层都满足8电子稳定结构 |
您最近一年使用:0次
2023-12-26更新
|
230次组卷
|
3卷引用:青海省海南州高级中学、共和县高级中学2023-2024学年高二上学期期中联考化学试题
9 . 单原子合金成功用于多种异相催化剂的设计,某研究所成功研制出了单原子Bi修饰的Cu催化剂(BiCu一SAA),该催化剂能够在电催化还原CO2的过程中生成C2+而不是生成C1产物。

回答下列问题:
(1)写出基态Cu原子的价电子排布式:_________ 。铜元素的焰色试验呈绿色,下列三种波长为橙、黄、绿色对应的辐射波长,则绿色对应的辐射波长为________ (填标号)。
A.577~492nm B.597~577nm C.622~597nm
(2)与C同周期的p区主族元素第一电离能由大到小的顺序为_______ 。
(3)C2H4、CH3CH2OH中碳原子杂化方式有_______ ,催化还原CO2的过程中可能产生CO ,该离子的空间结构为
,该离子的空间结构为________ 。
(4)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1mol该配合物中含有的π键数目为________ (NA表示阿伏加德罗常数的值)。
(5)晶体铜的晶胞结构如图甲所示,原子之间相对位置关系的平面图如图乙所示,铜原子的配位数为________ ,铜原子的半径为apm,NA表示阿伏加德罗常数的值,晶体铜的密度为_________ (列出计算式即可)g•cm-3。


回答下列问题:
(1)写出基态Cu原子的价电子排布式:
A.577~492nm B.597~577nm C.622~597nm
(2)与C同周期的p区主族元素第一电离能由大到小的顺序为
(3)C2H4、CH3CH2OH中碳原子杂化方式有
 ,该离子的空间结构为
,该离子的空间结构为(4)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1mol该配合物中含有的π键数目为
(5)晶体铜的晶胞结构如图甲所示,原子之间相对位置关系的平面图如图乙所示,铜原子的配位数为

您最近一年使用:0次
解题方法
10 . 据《科学》报道,中国科学家首次利用第V A族元素Bi实现超导体(Bi2Te3/NbSe2 )中分段费米面。回答下列问题:
(1)Bi与As位于同主族,基态As原子的价层电子排布式为_____ ,基态Se原子p能级上共有_________ 个电子。
(2)第二周期元素中,第一电离能介于B、N之间的元素是_________ (填元素符号)。
(3)碲的化合物TeO2、TeO3、H2Te三种物质中, H2Te的中心原子杂化类型为_______ ,分子构型为V形的是________ 。
(4)四氟化铌(NbF4)的熔点为72 °C,它的晶体类型为___________ 。
(5)CdSe是一种重要的半导体材料,其中一种晶体为闪锌矿型结构,晶胞结构如图所示,A点Se原子坐标为( ,
,  ,
, ),B点Cd原子坐标为(1,0,0),则C点Se原子坐标为
),B点Cd原子坐标为(1,0,0),则C点Se原子坐标为_____________________ ;已知晶胞参数为anm,则CdSe的密度为_________________ g·cm-3(列出计算表达式, NA表示阿伏加德罗常数的值)。

(1)Bi与As位于同主族,基态As原子的价层电子排布式为
(2)第二周期元素中,第一电离能介于B、N之间的元素是
(3)碲的化合物TeO2、TeO3、H2Te三种物质中, H2Te的中心原子杂化类型为
(4)四氟化铌(NbF4)的熔点为72 °C,它的晶体类型为
(5)CdSe是一种重要的半导体材料,其中一种晶体为闪锌矿型结构,晶胞结构如图所示,A点Se原子坐标为(
 ,
,  ,
, ),B点Cd原子坐标为(1,0,0),则C点Se原子坐标为
),B点Cd原子坐标为(1,0,0),则C点Se原子坐标为
您最近一年使用:0次



