名校
解题方法
1 . 钴广泛应用于机械制造、电子电器、航空航天、电池制造等行业,是国家重要的战略资源。用含钴废料(主要成分为 ,含少量
,含少量 、
、 、CaO、MgO、
、CaO、MgO、 等)制备草酸钴晶体(
等)制备草酸钴晶体( )的工艺流程如图所示,试回答下列问题:
)的工艺流程如图所示,试回答下列问题:
① 具有强氧化性。
具有强氧化性。
② ,
, 。
。
(1)为提高含钴废料的浸出效率,可采取的措施是___________ (任写一条)。
(2) 在水溶液中的电离方程式为
在水溶液中的电离方程式为___________ ;浸出渣的主要成分为___________ (填化学式)。
(3)向“浸出液”中加入适量的 时,
时, 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(4)①“除钙镁”后,滤液中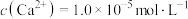 时,
时,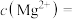
___________  。
。
②若“调pH”时溶液的pH偏低,将会导致 、
、 沉淀不完全,其原因是
沉淀不完全,其原因是___________ 。
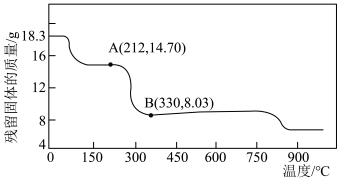
(5)将 在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知:
在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知: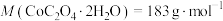 ]
] ,此过程中发生反应的化学方程式为
,此过程中发生反应的化学方程式为___________ 。
 ,含少量
,含少量 、
、 、CaO、MgO、
、CaO、MgO、 等)制备草酸钴晶体(
等)制备草酸钴晶体( )的工艺流程如图所示,试回答下列问题:
)的工艺流程如图所示,试回答下列问题: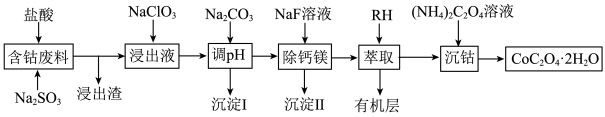
①
 具有强氧化性。
具有强氧化性。②
 ,
, 。
。(1)为提高含钴废料的浸出效率,可采取的措施是
(2)
 在水溶液中的电离方程式为
在水溶液中的电离方程式为(3)向“浸出液”中加入适量的
 时,
时, 发生反应的离子方程式为
发生反应的离子方程式为(4)①“除钙镁”后,滤液中
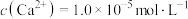 时,
时,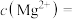
 。
。②若“调pH”时溶液的pH偏低,将会导致
 、
、 沉淀不完全,其原因是
沉淀不完全,其原因是(5)将
 在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知:
在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知: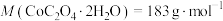 ]
]
 ,此过程中发生反应的化学方程式为
,此过程中发生反应的化学方程式为
您最近一年使用:0次
7日内更新
|
120次组卷
|
5卷引用:2024届青海省西宁市大通县高三下学期高考四模理科综合试卷-高中化学
解题方法
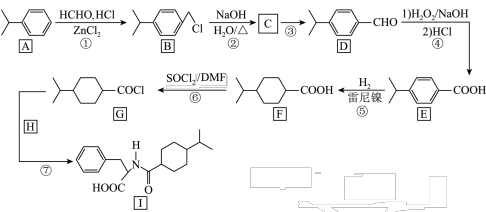
2 . 一种治疗糖尿病药物的合成路线如下(部分反应条件已省略)。
(1)写出有机物Ⅰ中一种含氧官能团的名称:________ 。
(2)反应⑤的反应类型是________ 。
(3)写出反应②的化学方程式:________ 。
(4)H是一种氨基酸,其本身发生聚合反应,所得高分子化合物的结构简式为________ 。
(5)符合下列条件的E的同分异构体有________ 种。
①属于芳香族化合物且苯环上有3个取代基;②既可发生银镜反应,又可发生水解反应。
其中核磁共振氢谱有5组峰,且峰面积之比为6:2:2:1:1的结构简式为________ (写出一种即可)。
(6)参照上述流程,设计以甲醛、甲苯为起始原料制备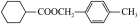 的合成路线如下:
的合成路线如下:________ ,Y的结构简式:________ ,反应条件1:________ 。
(1)写出有机物Ⅰ中一种含氧官能团的名称:
(2)反应⑤的反应类型是
(3)写出反应②的化学方程式:
(4)H是一种氨基酸,其本身发生聚合反应,所得高分子化合物的结构简式为
(5)符合下列条件的E的同分异构体有
①属于芳香族化合物且苯环上有3个取代基;②既可发生银镜反应,又可发生水解反应。
其中核磁共振氢谱有5组峰,且峰面积之比为6:2:2:1:1的结构简式为
(6)参照上述流程,设计以甲醛、甲苯为起始原料制备
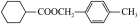 的合成路线如下:
的合成路线如下: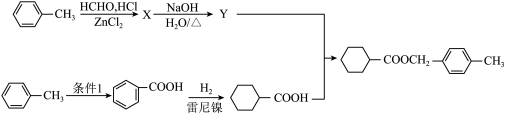
您最近一年使用:0次
解题方法
3 . 航空材料、医药、电池工业的发展都离不开化学。砷化镓(GaAs)、碳化硅等是制作半导体芯片的关键材料,磷酸铁锂( )和三元锂电池(正极含有Ni、Co、Mn三种元素)是新能源汽车的常用电池。回答以下问题:
)和三元锂电池(正极含有Ni、Co、Mn三种元素)是新能源汽车的常用电池。回答以下问题:
(1)基态Ga原子的价层电子排布式为________ 。
(2)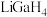 是一种温和的还原剂,可通过反应:
是一种温和的还原剂,可通过反应: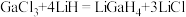 制得。已知
制得。已知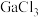 的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为
的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为________ 。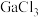 在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:
在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:________ 。
(3) 中四种元素的第一电离能由大到小的顺序是
中四种元素的第一电离能由大到小的顺序是________ (填元素符号),其阴离子的立体构型名称是________ 。
(4)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物 和
和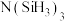 的结构如图所示,
的结构如图所示,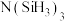 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为________ ,二者中更易与 形成配位键的是
形成配位键的是________ 。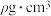 ,晶胞中原子的空间利用率(即晶胞中原子体积占空间体积的百分率为
,晶胞中原子的空间利用率(即晶胞中原子体积占空间体积的百分率为________ 。(用含a、b、p、 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
 )和三元锂电池(正极含有Ni、Co、Mn三种元素)是新能源汽车的常用电池。回答以下问题:
)和三元锂电池(正极含有Ni、Co、Mn三种元素)是新能源汽车的常用电池。回答以下问题:(1)基态Ga原子的价层电子排布式为
(2)
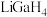 是一种温和的还原剂,可通过反应:
是一种温和的还原剂,可通过反应: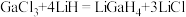 制得。已知
制得。已知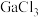 的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为
的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为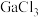 在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:
在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:(3)
 中四种元素的第一电离能由大到小的顺序是
中四种元素的第一电离能由大到小的顺序是(4)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物
 和
和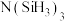 的结构如图所示,
的结构如图所示,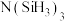 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为 形成配位键的是
形成配位键的是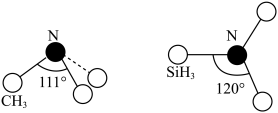
 ,晶胞中原子的空间利用率(即晶胞中原子体积占空间体积的百分率为
,晶胞中原子的空间利用率(即晶胞中原子体积占空间体积的百分率为 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。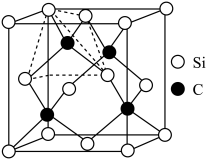
您最近一年使用:0次
解题方法
4 . 工业上利用软锰矿(主要成分为 ,含少量
,含少量 、FeO和
、FeO和 等杂质)和含
等杂质)和含 的烟气为主要原料,制备无水碳酸锰的工艺流程如图所示。
的烟气为主要原料,制备无水碳酸锰的工艺流程如图所示。 难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解,在空气中高温加热所得固体产物为
难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解,在空气中高温加热所得固体产物为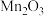 。
。
②不同金属离子生成氢氧化物沉淀的pH如下表:
③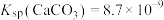 ,
,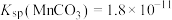 。
。
回答下列问题:
(1)下列说法正确的是________(填序号)。
(2)调节溶液的pH前,加入软锰矿发生“氧化”作用的离子方程式是________ 。
(3)调节pH:加入适量的熟石灰,调节pH=5。充分反应后生成的沉淀有________ 。如果没有前期的“氧化”环节,pH就需要调节到更大的数值,这样会导致________ 。
(4)“沉锰”过程中加入氨水的目的是________ (从化学平衡移动的角度解释)。“沉锰”过程宜在较低温度下进行,可能的原因是________ (写1条即可)。“沉锰”时通过控制合理的pH,就可以控制 的浓度,达到不产生
的浓度,达到不产生 的目的,原因是
的目的,原因是________ 。
 ,含少量
,含少量 、FeO和
、FeO和 等杂质)和含
等杂质)和含 的烟气为主要原料,制备无水碳酸锰的工艺流程如图所示。
的烟气为主要原料,制备无水碳酸锰的工艺流程如图所示。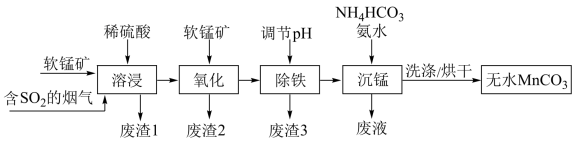
 难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解,在空气中高温加热所得固体产物为
难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解,在空气中高温加热所得固体产物为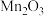 。
。②不同金属离子生成氢氧化物沉淀的pH如下表:
| 离子 |  |  |  |
| 开始沉淀时pH | 2.7 | 7.5 | 7.8 |
| 完全沉淀时pH | 3.7 | 9.7 | 9.8 |
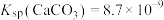 ,
,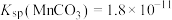 。
。回答下列问题:
(1)下列说法正确的是________(填序号)。
| A.最好使用粉状软锰矿进行“溶浸” | B.废渣1的主要成分和“芯片”相同 |
| C.溶浸时不会发生氧化还原反应 | D.废液经处理可用于灌溉农作物 |
(2)调节溶液的pH前,加入软锰矿发生“氧化”作用的离子方程式是
(3)调节pH:加入适量的熟石灰,调节pH=5。充分反应后生成的沉淀有
(4)“沉锰”过程中加入氨水的目的是
 的浓度,达到不产生
的浓度,达到不产生 的目的,原因是
的目的,原因是
您最近一年使用:0次
名校
解题方法
5 . 亚硝酸钙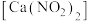 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应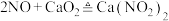 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。 溶液能将NO氧化为
溶液能将NO氧化为 。
。
回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通 ,其目的是
,其目的是________ 。通 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是________ 。
(2)仪器a的名称为________ ,装置D中盛装的试剂是________ (填名称),装置E的作用是________ 。
(3)制备的产品 样品中含有杂质
样品中含有杂质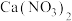 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: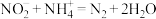 ;“还原
;“还原 ”时加入
”时加入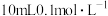 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为________ ,样品中 的纯度为
的纯度为________ (用含m、V的式子表示)。
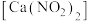 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应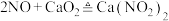 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。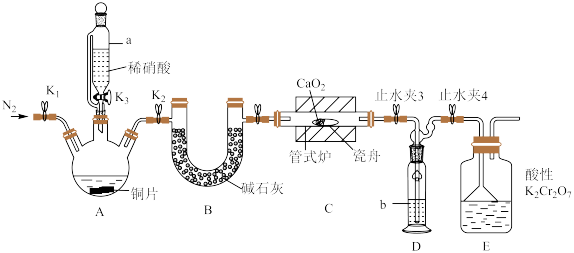
 溶液能将NO氧化为
溶液能将NO氧化为 。
。回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通
 ,其目的是
,其目的是 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是(2)仪器a的名称为
(3)制备的产品
 样品中含有杂质
样品中含有杂质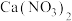 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: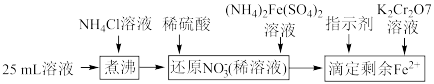
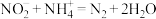 ;“还原
;“还原 ”时加入
”时加入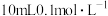 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为 的纯度为
的纯度为
您最近一年使用:0次
2024-05-23更新
|
221次组卷
|
5卷引用:2024届青海省西宁市大通县高三下学期三模理科综合试题-高中化学
6 . 短周期主族元素W、X、Y、Z的原子序数依次增大。其中W、X为同周期相邻元素,X、Z的原子序数之和是X的原子序数的三倍,Z元素原子的最外层电子数是Y元素原子最外层电子数的六倍。下列说法错误的是
A.原子半径: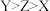 |
B.非金属性: |
| C.Z的最高价氧化物对应的水化物为强酸 |
| D.Y、Z的单质均可在X的单质中燃烧 |
您最近一年使用:0次
名校
解题方法
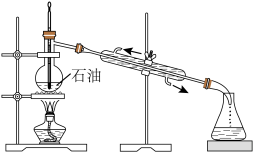
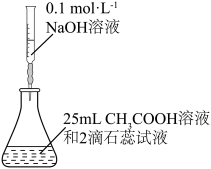
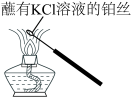
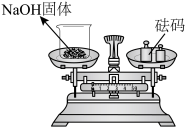
7 . 化学实验操作是进行科学实验的基础。下列操作合理的是
|
|
| A.石油分馏 | B.用NaOH标准溶液滴定未知浓度的 溶液 溶液 |
|
|
| C.观察K元素的焰色 | D.称量NaOH固体 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-05-23更新
|
114次组卷
|
6卷引用:2024届青海省西宁市大通县高三下学期高考四模理科综合试卷-高中化学
名校
解题方法
8 . 常温下,下列各组离子在指定溶液中一定能大量共存的是
A.澄清透明溶液中: 、 、 、 、 、 、 |
B.加入铝能放出氢气的溶液中: 、 、 、 、 、 、 |
C.滴加淀粉-KI溶液显蓝色的溶液中: 、 、 、 、 、 、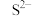 |
D.水电离出的氢离子浓度为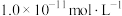 的溶液中: 的溶液中: 、 、 、 、 、 、 |
您最近一年使用:0次
2024-05-22更新
|
90次组卷
|
2卷引用:2024届青海省西宁市大通县高三下学期高考四模理科综合试卷-高中化学
9 . 氢能是一种重要的绿色能源,在实现“碳中和”与“碳达峰”目标中起到重要作用。
Ⅰ.甲醇―水催化重整可获得氢气。
(1)表中数据是该反应中相关物质的标准摩尔生成焓(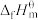 )数据(标准摩尔生成焓是指在298.15K、100kPa下由稳定态单质生成1mol化合物时的焓变)。
)数据(标准摩尔生成焓是指在298.15K、100kPa下由稳定态单质生成1mol化合物时的焓变)。
则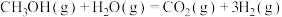 △H=
△H=___________ kJ∙mol-1,该反应在___________ (填“高温”“低温”或“任意温度”)下能自发进行。
Ⅱ.乙醇―水催化重整亦可获得,主要反应如下:
反应①: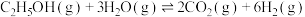
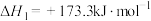
反应②:
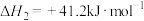
(2)向恒容密闭容器中充入1mol 和3mol
和3mol 发生上述反应①和②,初始时体系压强为100kPa.平衡时
发生上述反应①和②,初始时体系压强为100kPa.平衡时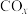 的分布分数
的分布分数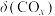 、
、 的产率随温度的变化曲线如图所示。
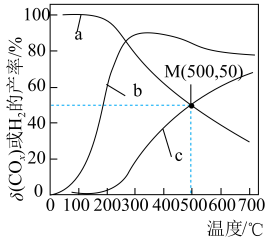
的产率随温度的变化曲线如图所示。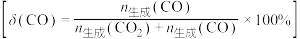
___________ (写出2条)。
②200℃以后,解释曲线a随温度变化趋势的原因:___________ 。
③温度为500℃时,反应经10min达到平衡,此时乙醇的转化率为60%,则0~10min内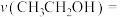
___________ kPa∙min-1,该温度下,反应②的Kp=___________ (保留小数点后两位)。
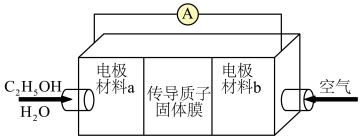
(3)乙醇燃料电池(电极材料a和b均为惰性电极)广泛应用于微型电源、能源汽车、家用电源、国防等领域,工作原理如图所示,写出负极的电极反应式:___________ ,当转移1.2mol电子时,正极消耗的氧气的体积为___________ L(标准状况下)。
Ⅰ.甲醇―水催化重整可获得氢气。
(1)表中数据是该反应中相关物质的标准摩尔生成焓(
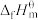 )数据(标准摩尔生成焓是指在298.15K、100kPa下由稳定态单质生成1mol化合物时的焓变)。
)数据(标准摩尔生成焓是指在298.15K、100kPa下由稳定态单质生成1mol化合物时的焓变)。| 物质 |  |  |  |  |
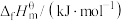 | 0 | ―393.5 | ―241.8 | ―200.7 |
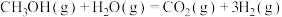 △H=
△H=Ⅱ.乙醇―水催化重整亦可获得,主要反应如下:
反应①:
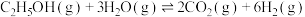
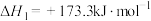
反应②:

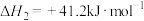
(2)向恒容密闭容器中充入1mol
 和3mol
和3mol 发生上述反应①和②,初始时体系压强为100kPa.平衡时
发生上述反应①和②,初始时体系压强为100kPa.平衡时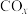 的分布分数
的分布分数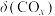 、
、 的产率随温度的变化曲线如图所示。
的产率随温度的变化曲线如图所示。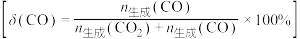
②200℃以后,解释曲线a随温度变化趋势的原因:
③温度为500℃时,反应经10min达到平衡,此时乙醇的转化率为60%,则0~10min内
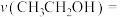
(3)乙醇燃料电池(电极材料a和b均为惰性电极)广泛应用于微型电源、能源汽车、家用电源、国防等领域,工作原理如图所示,写出负极的电极反应式:
您最近一年使用:0次
2024-05-19更新
|
95次组卷
|
4卷引用:2024届青海省部分学校高三下学期模拟考试理综试题-高中化学
名校
解题方法
10 . 物质M转化为物质N的反应如图,下列叙述正确的是

| A.物质M与物质N互为同系物 | B.M中所有的原子可能在同一平面上 |
C.1mol N与碳酸钠反应得44g | D.M、N均能发生加成反应和取代反应 |
您最近一年使用:0次
2024-05-19更新
|
100次组卷
|
2卷引用:2024届青海省部分学校高三下学期模拟考试理综试题-高中化学