解题方法
1 . 根据价层电子对互斥理论及原子的杂化理论判断PCl3分子的空间构型和中心原子的杂化方式为( )
| A.直线形 sp杂化 | B.三角形 sp2杂化 |
| C.三角锥形 sp2杂化 | D.三角锥形 sp3杂化 |
您最近一年使用:0次
解题方法
2 . 下列描述中正确的是( )
| A.CS2 为空间构型为V形的极性分子 |
| B.双原子或多原子形成的气体单质中,一定有σ键,可能有π键 |
| C.氢原子电子云的一个小黑点表示一个电子 |
| D.HCN、SiF4 的中心原子均为sp3杂化 |
您最近一年使用:0次
解题方法
3 . 随新能源汽车的发展,新能源电池技术也在不断创新,典型的锂离子电池一般以LiCoO2或LiFePO4等为正极材料,以石墨碳为负极材料,以溶有LiPF6等的有机溶液为电解质溶液。
(1)P原子的电子排布式为_________ 。Fe2+中未成对电子数为___________ 。
(2)N、O、F原子的第一电离能由小到大的顺序为_______ 。
(3)等电子体具有相似的化学键特征,它们的许多性质是相近的。ClO4-与PO43-互为等电子体,ClO4-的立体构型为_______ ,中心原子的杂化轨道类型为________ 。
(4)烷烃同系物中,CH4的沸点最低,原因是______________ 。
(5)向CuSO4溶液中加入氨水,首先形成蓝色沉淀,继续加氨水,沉淀溶解,得到深蓝色溶液,在此溶液中加入乙醇,析出深蓝色的晶体。由蓝色沉淀得到深蓝色溶液的离子方程式为_______________ ;深蓝色晶体中存在的化学键类型有__________ 。(填代号)
A.离子键
B.σ键
C.非极性共价键
D.配位键
E.金属键
F.氢键
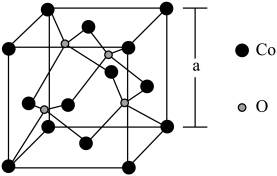
(6)如图所示为Co的某种氧化物的晶胞结构图,则该氧化物的化学式为______ ;若该晶胞的棱长为a pm,则该晶体的密度为_____________ g/cm3。(NA为阿伏加 德罗常数的值)
(1)P原子的电子排布式为
(2)N、O、F原子的第一电离能由小到大的顺序为
(3)等电子体具有相似的化学键特征,它们的许多性质是相近的。ClO4-与PO43-互为等电子体,ClO4-的立体构型为
(4)烷烃同系物中,CH4的沸点最低,原因是
(5)向CuSO4溶液中加入氨水,首先形成蓝色沉淀,继续加氨水,沉淀溶解,得到深蓝色溶液,在此溶液中加入乙醇,析出深蓝色的晶体。由蓝色沉淀得到深蓝色溶液的离子方程式为
A.离子键
B.σ键
C.非极性共价键
D.配位键
E.金属键
F.氢键
(6)如图所示为Co的某种氧化物的晶胞结构图,则该氧化物的化学式为

您最近一年使用:0次
2020-03-04更新
|
245次组卷
|
3卷引用:内蒙古自治区阿拉善盟2020届高三上学期一模化学试题
名校
解题方法
4 . (1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有 NOx、HCOOH、 (PAN)等二次污染物。
(PAN)等二次污染物。
①1mol PAN中含有的σ键数目为_______ 。PAN中除H外其余三种元素的第一电离能由大到小的顺序为_________________ 。
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中中心离子的配位数为_______ ,中心离子的核外电子排布式为_______ 。
③相同压强下,HCOOH 的沸点比 CH3OCH3_______ (填高或低),其原因是_______ 。
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
①(NH4)2SO4 晶体中各种微粒间的作用力不涉及_______ (填序号)。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
②NH4NO3中阳离子的空间构型为_____ ,阴离子的中心原子轨道采用_______ 杂化。
(3)测定大气中 PM2.5的浓度方法之一是 β-射线吸收法,β-射线放射源可用85Kr。已知 Kr晶体的晶胞结构如图所示,设晶体中与每个 Kr 原子紧相邻的 Kr原子有m个,晶胞中Kr 原子为n个,则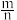 =
=______ (填数字)。
 (PAN)等二次污染物。
(PAN)等二次污染物。①1mol PAN中含有的σ键数目为
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中中心离子的配位数为
③相同压强下,HCOOH 的沸点比 CH3OCH3
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
①(NH4)2SO4 晶体中各种微粒间的作用力不涉及
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
②NH4NO3中阳离子的空间构型为
(3)测定大气中 PM2.5的浓度方法之一是 β-射线吸收法,β-射线放射源可用85Kr。已知 Kr晶体的晶胞结构如图所示,设晶体中与每个 Kr 原子紧相邻的 Kr原子有m个,晶胞中Kr 原子为n个,则
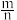 =
=
您最近一年使用:0次
解题方法
5 . E、G、M、Q、T是五种原子序数依次增大的前四周期元素。E、G、M是位于p区的同一周期的元素,M的价层电子排布为ns2np2n,E与M原子核外的未成对电子数相等;QM2与GM2−具有相等的价电子总数;T为过渡元素,其原子核外没有未成对电子。请回答下列问题:
(1)T元素原子的价电子排布式是___ 。
(2)E、G、M三种元素的第一电离能由大到小的顺序为___ (用元素符号表示),其原因为___ 。
(3)G的最简单氢化物的分子立体构型名称为___ ,M的最简单氢化物的分子中中心原子的杂化类型为___ 。M和Q的最简单氢化物的沸点大小顺序为___ (写化学式)。
(4)TQ在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方TQ晶体结构如图所示,该晶体的密度为pg·cm−3。如果TQ的摩尔质量为Mg·mol−1,阿伏加 德罗常数为NAmol−1,则a、b之间的距离为___ cm。
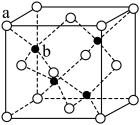
(1)T元素原子的价电子排布式是
(2)E、G、M三种元素的第一电离能由大到小的顺序为
(3)G的最简单氢化物的分子立体构型名称为
(4)TQ在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方TQ晶体结构如图所示,该晶体的密度为pg·cm−3。如果TQ的摩尔质量为Mg·mol−1,阿伏加 德罗常数为NAmol−1,则a、b之间的距离为

您最近一年使用:0次
10-11高二下·山西晋中·期中
名校
6 . 下列分子和离子中中心原子价层电子对几何构型为四面体且分子或离子空间的构型为V形的是( )
| A.NH4+ | B.PH3 | C.H3O+ | D.OF2 |
您最近一年使用:0次
2019-09-14更新
|
475次组卷
|
24卷引用:2015-2016学年内蒙古元平煤高中高二实验班下期中化学卷
2015-2016学年内蒙古元平煤高中高二实验班下期中化学卷(已下线)2010—2011学年山西省平遥中学高二下学期期中考试化学试卷(已下线)2011-2012学年甘肃省甘谷一中高二下学期第二次月考化学试卷2015-2016学年江苏省泰州中学高二下第一次质检化学试卷2016-2017学年宁夏育才中学孔德校区高二下学期第一次(3月)月考化学试卷广西宾阳县宾阳中学2016-2017学年高二下学期7月期末考试化学试题河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:2.2 第1课时人教版2017-2018学年高二化学选修三同步训练:2.2 分子的立体构型(第1课时)云南省曲靖市宣威市第三中学2017-2018学年高二下学期3月月考化学试题福建省长汀一中2017-2018学年高二实验班下学期第一次月考化学试题山西省祁县中学2017-2018学年高二4月月考化学试题(已下线)2019年3月7日 《每日一题》人教选修3-价层电子对互斥理论的应用云南省玉溪市元江县第一中学2018-2019学年高二下学期开学考试化学试题【全国百强校】宁夏回族自治区育才中学勤行校区2018-2019学年高二下学期3月月考化学试题宁夏回族自治区银川市长庆高级中学2018-2019学年高二下学期第二次月考化学试题吉林省汪清县第六中学2018-2019学年高二6月月考化学试题【市级联考】新疆维吾尔自治区乌鲁木齐市2018-2019学年高二下学期期末考试化学试题吉林省松原市前郭尔罗斯蒙古族自治县蒙古族中学2019-2020学年高二下学期网课质量检测化学试题鲁科版2019选择性必修2第2章 微粒间相互作用与物质性质 第2节 共价键与分子的空间结构 第1课时 分子空间结构的理论分析甘肃省兰州二十七中学2020-2021学年高二下学期期中考试化学试题(已下线)课时55 分子结构与性质-2022年高考化学一轮复习小题多维练(全国通用)河南省驻马店市环际大联考2021-2022学年高二下学期期中考试化学试题(已下线)第40练 分子的空间结构-2023年高考化学一轮复习小题多维练(全国通用)福建省龙岩市长汀县第一中学2021-2022学年高二下学期第一次月考化学试题
7 . 磷、硫、氯、砷等是农药中的重要组成元素。回答下列问题:
(1)基态砷原子的核外价电子排布式为___________ 。
(2)生产农药的原料PSCl3中P、S、Cl的第一电离能由大到小的顺序为________ ,电负性由大到小的顺序为________________________ 。
(3)H2O 与H2S为同族元素的氢化物,H2O可以形成H3O+或H9O4+等,而H2S几乎不能形成类似的H3S+或H9S4+,其原因是______________________ 。
(4)COS(羰基硫)可用作粮食的熏蒸剂,其中碳原子的杂化轨道类型为_____________ ,所含共价键的类型为_____________ ,N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,则N2O的电子式为_____________________ 。
(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃ ,其晶胞结构如图所示。

①磷化铝的晶体类型为_____________ 。
②A、B点的原子坐标如图所示,则C点的原子坐标为_____________ 。
③磷化铝的晶胞参数a=546.35pm,其密度为_____________ (列出计算式即可,用NA表示阿伏伽德罗常数的数值)g/cm3。
(1)基态砷原子的核外价电子排布式为
(2)生产农药的原料PSCl3中P、S、Cl的第一电离能由大到小的顺序为
(3)H2O 与H2S为同族元素的氢化物,H2O可以形成H3O+或H9O4+等,而H2S几乎不能形成类似的H3S+或H9S4+,其原因是
(4)COS(羰基硫)可用作粮食的熏蒸剂,其中碳原子的杂化轨道类型为
(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃ ,其晶胞结构如图所示。

①磷化铝的晶体类型为
②A、B点的原子坐标如图所示,则C点的原子坐标为
③磷化铝的晶胞参数a=546.35pm,其密度为
您最近一年使用:0次
名校
解题方法
8 . 二氟草酸硼酸锂[LiBF2(C2O4)]是新型锂离子电池电解质,乙酸锰(CH3COO)3Mn]可用于制造离子电池的负极材料。合成方程式如下:
2H2C2O4+SiC14+2LiBF4==2LiBF2(C2O4)+SiF4+4HCl
4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40 CH3COOH
(1)基态Mn原子的核外电子排布式为_________ 。
(2)草酸(HOOCCOOH)分子中碳原子轨道的杂化类型是___________ ,1mol草酸分子中含有 键的数目为
键的数目为_______________ 。
(3)与SiF4互为等电子体的两种阴离子的化学式为_________________ 。
(4)CH3COOH易溶于水,除了它是极性分子外,还因为___________________ 。
(5)向硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子的原因是_______________ 。

(6)硼氢化钠的晶胞结构如图所示,该晶胞中Na+的配位数为___________ ,若硼氢化钠晶体的密度为d g/cm3,NA表示阿伏伽德罗常数的值,则a=______ (用含d、NA的代数式表示);若硼氢化钠晶胞上、下底心处的Na+被Li+取代,则得到晶体的化学式为___________________ 。
2H2C2O4+SiC14+2LiBF4==2LiBF2(C2O4)+SiF4+4HCl
4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40 CH3COOH
(1)基态Mn原子的核外电子排布式为
(2)草酸(HOOCCOOH)分子中碳原子轨道的杂化类型是
 键的数目为
键的数目为(3)与SiF4互为等电子体的两种阴离子的化学式为
(4)CH3COOH易溶于水,除了它是极性分子外,还因为
(5)向硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子的原因是

(6)硼氢化钠的晶胞结构如图所示,该晶胞中Na+的配位数为
您最近一年使用:0次
2019-04-08更新
|
567次组卷
|
3卷引用:内蒙古通辽市重点学校2022-2023学年高二下学期3月质量检测化学试题
9-10高二下·黑龙江·期末
名校
解题方法
9 . 下列关于丙烯(CH3—CH=CH2)的说法错误的是( )
| A.丙烯分子有8个σ键,1个π键 | B.丙烯分子中3个碳原子都是sp3杂化 |
| C.丙烯分子存在非极性键 | D.丙烯分子中3个碳原子在同一平面上 |
您最近一年使用:0次
2019-01-30更新
|
588次组卷
|
12卷引用:内蒙古通辽市2019-2020学年高二下学期期中考试化学试题
内蒙古通辽市2019-2020学年高二下学期期中考试化学试题(已下线)09—10年哈三中高二下学期期末考试化学卷(已下线)2010-2011学年江西省新建二中高二下学期期末考试化学试卷(已下线)2011-2012年四川省成都市六校协作体高二上学期期中考试化学试卷(已下线)2011-2012学年江苏省泰州中学高二上学期期中考试化学(选修)试卷(已下线)2011-2012学年四川省雅安中学高二12月月考化学试卷(已下线)2011-2012学年湖北省襄阳市高二下学期四校联考期中考试化学试卷(已下线)2012-2013学年湖北省孝感高级中学高二上学期期末考试化学试卷辽宁省部分重点高中2020-2021学年高二下学期期中考试化学试题(已下线)专题17 烃-2023年高考化学一轮复习小题多维练(全国通用)黑龙江省大庆市东风中学2021-2022学年高二下学期期末考试化学试题福建省上杭县第五中学、才溪中学2020-2021学年高二下学期期中联考化学试题
10 . 氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
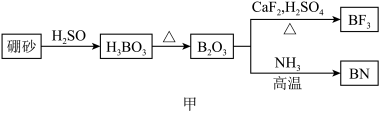
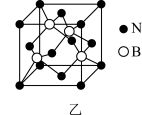
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是_________ 、__________ ;
(2)基态B原子的电子排布式为_________ ;B和N相比,电负性较大的是_________ ,BN中B元素的化合价为_________ ;
(3)在BF3分子中,F-B-F的建角是_______ ,B原子的杂化轨道类型为_______ ,BF3和过量NaF作用可生成NaBF,BF 的立体结构为
的立体结构为_______ ;
(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________ ,层间作用力为________ ;
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有______ 各氮原子、________ 各硼原子,立方氮化硼的密度是_______ g· (只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。


请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是
(2)基态B原子的电子排布式为
(3)在BF3分子中,F-B-F的建角是
 的立体结构为
的立体结构为(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有
 (只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
您最近一年使用:0次
2019-01-30更新
|
2640次组卷
|
14卷引用:内蒙古阿拉善左旗高级中学2017-2018学年高二下学期期末考试化学试题
内蒙古阿拉善左旗高级中学2017-2018学年高二下学期期末考试化学试题2011年普通高等学校招生全国统一考试化学卷(新课标)(已下线)2012-2013学年吉林省龙井市三中高二下学期期中考试化学试卷(已下线)2012-2013学年河南灵宝第三高级中学高二下学期第三次检测化学卷(已下线)2014高考名师推荐化学选做题练习22016届重庆市部分中学高三上学期第一次月考化学试卷2015-2016学年贵州省思南中学高二下第二次月考化学试卷2016-2017学年高中化学选修3(人教版)第三章 晶体结构与性质 章末检测贵州省遵义育新高级中学2018-2019学年高二上学期11月月考化学试题云南省彝良县民族中学2018-2019学年高二上学期12月份考试化学试题云南省武定县第一中学2018-2019学年高二上学期12月份考试化学试题云南省昭通水田新区中学2018-2019学年高二上学期12月月考化学试题云南省凤庆县第一中学2019-2020学年高二12月月考化学试题云南省梁河县第一中学2019-2020学年高二上学期期末考试化学试题



