名校
解题方法
1 . 铁、钴、镍都属于第VIII族元素,它们的单质、合金及其化合物在催化剂和能源领域用途非常广泛。
(1)结合电子排布式分析Fe3+比Co3+氧化性弱的原因:_______________________________ 。
(2)BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①CTCN的化学式为[Co(NH3)4CO3]NO3,与Co3+形成配位键的原子是____________ 。(已知 的结构式为
的结构式为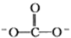 )
)
②NaNT可以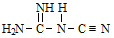 (双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为
(双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为________ ,1mol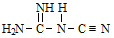 中含有σ键的物质的量为
中含有σ键的物质的量为___________ 。
③[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为_________________ 。
(3)一种新型的功能材料的晶胞结构如图1所示,它的化学式可表示为________ 。晶胞中离1个Mn原子最近的Ni原子有________ 个。
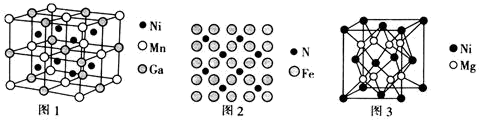
(4)铁触媒是合成氨反应的催化剂,其表面存在氮原子。氮原子在铁表面上的单层附着,局部示意图如图2所示。则铁表面上氮原子与铁原子的数目比为________ 。
(5)镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图3所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm。则镍镁晶体未储氢时的密度为________ g/cm3(列出计算表达式,NA表示阿伏加 德罗常数的数值).
(1)结合电子排布式分析Fe3+比Co3+氧化性弱的原因:
(2)BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①CTCN的化学式为[Co(NH3)4CO3]NO3,与Co3+形成配位键的原子是
 的结构式为
的结构式为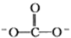 )
)②NaNT可以
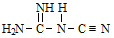 (双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为
(双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为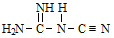 中含有σ键的物质的量为
中含有σ键的物质的量为③[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为
(3)一种新型的功能材料的晶胞结构如图1所示,它的化学式可表示为

(4)铁触媒是合成氨反应的催化剂,其表面存在氮原子。氮原子在铁表面上的单层附着,局部示意图如图2所示。则铁表面上氮原子与铁原子的数目比为
(5)镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图3所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm。则镍镁晶体未储氢时的密度为
您最近一年使用:0次
名校
解题方法
2 . 碳、氮和磷元素是几乎所有的生物体中均含有的生命元素。回答下列问题:
(1)叠氮酸(HN3)是一种弱酸,在水中能微弱电离出H+和 ,分子中的大Π键可用符号
,分子中的大Π键可用符号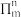 表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为
表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为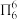 ,则
,则 中的大Π键应表示为
中的大Π键应表示为__________________ 。
(2)2001年德国专家从硫酸铵中检出一种组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以 和
和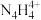 两种离子的形式存在。
两种离子的形式存在。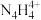 中N原子均为sp3杂化,请推测
中N原子均为sp3杂化,请推测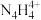 的结构式:
的结构式:_______________________ 。
(3)氨(NH3)和膦(PH3)是两种三角锥形气态氢化物,其键角分别为107°和93.6°,试分析PH3的键角小于NH3的原因:____________________________ 。
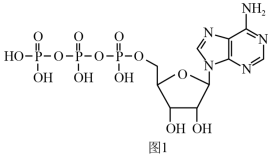
(4)ATP(三磷酸腺苷)是一种高能磷酸化合物,在细胞中,它与ADP的相互转化实现贮能和放能,从而保证了细胞各项生命活动的能量供应。ATP的结构简式如图1所示。
 分子中属于sp2杂化的N原子有
分子中属于sp2杂化的N原子有_______________ 个。
(5)某种磁性氮化铁的晶胞结构如图2所示。

①基态Fe原子的电子排布式为______________________ 。
②该化合物的化学式为___________________________ 。
③若晶胞底边长为anm,高为cnm,NA为阿伏加 德罗常数的值,则该磁性氮化铁的晶体密度为__________________ g.cm-3(用含a、c、NA的代数式表示)。
(1)叠氮酸(HN3)是一种弱酸,在水中能微弱电离出H+和
 ,分子中的大Π键可用符号
,分子中的大Π键可用符号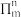 表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为
表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为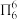 ,则
,则 中的大Π键应表示为
中的大Π键应表示为(2)2001年德国专家从硫酸铵中检出一种组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以
 和
和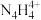 两种离子的形式存在。
两种离子的形式存在。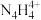 中N原子均为sp3杂化,请推测
中N原子均为sp3杂化,请推测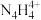 的结构式:
的结构式:(3)氨(NH3)和膦(PH3)是两种三角锥形气态氢化物,其键角分别为107°和93.6°,试分析PH3的键角小于NH3的原因:
(4)ATP(三磷酸腺苷)是一种高能磷酸化合物,在细胞中,它与ADP的相互转化实现贮能和放能,从而保证了细胞各项生命活动的能量供应。ATP的结构简式如图1所示。
 分子中属于sp2杂化的N原子有
分子中属于sp2杂化的N原子有(5)某种磁性氮化铁的晶胞结构如图2所示。

①基态Fe原子的电子排布式为
②该化合物的化学式为
③若晶胞底边长为anm,高为cnm,NA为阿伏加 德罗常数的值,则该磁性氮化铁的晶体密度为
您最近一年使用:0次
解题方法
3 . 有四种短周期元素,它们的结构、性质等信息如下表所示:
请根据表中信息填写:
(1)B原子的简化电子排布式_____ 。
(2)A元素在周期表中的位置_____ ;离子半径:A_____ B(填>、=或< )。
(3)E原子的价电子排布图是____ ,其原子核外有______ 个未成对电子,能量最高的电子为_____ 轨道上的电子,其轨道呈_____ 形。
(4)D原子的外围电子排布式为____ ,D-的离子结构示意图是_____ 。
(5)C、E元素的第一电离能的大小关系是_____ (用元素符号表示,下同)。
(6)已知CD3分子中D元素为+1价,则C、D的电负性大小关系是____ ,CD3的中心原子杂化轨道类型是___ ,CD3与水反应的化学方程式是_____ 。
| 元素 | 结构、性质等信息 |
| A | 是元素周期表中(除稀有气体外)原子半径最大的元素,该元素某种合金是原子反应堆导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
| E | L层上有2对成对电子 |
(1)B原子的简化电子排布式
(2)A元素在周期表中的位置
(3)E原子的价电子排布图是
(4)D原子的外围电子排布式为
(5)C、E元素的第一电离能的大小关系是
(6)已知CD3分子中D元素为+1价,则C、D的电负性大小关系是
您最近一年使用:0次
名校
解题方法
4 . 以氮化镓(GaN)、砷化镓(GaAs)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点,如砷化镓灯泡寿命是普通灯泡的100倍,而耗能仅为10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。请回答下列问题:
(1)镓为元素周期表第31号元素,基态镓原子的电子排布式为___________ ,核外电子占据最高能层符号为________ 。
(2)氮化镓与金刚石具有相似的晶体结构,氮化镓中氮原子与镓原子之间以_______ 键相结合,氮化镓属于_______ 晶体。
(3)下列说法正确的是_______
A.第一电离能:As < Ga B.砷和镓都属于p区元素
C.电负性:As < Ga D.半导体GaP、SiC与砷化镓为等电子体
(4)①砷化镓是将(CH3)3Ga和AsH3用MOCVD(金属有机物化学气相淀积)方法制备得到的,该反应在700℃进行,反应的方程式为:____________________ 。
②反应物AsH3分子的几何构型为_______ ,(CH3)3Ga中镓原子杂化方式为___ 。
(1)镓为元素周期表第31号元素,基态镓原子的电子排布式为
(2)氮化镓与金刚石具有相似的晶体结构,氮化镓中氮原子与镓原子之间以
(3)下列说法正确的是
A.第一电离能:As < Ga B.砷和镓都属于p区元素
C.电负性:As < Ga D.半导体GaP、SiC与砷化镓为等电子体
(4)①砷化镓是将(CH3)3Ga和AsH3用MOCVD(金属有机物化学气相淀积)方法制备得到的,该反应在700℃进行,反应的方程式为:
②反应物AsH3分子的几何构型为
您最近一年使用:0次
解题方法
5 . 由 H、B、C、N、O、F 等元素通过共价键形成的物质在工业生产中有广泛的应用。回答下列问题:
(1)氧原子核外有_____ 种不同运动状态的电子,有_______ 种不同能量的原子轨道。
(2)Bi 是 N 的同主族元素,与 N 原子相差 4 个电子层,基态 Bi 原子的价电子轨道排布图为______ 。
(3)C2H4与N2H4在水中的溶解度相差很大, 出现这种现象的主要原因是__________ 。
(4)H2C2O4分子中碳原子的杂化类型是_________ ,写出一种与 C2O42-互为等电子体的分子的化学式_______________ 。
(5)NaHF2可用于制无水氟化氢和雕刻玻璃、木材防腐等。常温常压下为白色固体,易溶于水,160℃分解,NaHF2中所含作用力的类型有___________ (填字母)。
a 离子键 b 共价键 c 配位键 d 氢键
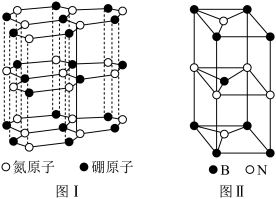
(6)六方氮化硼晶体结构如图 I 所示,氮化硼的化学式为______ 在其晶胞(图Ⅱ所示)中层内 BN 核间距为 apm,层间 BN 核间距为bpm,其密度为______ g·cm -3(阿伏加 德罗常数的值为 NA,用含 a、b、NA的代数式表示)
(1)氧原子核外有
(2)Bi 是 N 的同主族元素,与 N 原子相差 4 个电子层,基态 Bi 原子的价电子轨道排布图为
(3)C2H4与N2H4在水中的溶解度相差很大, 出现这种现象的主要原因是
(4)H2C2O4分子中碳原子的杂化类型是
(5)NaHF2可用于制无水氟化氢和雕刻玻璃、木材防腐等。常温常压下为白色固体,易溶于水,160℃分解,NaHF2中所含作用力的类型有
a 离子键 b 共价键 c 配位键 d 氢键
(6)六方氮化硼晶体结构如图 I 所示,氮化硼的化学式为

您最近一年使用:0次
2020-05-25更新
|
90次组卷
|
2卷引用:内蒙古鄂尔多斯市2020届高考模拟试卷理科综合化学试题
6 . 钴、铁、镓、砷的单质及其化合物在生产生活中有重要的应用。回答下列问题:
(1)写出Fe的基态原子的电子排布式_________________ 。
(2)N、P、As为同一主族元素,其电负性由大到小的顺序为____________________ ,它们的氢化物沸点最高的是____________ 。其原因是__________ ,将NaNO3和Na2O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,则该阴离子的化学式是_____________ 。
(3)Fe3+、Co3+与N3-、CN-等可形成络合离子。
①K3[Fe(CN)6]可用于检验Fe2+,配体CN-中碳原子杂化轨道类型为______________ 。
②[Co(N3)(NH3)5]SO4中Co的配位数为____________ ,其配离子中含有的化学键类型为_______ (填离子键、共价键、配位键),C、N、O 的第一电离能最大的为_______ ,其原因是_____________________ 。

(4)砷化镓晶胞结构如图。晶胞中Ga与周围等距且最近的As形成的空间构型为________ 。已知砷化镓晶胞边长为apm,其密度为pg·cm-3,则阿伏加 德罗常数的数值为__________________ (列出计算式即可)。
(1)写出Fe的基态原子的电子排布式
(2)N、P、As为同一主族元素,其电负性由大到小的顺序为
(3)Fe3+、Co3+与N3-、CN-等可形成络合离子。
①K3[Fe(CN)6]可用于检验Fe2+,配体CN-中碳原子杂化轨道类型为
②[Co(N3)(NH3)5]SO4中Co的配位数为

(4)砷化镓晶胞结构如图。晶胞中Ga与周围等距且最近的As形成的空间构型为
您最近一年使用:0次
7 . 2017年4月26日,中田首艘国产航母在大连正式下水,标志着我国自主设计航空母舰取得重大阶段性成果。请回答下列问题:
(1)航母用钢可由低硅生铁冶炼而成。
①硅原子L能层的电子分布图为____________________ ;
②Fe3+比Fe2+稳定的原因是_____________________ ;
③铁氰化钾K3[Fe(CN)6]溶液可以检验Fe2+。1 mol CN-中含有π键的数为_________ ,与CN-互为等电子体的分子有__________ (写出一种),铁氰化钾晶体中各种微粒间相互作用不包括_______________ ;
a. 离子键 b. 共价键 c.配位键 d. 金属键 e. 氢键 f. 范德华力
(2)航母螺旋桨主要用铜合金制造。含铜废液可以利用铜萃取剂M,通过如下反应实现铜离子的富集,进行回收。
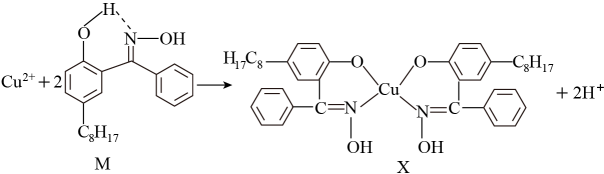
①M所含元素的电负性由大到小的顺序为__________ (用元素符号表示);
②X中采用sp3杂化的非金属原子有___________ (填写元素名称),采用sp3杂化的原子有__________ 个;
(3)Fe3O4是Fe3+、Fe2+、O2-通过离子键而组成的复杂离子晶体。O2-的重复排列方式如图所示,已知该晶体的晶胞参数为a nm,密度为b g/cm3,则NA=__________ mol-1。(列出含a、b的计算式)
 (白球表示O2-)
(白球表示O2-)
(1)航母用钢可由低硅生铁冶炼而成。
①硅原子L能层的电子分布图为
②Fe3+比Fe2+稳定的原因是
③铁氰化钾K3[Fe(CN)6]溶液可以检验Fe2+。1 mol CN-中含有π键的数为
a. 离子键 b. 共价键 c.配位键 d. 金属键 e. 氢键 f. 范德华力
(2)航母螺旋桨主要用铜合金制造。含铜废液可以利用铜萃取剂M,通过如下反应实现铜离子的富集,进行回收。

①M所含元素的电负性由大到小的顺序为
②X中采用sp3杂化的非金属原子有
(3)Fe3O4是Fe3+、Fe2+、O2-通过离子键而组成的复杂离子晶体。O2-的重复排列方式如图所示,已知该晶体的晶胞参数为a nm,密度为b g/cm3,则NA=
 (白球表示O2-)
(白球表示O2-)
您最近一年使用:0次
2020-05-12更新
|
163次组卷
|
2卷引用:内蒙古赤峰市2020届高三四月模拟理综化学试题
解题方法
8 . 有U、V、W、X、Y、Z六种前四周期元素,原子序数依次增大,其相关信息如下表:
请回答下列问题:
(1)W、X、V第一电离能由大到小顺序:________________________ (用元素符号表示)
(2)V的最高价氧化物对应含氧酸中,酸根的立体构型为:_________ ,中心原子的杂化方式为:_______________ ;
(3)Y的基态原子的价电子排布图为____________________________ ;
(4)乙和丙分别是V和X的氢化物,这两种氢化物分子中都含有10个电子。两者沸点的关系为乙______ 丙(填“>”或“<”),原因是__________________________________________ ;
(5)V与W原子结合形成的V3W4晶体,其硬度比金刚石大,则V3W4晶体中属于____________ 晶体
| 元素编号 | 相关信息比 |
| U | 所处的周期数、族序数分别与其原子序数相等 |
| V | 基态时,电子分布在三个能级上,且各能级中电子数相等 |
| W | 基态时, 2p 轨道处于半充满状态 |
| X | 自然界中含量最多 |
| Y | 是第四周期元素中未成对电子数最多的元素 |
请回答下列问题:
(1)W、X、V第一电离能由大到小顺序:
(2)V的最高价氧化物对应含氧酸中,酸根的立体构型为:
(3)Y的基态原子的价电子排布图为
(4)乙和丙分别是V和X的氢化物,这两种氢化物分子中都含有10个电子。两者沸点的关系为乙
(5)V与W原子结合形成的V3W4晶体,其硬度比金刚石大,则V3W4晶体中属于
您最近一年使用:0次
解题方法
9 . 硫及其化合物有许多用途。相关物质的物理常数如表所示:
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______ ,基态S原子电子占据最高能级的电子云轮廓图为______ 形。
(2)根据价层电子对互斥理论,H2S,SO2,SO3的气态分子中,中心原子价层电子对数不同于其他分子的是______ 。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为____ 。
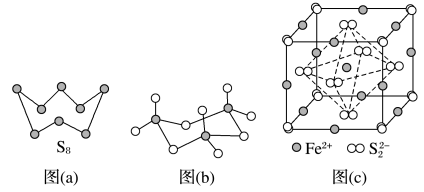
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为______ 形,其中共价键的类型有______ 种;固体三氧化硫中存在如图(b)所示的三聚分子。该分子中S原子的杂化轨道类型为______ 。
(5)FeS2晶体的晶胞如图(c)所示,该晶胞中FeS2个数___________ ,晶胞边长为anm,FeS2相对式量为M、阿伏加 德罗常数的值为NA,其晶体密度的计算表达式为_____ g/cm3.(写出表达式) ;晶胞中Fe2+位于S22-所形成的八面体的体心,该正八面体的边长为______ nm。
| H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
| 熔点/℃ | -85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
| 沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为
(2)根据价层电子对互斥理论,H2S,SO2,SO3的气态分子中,中心原子价层电子对数不同于其他分子的是
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为
(5)FeS2晶体的晶胞如图(c)所示,该晶胞中FeS2个数
您最近一年使用:0次
解题方法
10 . 下列有关说法不正确的是( )
| A.C2H6中碳原子都采用的是sp3杂化 |
| B.O2、CO2、N2都是非极性分子 |
| C.酸性:H2CO3<H3PO4<H2SO4<HClO |
D.CO的一种等电子体为NO+,它的电子式为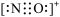 |
您最近一年使用:0次



