名校
解题方法
1 . 回答下列问题。
(1)下列几种氢键由强到弱的顺序为___________ (填字母)。
a.O-H…O b.N-H…N c.F-H…F d.O-H…N
(2)①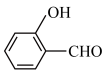 的沸点比
的沸点比 的沸点低,原因是
的沸点低,原因是___________ 。
②水和乙酸以任意比例互溶,除因为他们都是极性分子外,还因为___________ 。
(3)BF3与一定量水形成(H2O)·BF3晶体Q(结构如图所示),晶体Q中各微粒之间的作用力不涉及___________ (填序号)。

a.离子键 b.共价键 c.配位键 d.氢键 e.范德华力
(4)类卤素离子SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是
N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是___________ (填物质名称)。
(5)离子液体是一种只由离子组成的液体,在低温下也能以液态稳定存在,是一种很有研究价值的溶剂。最常见的离子液体主要由阴离子AlCl 和以下的正离子组成。
和以下的正离子组成。

①图中正离子有令人惊奇的稳定性,它的电子在其环状结构中高度离域。该正离子中N原子的杂化方式为___________ 。
②为了使正离子以单个形式存在,正离子间不发生聚集,所以与N原子相连的—CH不能被H原子替换,原因是___________ 。
(1)下列几种氢键由强到弱的顺序为
a.O-H…O b.N-H…N c.F-H…F d.O-H…N
(2)①
 的沸点比
的沸点比 的沸点低,原因是
的沸点低,原因是②水和乙酸以任意比例互溶,除因为他们都是极性分子外,还因为
(3)BF3与一定量水形成(H2O)·BF3晶体Q(结构如图所示),晶体Q中各微粒之间的作用力不涉及

a.离子键 b.共价键 c.配位键 d.氢键 e.范德华力
(4)类卤素离子SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C
 N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是
N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是(5)离子液体是一种只由离子组成的液体,在低温下也能以液态稳定存在,是一种很有研究价值的溶剂。最常见的离子液体主要由阴离子AlCl
 和以下的正离子组成。
和以下的正离子组成。
①图中正离子有令人惊奇的稳定性,它的电子在其环状结构中高度离域。该正离子中N原子的杂化方式为
②为了使正离子以单个形式存在,正离子间不发生聚集,所以与N原子相连的—CH不能被H原子替换,原因是
您最近半年使用:0次
名校
2 . 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:

(1)元素p为26号元素,请写出其基态原子的电子排布式___________ ,该元素的价电子排布图___________ 。
(2)d与a的单质反应生成的产物分子中,中心原子的杂化形式为___________ ,分子空间构型为___________ 。d、e元素分别形成的两种简单氢化物中键角较大的是___________ ,原因是___________ 。
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:___________ 。
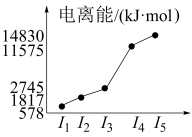
(4)o、p两元素的部分电离能数据列于下表:
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此你的解释是___________ 。
(5)表中所列的某主族元素的电离能情况如图所示,则该元素是___________ (填元素符号)。

(1)元素p为26号元素,请写出其基态原子的电子排布式
(2)d与a的单质反应生成的产物分子中,中心原子的杂化形式为
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:
(4)o、p两元素的部分电离能数据列于下表:
| 元素 | o | p | |
电离能 |  | 717 | 759 |
 | 1509 | 1561 | |
 | 3248 | 2957 | |
(5)表中所列的某主族元素的电离能情况如图所示,则该元素是

您最近半年使用:0次
3 . 胆矾CuSO4·5H2O可写[Cu(H2O)]SO4·H2O,其结构示意图如下:
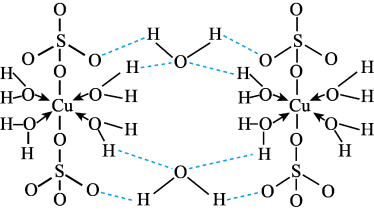
下列有关胆矾的说法正确的是

下列有关胆矾的说法正确的是
| A.Cu2+的价电子排布式为3d84s1 |
| B.所有氧原子都采取sp3杂化 |
| C.氧原子参与形成离子键、配位键、σ键和氢键四种化学键 |
| D.第二周期的元素中第一电离能比氧原子大的元素有三种 |
您最近半年使用:0次
名校
解题方法
4 . 如图所示,a为乙二胺四乙酸(EDTA),易与金属离子形成整合物,b为EDTA与Ca2+形成的鳌合物。下列叙述正确的是
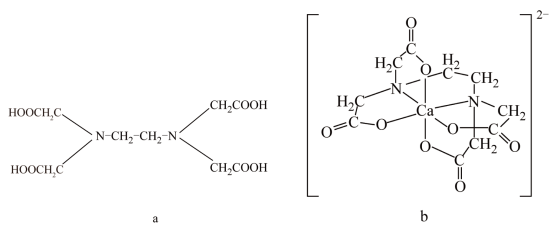

| A.a和b中N原子均采取sp3杂化 |
| B.b中Ca2+的配位数为4,配位原子是C原子 |
| C.a和b中C原子杂化方式相同 |
| D.b中含有共价键、离子键和配位键 |
您最近半年使用:0次
名校
解题方法
5 . NH3和BF3可以通过配位键形成化合物NH3⋅BF3,下列说法正确的是
| A.NH3、BF3两分子都是平面三角形分子 |
| B.NH3、BF3两分子的键角前者更大 |
| C.形成配合物时NH3中N原子提供的是孤对电子,BF3中B原子提供空轨道 |
| D.形成配合物时BF3中B原子提供的是孤对电子,NH3中N原子提供空轨道 |
您最近半年使用:0次
名校
解题方法
6 . 下列说法正确的是
| A.HF、HCl、HBr、HI的熔沸点、还原性都依次升高(增强) |
| B.通常测定氟化氢的相对分子质量大于理论值,因分子间存在氢键 |
| C.BF3、NCl3、PH3中心原子的杂化方式相同 |
| D.各种含氯元素的酸性由强到弱排列为HCl<HClO<HClO2<HClO3<HClO4 |
您最近半年使用:0次
解题方法
7 . 下列符号表征或说法正确的是
A. 电离: 电离: | B. 位于元素周期表p区 位于元素周期表p区 |
C. 空间结构:平面三角形 空间结构:平面三角形 | D. 电子式: 电子式: |
您最近半年使用:0次
名校
解题方法
8 . 我国力争在2030年前实现“碳达峰”。2060年前实现“碳中和”的目标,因此二氧化碳的固定及转化成了重要的研究课题。
Ⅰ.在 催化作用下
催化作用下 和
和 反应生成甲醇:
反应生成甲醇: ;
;
Ⅱ.新型 水介质电池放电时,温室气体
水介质电池放电时,温室气体 被转化为储能物质
被转化为储能物质 。
。
请回答下列问题:
(1)基态Cu原子的外围电子排布式为___________ ,基态O原子核外有___________ 种不同运动状态的电子。
(2)Ⅰ中涉及的 、
、 、
、 、
、 ,属于非极性分子的是
,属于非极性分子的是___________ (填化学式)。
(3) 分子中碳原子的杂化轨道类型为
分子中碳原子的杂化轨道类型为___________ ,分子中含有的 键和
键和 键数目之比为
键数目之比为___________ 。
(4) 反应中,
反应中, 的立体构型为
的立体构型为___________ , 的沸点高于
的沸点高于 的原因是
的原因是___________ 。
(5)氧化锌(ZnO),俗称锌白,是一种常用的化学添加剂,广泛地应用于塑料、硅酸盐制品、合成橡胶等产品的制作中。一种ZnO的立方晶胞如图所示。
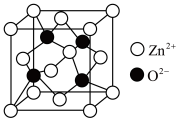
① 周围距离最近且等距的
周围距离最近且等距的 数目为
数目为___________ 。
②设晶胞边长为anm, 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为___________  。
。
Ⅰ.在
 催化作用下
催化作用下 和
和 反应生成甲醇:
反应生成甲醇: ;
;Ⅱ.新型
 水介质电池放电时,温室气体
水介质电池放电时,温室气体 被转化为储能物质
被转化为储能物质 。
。请回答下列问题:
(1)基态Cu原子的外围电子排布式为
(2)Ⅰ中涉及的
 、
、 、
、 、
、 ,属于非极性分子的是
,属于非极性分子的是(3)
 分子中碳原子的杂化轨道类型为
分子中碳原子的杂化轨道类型为 键和
键和 键数目之比为
键数目之比为(4)
 反应中,
反应中, 的立体构型为
的立体构型为 的沸点高于
的沸点高于 的原因是
的原因是(5)氧化锌(ZnO),俗称锌白,是一种常用的化学添加剂,广泛地应用于塑料、硅酸盐制品、合成橡胶等产品的制作中。一种ZnO的立方晶胞如图所示。

①
 周围距离最近且等距的
周围距离最近且等距的 数目为
数目为②设晶胞边长为anm,
 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为 。
。
您最近半年使用:0次
2023-07-30更新
|
884次组卷
|
4卷引用:内蒙古名校联盟2022-2023学年高二下学期期末考试化学试题
解题方法
9 . 铜及其化合物在生产生活中有着广泛的应用。回答下列问题:
(1)在元素周期表的分区中,铜属于_______ 区,与铜处于同一周期且最外层电子数相同的元素的基态原子共有_______ 种。
(2)过渡金属与O形成羰基配合物时,每个CO分子向中心原子提供2个电子,最终使中心原子的电子总数与同周期的稀有气体原子相同,称为有效原子序数规则。根据此规则推断,镍与CO形成的羰基配合物Ni(CO)x中,x=_______ 。
(3)CuCl2可与某有机多齿配体形成具有较强荧光性能的配合物,其结构简式如图所示。该配合物分子中N原子的杂化类型为_______ ,1mol 该有机配体与Cu( II )形成的配位键为_______ mol。
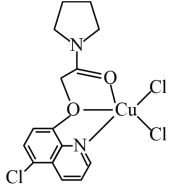
(4)铜催化烯烃硝化反应时会产生 。键角:
。键角:
_______  (填“<” 或“=”或“>”),其原因是
(填“<” 或“=”或“>”),其原因是_______ 。
(5)近期我国科学家合成了一种电化学性能优异的铜硒化合物,其晶胞结构如图所示。该铜硒化合物的化学式为_______ ,其中Cu 元素以Cu+和Cu2+存在,则_______ (填“①”或“②”)为Cu2+,该晶体的密度_______ g/cm3 (用含a和c的式子表示,设阿伏伽德罗常数为NA)。

(1)在元素周期表的分区中,铜属于
(2)过渡金属与O形成羰基配合物时,每个CO分子向中心原子提供2个电子,最终使中心原子的电子总数与同周期的稀有气体原子相同,称为有效原子序数规则。根据此规则推断,镍与CO形成的羰基配合物Ni(CO)x中,x=
(3)CuCl2可与某有机多齿配体形成具有较强荧光性能的配合物,其结构简式如图所示。该配合物分子中N原子的杂化类型为

(4)铜催化烯烃硝化反应时会产生
 。键角:
。键角:
 (填“<” 或“=”或“>”),其原因是
(填“<” 或“=”或“>”),其原因是(5)近期我国科学家合成了一种电化学性能优异的铜硒化合物,其晶胞结构如图所示。该铜硒化合物的化学式为

您最近半年使用:0次
10 . 铜及其化合物在生产生活中有着广泛的应用。请回答:
(1)已知Cu第一电离能I1(Cu)=746 kJ·mol-1,Zn第一电离能I1(Zn)=906 kJ·mol-1;则第二电离能大小关系为I2(Cu)___________ I2(Zn)(填“>”、“=”或“<”)。。
(2)在碱性条件下CuSO4与双缩脲[HN(CONH2)2]生成紫色的配位化合物,该原理可用于检验蛋白质。该配位化合物的阴离子结构如图所示:
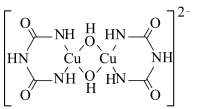
①该阴离子中所有元素的电负性从大到小的顺序为___________ 。
②该阴离子中氧原子的杂化方式为___________ ;
③lmol该阴离子含有σ键的数目为___________ ;
④该配合物中心铜离子的外围电子排布图为___________ ;
(3)磁性形状记忆材料Cu-Mn-Al合金的晶胞如图a所示(Mn、Al位于Cu形成的立方体体心位置),图b是沿立方格子对角面取得的截图,Cu在沿立方格子对角面取得截图中的相对位置如图c所示。

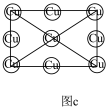
①该合金随温度升高,电导率_______ (填“升高”或“降低”或“不变”) ,原因为________ ;
②在图c中画出上图b切面上的Al和Mn的相对位置___________ (不考虑各原子的大小)。
(1)已知Cu第一电离能I1(Cu)=746 kJ·mol-1,Zn第一电离能I1(Zn)=906 kJ·mol-1;则第二电离能大小关系为I2(Cu)
(2)在碱性条件下CuSO4与双缩脲[HN(CONH2)2]生成紫色的配位化合物,该原理可用于检验蛋白质。该配位化合物的阴离子结构如图所示:

①该阴离子中所有元素的电负性从大到小的顺序为
②该阴离子中氧原子的杂化方式为
③lmol该阴离子含有σ键的数目为
④该配合物中心铜离子的外围电子排布图为
(3)磁性形状记忆材料Cu-Mn-Al合金的晶胞如图a所示(Mn、Al位于Cu形成的立方体体心位置),图b是沿立方格子对角面取得的截图,Cu在沿立方格子对角面取得截图中的相对位置如图c所示。


①该合金随温度升高,电导率
②在图c中画出上图b切面上的Al和Mn的相对位置
您最近半年使用:0次



