10-11高二下·河北衡水·阶段练习
解题方法
1 .
(1)菠菜营养丰富,素有“蔬菜之王”之称,在营养价值上是一种高效的补铁剂。某化学小组欲设计实验方案,探究菠菜中是否存在铁元素与草酸及可溶性草酸盐。甲同学查阅资料得知:草酸又名乙二酸,化学式为H2C2O4,是一种二元有机弱酸,具有较强的还原性。甲同学依据上述信息推测,菠菜中铁元素呈____ 价,其理由是____________________ 。甲同学同时设计实验方案,验证其推测是否正确。请简述实验方案_______________________________________ 。
(2)乙炔是有机合成工业的一种原料。工业上曾用 与水反应生成乙炔。
与水反应生成乙炔。
① 中
中 与
与 互为等电子体,
互为等电子体, 的电子式可表示为
的电子式可表示为_______________ ;1mol 中含有的
中含有的 键数目为
键数目为________ 。
②乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是___________________ ;分子中处于同一直线上的原子数目最多为_____ 。
(1)菠菜营养丰富,素有“蔬菜之王”之称,在营养价值上是一种高效的补铁剂。某化学小组欲设计实验方案,探究菠菜中是否存在铁元素与草酸及可溶性草酸盐。甲同学查阅资料得知:草酸又名乙二酸,化学式为H2C2O4,是一种二元有机弱酸,具有较强的还原性。甲同学依据上述信息推测,菠菜中铁元素呈
(2)乙炔是有机合成工业的一种原料。工业上曾用
 与水反应生成乙炔。
与水反应生成乙炔。①
 中
中 与
与 互为等电子体,
互为等电子体, 的电子式可表示为
的电子式可表示为 中含有的
中含有的 键数目为
键数目为②乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是
您最近一年使用:0次
名校
2 . Ⅰ.溴化铜 Ⅱ
Ⅱ 甲基咪唑配合物是一种制备有机玻璃的催化剂,其合成方法如下:
甲基咪唑配合物是一种制备有机玻璃的催化剂,其合成方法如下:

 溴化铜
溴化铜 Ⅱ
Ⅱ 甲基咪唑中
甲基咪唑中 与
与 甲基咪唑间形成的化学键称为
甲基咪唑间形成的化学键称为_______________ ; 基态核外电子排布式为
基态核外电子排布式为_________________________________ 。
 与
与 互为等电子体的阴离子为
互为等电子体的阴离子为_______________ 。
 中碳原子杂化轨道类型为
中碳原子杂化轨道类型为_______________ ;1molMIm中含 键数目为
键数目为______ mol。
Ⅱ.碳、氧、氮、镁、铬、铁、铜是几种重要的元素,请回答下列问题:
(4)Mg、O、C、N四种元素的第一电离能从大到小的顺序为________ 。
(5)查阅相关资料发现MgO的熔点比CuO的熔点高得多,其原因是_______ 。
(6)金属铬是一种银白色,极硬,耐腐蚀的金属,铬的化合物种类繁多,如:Cr2(SO4)3、 以及配离子
以及配离子 。
。
 具有很强的氧化性,能直接将
具有很强的氧化性,能直接将 氧化成
氧化成 ,试写出基态铬原子的价层电子排布式:
,试写出基态铬原子的价层电子排布式:__________________________________________ 。
 该配离子
该配离子 中,中心离子的配位数为
中,中心离子的配位数为______________ , 的VSEPR模型为
的VSEPR模型为________________________ 。
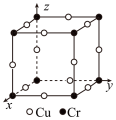
 已知晶胞中Cr和Cu原子间的最近距离为
已知晶胞中Cr和Cu原子间的最近距离为 ,则该晶体的密度为
,则该晶体的密度为___________ 
 用含a的代数式表示,设N
用含a的代数式表示,设N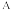 为阿伏加 德罗常数的值
为阿伏加 德罗常数的值 。
。
 Ⅱ
Ⅱ 甲基咪唑配合物是一种制备有机玻璃的催化剂,其合成方法如下:
甲基咪唑配合物是一种制备有机玻璃的催化剂,其合成方法如下:
 溴化铜
溴化铜 Ⅱ
Ⅱ 甲基咪唑中
甲基咪唑中 与
与 甲基咪唑间形成的化学键称为
甲基咪唑间形成的化学键称为 基态核外电子排布式为
基态核外电子排布式为 与
与 互为等电子体的阴离子为
互为等电子体的阴离子为 中碳原子杂化轨道类型为
中碳原子杂化轨道类型为 键数目为
键数目为Ⅱ.碳、氧、氮、镁、铬、铁、铜是几种重要的元素,请回答下列问题:
(4)Mg、O、C、N四种元素的第一电离能从大到小的顺序为
(5)查阅相关资料发现MgO的熔点比CuO的熔点高得多,其原因是
(6)金属铬是一种银白色,极硬,耐腐蚀的金属,铬的化合物种类繁多,如:Cr2(SO4)3、
 以及配离子
以及配离子 。
。 具有很强的氧化性,能直接将
具有很强的氧化性,能直接将 氧化成
氧化成 ,试写出基态铬原子的价层电子排布式:
,试写出基态铬原子的价层电子排布式: 该配离子
该配离子 中,中心离子的配位数为
中,中心离子的配位数为 的VSEPR模型为
的VSEPR模型为 已知晶胞中Cr和Cu原子间的最近距离为
已知晶胞中Cr和Cu原子间的最近距离为 ,则该晶体的密度为
,则该晶体的密度为
 用含a的代数式表示,设N
用含a的代数式表示,设N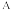 为阿伏加 德罗常数的值
为阿伏加 德罗常数的值 。
。
您最近一年使用:0次
3 . 吹沙填海是在填海点的周围用吹沙的方式堆沙造地。海水流出目标圈外,沙留在圈内,渐渐地圈内的海面就被不断吹进的沙填成了陆地,再用强夯机压实松土。高纯硅是现代信息、半导体和光伏发电等产业的基础材料。制备高纯硅的主要工艺流程如图所示:
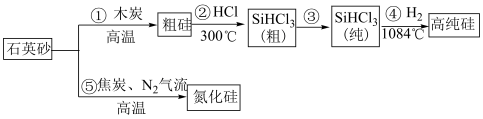
已知:SiHCl3极易水解,反应过程中会产生氢气。
回答下列问题:
(1)二氧化硅和硅酸盐是构成地壳中大部分岩石、沙子和土壤的主要微粒,SiO2的晶体类型为_____ ,其属于______ (填“酸性”或“碱性”)氧化物。化学上常用氧化物的形式表示硅酸盐的组成,例如青花瓷胎体的原料——高岭土[Al2Si2O5(OH)x]可表示为______ 。
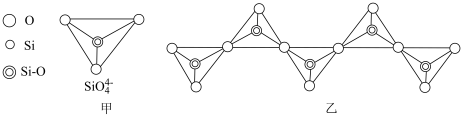
(2)在硅酸盐中,SiO 四面体(图甲为其俯视投影图)通过共用顶角氧原子可形成链状、环状等多种结构。如图乙所示为一种无限长单链结构的多硅酸根的一部分,其中Si原子的杂化方式为
四面体(图甲为其俯视投影图)通过共用顶角氧原子可形成链状、环状等多种结构。如图乙所示为一种无限长单链结构的多硅酸根的一部分,其中Si原子的杂化方式为______ ,该多硅酸根的最简式为______ 。
(3)工业上用纯净石英砂与C在高温下发生反应制造的粗硅中往往含有SiC,若粗硅中Si和SiC的物质的量之比为2∶1,则①的化学方程式为______ 。
(4)流程③提纯SiHCl3的操作名称为______ 。以上①~⑤的流程中,包含置换反应的是______ (填序号)。整个操作流程都需隔绝空气,原因是_______ 、______ (答出两条即可)。
(5)神舟十四号飞船成功发射标志着我国航天事业再上新台阶。氮化硼陶瓷基复合材料电推进系统及以SiC单晶制作器件,在航空航天特殊环境下具有广泛的应用前景。科学家用金属钠、四氯化碳和四氯化硅制得了SiC纳米棒,反应的化学方程式为______ 。

已知:SiHCl3极易水解,反应过程中会产生氢气。
回答下列问题:
(1)二氧化硅和硅酸盐是构成地壳中大部分岩石、沙子和土壤的主要微粒,SiO2的晶体类型为
(2)在硅酸盐中,SiO
 四面体(图甲为其俯视投影图)通过共用顶角氧原子可形成链状、环状等多种结构。如图乙所示为一种无限长单链结构的多硅酸根的一部分,其中Si原子的杂化方式为
四面体(图甲为其俯视投影图)通过共用顶角氧原子可形成链状、环状等多种结构。如图乙所示为一种无限长单链结构的多硅酸根的一部分,其中Si原子的杂化方式为
(3)工业上用纯净石英砂与C在高温下发生反应制造的粗硅中往往含有SiC,若粗硅中Si和SiC的物质的量之比为2∶1,则①的化学方程式为
(4)流程③提纯SiHCl3的操作名称为
(5)神舟十四号飞船成功发射标志着我国航天事业再上新台阶。氮化硼陶瓷基复合材料电推进系统及以SiC单晶制作器件,在航空航天特殊环境下具有广泛的应用前景。科学家用金属钠、四氯化碳和四氯化硅制得了SiC纳米棒,反应的化学方程式为
您最近一年使用:0次
名校
解题方法
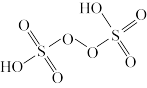
4 . 实验室常用酸性KMnO4溶液标定摩尔盐[(NH4)2Fe(SO4)2•6H2O],可用过二硫酸钠(Na2S2O8)使MnO 全部再生。下列说法错误的是
全部再生。下列说法错误的是
 全部再生。下列说法错误的是
全部再生。下列说法错误的是
A.氧化性:S2O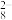 >MnO >MnO >Fe3+ >Fe3+ |
| B.标定时,KMnO4溶液和摩尔盐溶液都选用酸式滴定管 |
C.过二硫酸结构如图所示,则S2O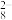 含有两个四面体结构 含有两个四面体结构 |
| D.过程中,消耗的摩尔盐和过二硫酸钠物质的量之比为1:2 |
您最近一年使用:0次
2022-03-22更新
|
1010次组卷
|
3卷引用:河北省衡水中学2022-2023学年高三上学期四调考试化学试题
解题方法
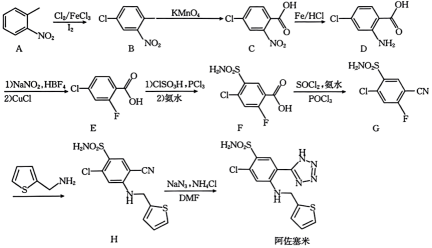
5 . 阿佐塞米是一种重要的药物,可用于心源性水肿(充血性心力衰竭)、肾性水肿、肝性水肿的治疗。其一种合成路线如下:
(1)A中碳原子的杂化方式为______ 。
(2)B的系统命名是______ ,D中的官能团是羧基、______ (填名称)。
(3)C→D的反应类型是______ 。
(4)G→H的化学方程式为______ 。
(5)在E的芳香族同分异构体中,含有酯基的结构有______ 种(不考虑立体异构),写出其中一种的结构简式:______ 。
(6)已知苯胺具有强还原性。以对硝基甲苯为原料,参照上述流程并利用相关原理设计合成H路线_____ 合成塑料{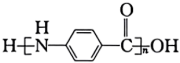 }(其他无机试剂任选)。
}(其他无机试剂任选)。
(1)A中碳原子的杂化方式为
(2)B的系统命名是
(3)C→D的反应类型是
(4)G→H的化学方程式为
(5)在E的芳香族同分异构体中,含有酯基的结构有
(6)已知苯胺具有强还原性。以对硝基甲苯为原料,参照上述流程并利用相关原理设计合成H路线
 }(其他无机试剂任选)。
}(其他无机试剂任选)。
您最近一年使用:0次
名校
6 . 蔬菜和水果中富含维生素C,维生素C具有还原性,在酸性溶液中可以被 等氧化剂氧化为脱氢维生素C(已知:阿伏加德罗常数的值为
等氧化剂氧化为脱氢维生素C(已知:阿伏加德罗常数的值为 )。下列有关说法错误的是
)。下列有关说法错误的是
 等氧化剂氧化为脱氢维生素C(已知:阿伏加德罗常数的值为
等氧化剂氧化为脱氢维生素C(已知:阿伏加德罗常数的值为 )。下列有关说法错误的是
)。下列有关说法错误的是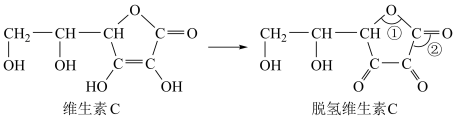
| A.脱氢维生素C中,键角①<键角② |
| B.维生素C分子中含有2个手性碳原子 |
C. 维生素C中含 维生素C中含 键数目为 键数目为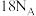 |
D.维生素C与 发生氧化还原反应时, 发生氧化还原反应时, 维生素C被氧化转移的电子数为 维生素C被氧化转移的电子数为 |
您最近一年使用:0次
2024-01-30更新
|
471次组卷
|
4卷引用:河北省武邑中学2023-2024学年高三上学期三模化学试题
解题方法
7 . 冬季燃煤排放的大量活性溴化合物BrCl能通过光解释放溴自由基(用Br表示)和氯自由基(用Cl表示),从而影响大气中自由基(OH、HO2)的浓度,其循环原理如图所示。下列说法错误的是
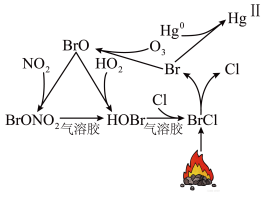

| A.BrCl可以与水反应生成HCl和HBrO |
| B.HOBr为直线形分子 |
| C.溴自由基和氯自由基均具有强氧化性 |
| D.BrCl的排放会造成臭氧空洞、水中汞含量超标等 |
您最近一年使用:0次
解题方法
8 . 锡是“五金”——金、银、铜、铁、锡之一,自然界中主要以二氧化物(SnO2)和各种硫化物(例如硫锡石)的形式存在。回答下列问题:
(1)已知Sn和Si同族,基态Sn原子的价层电子排布式为___________ ,基态氧原子的价层电子排布式不能表示为2s22 2
2 ,因为这违背了
,因为这违背了___________ (填标号)。
A.泡利原理 B.洪特规则 C.能量最低原理
(2)Sn(OH)4在碱性介质中可转化为[Sn(OH)6]2-,则[Sn(OH)6]2-中Sn与O之间的化学键不可能是___________(填标号)。
(3)某种锡的化合物可作为治疗癌症药物的原料,结构如图(Bu-n为正丁基)。
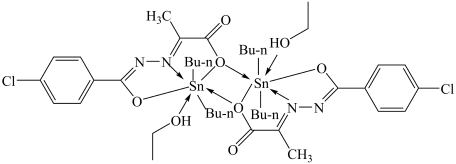
①结构中1个Sn原子形成的配位键有___________ 个。
②结构中N原子的杂化类型为___________ 。
③上述涉及的第二周期的元素中,第一电离能从大到小的顺序为___________ 。
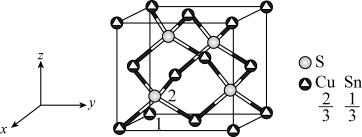
(4)Cu2SnS3属于立方晶体(如图所示)图中原子1的坐标为(0,0,0),则原子2的坐标为___________ 。其晶胞参数为a nm,阿伏加德罗常数的值为NA,S原子填充在Cux(Sn1-x)构成的正四面体空隙中,则Cu2SnS3的密度为___________ (列出计算式)g·cm-3
(1)已知Sn和Si同族,基态Sn原子的价层电子排布式为
 2
2 ,因为这违背了
,因为这违背了A.泡利原理 B.洪特规则 C.能量最低原理
(2)Sn(OH)4在碱性介质中可转化为[Sn(OH)6]2-,则[Sn(OH)6]2-中Sn与O之间的化学键不可能是___________(填标号)。
| A.π键 | B.σ键 | C.配位键 | D.极性键 |

①结构中1个Sn原子形成的配位键有
②结构中N原子的杂化类型为
③上述涉及的第二周期的元素中,第一电离能从大到小的顺序为
(4)Cu2SnS3属于立方晶体(如图所示)图中原子1的坐标为(0,0,0),则原子2的坐标为

您最近一年使用:0次
2023-07-04更新
|
101次组卷
|
2卷引用:河北省承德市2022-2023学年高二下学期期末考试化学试题
名校
解题方法
9 . 硫酸钴可用于电镀、碱性电池、生产含钴颜料,有着较为广泛的用途.由含钴矿(主要成分为 ,含有少量
,含有少量 的氧化物及有机物等)制备硫酸钴,并实现
的氧化物及有机物等)制备硫酸钴,并实现 元素的回收流程如图:
元素的回收流程如图:
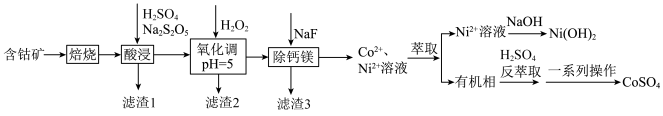
已知:① ;
;
②焦亚硫酸钠 常用作食品抗氧化剂;
常用作食品抗氧化剂;
③氧化性: .
.
回答下列问题:
(1)滤渣1的成分为___________________________ .
(2)酸浸工序发生的主要反应的化学方程式是_______________________ .
(3)氧化调 工序中,
工序中, 的作用是
的作用是__________________ (用离子方程式表示);调 时,最好选择
时,最好选择____________ .
a. b.
b. c.
c.
(4)萃取后, 浓度为
浓度为 ,当沉镍率达到99%时,溶液中
,当沉镍率达到99%时,溶液中 浓度为
浓度为____________  .
.
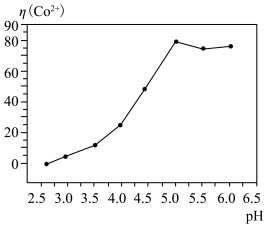
(5)向除杂后的溶液中,加入有机酸萃取剂 ,发生反应:
,发生反应: ,实验发现,随着
,实验发现,随着 的增大,萃取率逐渐升高,这是由于
的增大,萃取率逐渐升高,这是由于______________________ ,当 时,萃取率最高.
时,萃取率最高.
(6)硫酸钴可用于生产钴酞菁,酞菁和钴酞菁的分子结构如图所示.酞菁分子中所有原子共平面,则氮原子的杂化方式为____________ .钴酞菁分子中,氮原子与钴离子形成____________ 键.

 ,含有少量
,含有少量 的氧化物及有机物等)制备硫酸钴,并实现
的氧化物及有机物等)制备硫酸钴,并实现 元素的回收流程如图:
元素的回收流程如图:
已知:①
 ;
;②焦亚硫酸钠
 常用作食品抗氧化剂;
常用作食品抗氧化剂;③氧化性:
 .
.回答下列问题:
(1)滤渣1的成分为
(2)酸浸工序发生的主要反应的化学方程式是
(3)氧化调
 工序中,
工序中, 的作用是
的作用是 时,最好选择
时,最好选择a.
 b.
b. c.
c.
(4)萃取后,
 浓度为
浓度为 ,当沉镍率达到99%时,溶液中
,当沉镍率达到99%时,溶液中 浓度为
浓度为 .
.(5)向除杂后的溶液中,加入有机酸萃取剂
 ,发生反应:
,发生反应: ,实验发现,随着
,实验发现,随着 的增大,萃取率逐渐升高,这是由于
的增大,萃取率逐渐升高,这是由于 时,萃取率最高.
时,萃取率最高.
(6)硫酸钴可用于生产钴酞菁,酞菁和钴酞菁的分子结构如图所示.酞菁分子中所有原子共平面,则氮原子的杂化方式为

您最近一年使用:0次
2024-03-18更新
|
288次组卷
|
3卷引用:河北省保定市部分高中2023-2024学年高三下学期开学化学试题
名校
解题方法
10 . 明代科学家宋应星在《天工开物》中写道:“凡玉入中国,贵者尽出于田葱岭”。和田玉的主要化学成分是含水的钙镁硅酸盐。回答下列问题:
(1)元素镁能形成很多简单微粒,下面是镁原子形成的微粒的电子排布式,其中再电离出一个电子所需能量最大的是______ (填标号),当从C状态变到B状态,形成的是______ 光谱(选填“发射”或“吸收”)。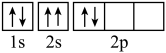 ,该电子排布图违背了
,该电子排布图违背了______ 。
(3)元素钙、镁和氯三种元素形成的最高价氧化物的水化物中,碱性最强的是______ (填化学式,下同),酸性最强的是______ 。
(4) 中中心原子Si的杂化类型是
中中心原子Si的杂化类型是______ ,离子空间结构为______ 。
(5)在 中不存在的化学键类型有
中不存在的化学键类型有______ 。
A.非极性共价键 B.极性共价键 C. 键 D.
键 D. 键
键
碳酸( )的酸性比硅酸(
)的酸性比硅酸( )
)______ (填“强”或“弱”),用离子方程式证明______ 。
(6)羧基( )能电离出
)能电离出 ,使溶液呈现酸性,已知
,使溶液呈现酸性,已知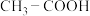 的酸性小于
的酸性小于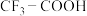 ,则推电子能力较强的是
,则推电子能力较强的是______ (填“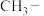 ”或“
”或“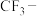 ”)
”)
(1)元素镁能形成很多简单微粒,下面是镁原子形成的微粒的电子排布式,其中再电离出一个电子所需能量最大的是
A. 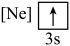 B.
B.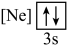 C.
C. 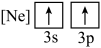 D.
D.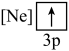
 ,该电子排布图违背了
,该电子排布图违背了(3)元素钙、镁和氯三种元素形成的最高价氧化物的水化物中,碱性最强的是
(4)
 中中心原子Si的杂化类型是
中中心原子Si的杂化类型是(5)在
 中不存在的化学键类型有
中不存在的化学键类型有A.非极性共价键 B.极性共价键 C.
 键 D.
键 D. 键
键碳酸(
 )的酸性比硅酸(
)的酸性比硅酸( )
)(6)羧基(
 )能电离出
)能电离出 ,使溶液呈现酸性,已知
,使溶液呈现酸性,已知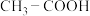 的酸性小于
的酸性小于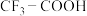 ,则推电子能力较强的是
,则推电子能力较强的是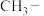 ”或“
”或“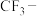 ”)
”)
您最近一年使用:0次
2024-03-28更新
|
64次组卷
|
2卷引用:河北省张家口市尚义县第一中学等校2023-2024学年高二下学期3月月考化学试题



