解题方法
1 . 硼及其化合物在材料制造、有机合成等方面用途非常广泛,硼的一些化合物表现出缺电子特征。回答下列问题:
(1)基态硼原子的电子排布式为_______ ;B和Al的第一电离能I1(B)_______ I1(Al)(填“>”或“=”或“<”)。
(2)H3BO3(层状结构)的结构示意图如下,在硼酸的层状结构中O的杂化类型是_______ ,层内存在的作用力有_______ 。硼酸显弱酸性与[B(OH)4]-配离子有关,硼酸的电离方程式:_______ 。

(3)自然界中不存在单质硼,硼的氢化物也很少,主要存在的是硼的含氧化合物,根据表中数据分析其原因是_______ 。
(4)已知晶体硼的熔、沸点及硬度数据和基本结构单元(由硼原子组成的正二十面体如图1所示,每个三角形均为正三角形,每个顶点为一个硼原子)如下:

①晶体硼属于原子(共价)晶体,其理由是_______ 。
②每一个硼基本单元由_______ 个原子组成;
③碳化硼,别名黑钻石,是已知最坚硬的三种材料之一,仅次于金刚石和立方氮化硼,图2为碳化硼晶胞,其化学式为_______ ;
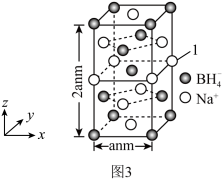
(5)硼氢化钠是一种常用的还原剂。其晶胞结构如图3所示,标注为“1”的Na+坐标参数为_______ 。已知NA代表阿伏加德罗常数的值,则硼氢化钠晶体的密度为ρ=_______ g·cm-3(用含NA的代数式表示)。
(1)基态硼原子的电子排布式为
(2)H3BO3(层状结构)的结构示意图如下,在硼酸的层状结构中O的杂化类型是

(3)自然界中不存在单质硼,硼的氢化物也很少,主要存在的是硼的含氧化合物,根据表中数据分析其原因是
| 化学键 | B-H | B-O | B-B |
| 键能(kJ·mol-1) | 389 | 561 | 293 |
| 晶体 | 金刚石 | 晶体硅 | 晶体硼 |
| 熔点(K) | 3832 | 1683 | 2573 |
| 沸点(K) | 5100 | 2628 | 3823 |
| 硬度 | 10 | 7.0 | 9.6 |

①晶体硼属于原子(共价)晶体,其理由是
②每一个硼基本单元由
③碳化硼,别名黑钻石,是已知最坚硬的三种材料之一,仅次于金刚石和立方氮化硼,图2为碳化硼晶胞,其化学式为
(5)硼氢化钠是一种常用的还原剂。其晶胞结构如图3所示,标注为“1”的Na+坐标参数为

您最近一年使用:0次
2023-03-12更新
|
754次组卷
|
3卷引用:内蒙古呼和浩特市2023届高三第一次质量数据监测理科综合化学试题
2 . 磷及其化合物在电池、催化等领域有重要应用。黑磷与石墨类似,也具有层状结构(如图1)。为大幅度提高锂电池的充电速率,科学家最近研发了黑磷-石墨复合负极材料,其单层结构俯视图如图2所示。

回答下列问题:
(1)Li 、C、P三种元素中,电负性最小的是_______ (用元素符号作答)。
(2)基态磷原子的电子排布式为_______ 。
(3)图2中,黑磷区P原子的杂化方式为_______ ,石墨区C原子的杂化方式为_______ 。
(4)氢化物PH3、CH4、NH3的沸点最高的是_______ ,原因是_______ 。
(5)根据图1和图2的信息,下列说法正确的有_______ (填字母)。
a.黑磷区P- P键的键能不完全相同
b.黑磷与石墨都属于混合型晶体
c.复合材料单层中,P原子与C原子之间的作用力属范德华力
(6)LiPF6、LiAsF6.等也可作为聚乙二醇锂离子电池的电极材料。电池放电时, Li+沿聚乙二醇分子中的碳氧链向正极迁移的过程如图所示(图中阴离子未画出)。

①从化学键角度看, Li+迁移过程发生_______ (填“物理”或“化学” )变化。
②相同条件下,电极材料_______ ( 填“LiPF6”或“LiAsF6”)中的Li+迁移较快,原因是_______ 。
(7)贵金属磷化物Rh2P(化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图3所示。已知晶胞参数为anm,晶体中与P距离最近的Rh的数目为_______ ,晶体的密度为_______ g·cm-3(列出计算式)。
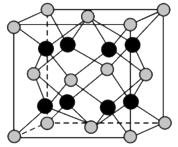
图3

回答下列问题:
(1)Li 、C、P三种元素中,电负性最小的是
(2)基态磷原子的电子排布式为
(3)图2中,黑磷区P原子的杂化方式为
(4)氢化物PH3、CH4、NH3的沸点最高的是
(5)根据图1和图2的信息,下列说法正确的有
a.黑磷区P- P键的键能不完全相同
b.黑磷与石墨都属于混合型晶体
c.复合材料单层中,P原子与C原子之间的作用力属范德华力
(6)LiPF6、LiAsF6.等也可作为聚乙二醇锂离子电池的电极材料。电池放电时, Li+沿聚乙二醇分子中的碳氧链向正极迁移的过程如图所示(图中阴离子未画出)。

①从化学键角度看, Li+迁移过程发生
②相同条件下,电极材料
(7)贵金属磷化物Rh2P(化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图3所示。已知晶胞参数为anm,晶体中与P距离最近的Rh的数目为

图3
您最近一年使用:0次
解题方法
3 . 含铜物质在生产生活中有着广泛应用回答下列问题:
(1)基态Cu原子最高能层的电子排布式为___ 。
(2)CuCl2稀溶液中存[Cu(H2O)6]2+。已知d轨道也可以参与杂化,则[Cu(H2O)6]2+中Cu的杂化方式为___ (填选项字母)。
(3)铜盐属于重金属盐,铜盐中毒可用青霉胺解毒,解毒原理如下:Cu2+能与青霉胺形成环状络合物,该环状络合物无毒、易溶于水,可经尿液排出。
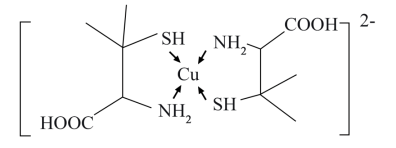
①比较硫化氢与氨气键角的大小:H2S___ NH3(填“>”或“<”) 。
②第二周期元素中,第一电离能大于N的元素有___ (用元素符号表示)。
③请解释该化合物易溶于水的主要原因:___ 。
④该环状络合物中,VSEPR模型为四面体或正四面体的非金属原子共有___ 个。
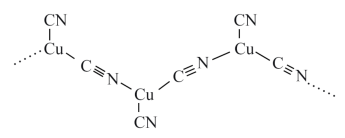
(4)Cu+与CN-形成长链阴离子,其结构片段如图所示,该阴离子中σ键与π键数目之比为___ 。
(5)一种由Cu、In、Te组成的高熵合金具有优良的热电性能,其四方晶胞如图所示:

①In的配位数为___ ;晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为___ 。
②若晶胞底边正方形的边长均为anm,高为cnm,阿伏加德罗常数的值为NA设晶体的最简式的式量为Mr,则该晶体的密度为____ g·cm-3(列出计算式)。
(1)基态Cu原子最高能层的电子排布式为
(2)CuCl2稀溶液中存[Cu(H2O)6]2+。已知d轨道也可以参与杂化,则[Cu(H2O)6]2+中Cu的杂化方式为
| A.sp3 | B.sp3d | C.d2sp3 | D.dsp2 |

①比较硫化氢与氨气键角的大小:H2S
②第二周期元素中,第一电离能大于N的元素有
③请解释该化合物易溶于水的主要原因:
④该环状络合物中,VSEPR模型为四面体或正四面体的非金属原子共有
(4)Cu+与CN-形成长链阴离子,其结构片段如图所示,该阴离子中σ键与π键数目之比为

(5)一种由Cu、In、Te组成的高熵合金具有优良的热电性能,其四方晶胞如图所示:

①In的配位数为
②若晶胞底边正方形的边长均为anm,高为cnm,阿伏加德罗常数的值为NA设晶体的最简式的式量为Mr,则该晶体的密度为
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
4 . 下列符号表征或说法正确的是
A. 电离: 电离: | B. 位于元素周期表p区 位于元素周期表p区 |
C. 空间结构:平面三角形 空间结构:平面三角形 | D. 电子式: 电子式: |
您最近一年使用:0次
名校
5 . NA为阿伏加德罗常数的值。下列说法错误的是
| A.23g CH3CH2OH中sp3杂化的原子数为NA |
| B.0.5molXeF4中氙的价层电子对数为3NA |
| C.62 g白磷中含有P-P键的数目为3NA |
| D.12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
您最近一年使用:0次
2023-05-09更新
|
169次组卷
|
2卷引用:内蒙古呼和浩特市剑桥中学2023-2024学年高二下学期3月月考化学试题
6 . 铜及其化合物在生产生活中有着广泛的应用。请回答:
(1)已知Cu第一电离能I1(Cu)=746 kJ·mol-1,Zn第一电离能I1(Zn)=906 kJ·mol-1;则第二电离能大小关系为I2(Cu)___________ I2(Zn)(填“>”、“=”或“<”)。。
(2)在碱性条件下CuSO4与双缩脲[HN(CONH2)2]生成紫色的配位化合物,该原理可用于检验蛋白质。该配位化合物的阴离子结构如图所示:
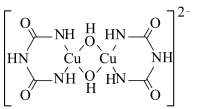
①该阴离子中所有元素的电负性从大到小的顺序为___________ 。
②该阴离子中氧原子的杂化方式为___________ ;
③lmol该阴离子含有σ键的数目为___________ ;
④该配合物中心铜离子的外围电子排布图为___________ ;
(3)磁性形状记忆材料Cu-Mn-Al合金的晶胞如图a所示(Mn、Al位于Cu形成的立方体体心位置),图b是沿立方格子对角面取得的截图,Cu在沿立方格子对角面取得截图中的相对位置如图c所示。

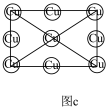
①该合金随温度升高,电导率_______ (填“升高”或“降低”或“不变”) ,原因为________ ;
②在图c中画出上图b切面上的Al和Mn的相对位置___________ (不考虑各原子的大小)。
(1)已知Cu第一电离能I1(Cu)=746 kJ·mol-1,Zn第一电离能I1(Zn)=906 kJ·mol-1;则第二电离能大小关系为I2(Cu)
(2)在碱性条件下CuSO4与双缩脲[HN(CONH2)2]生成紫色的配位化合物,该原理可用于检验蛋白质。该配位化合物的阴离子结构如图所示:

①该阴离子中所有元素的电负性从大到小的顺序为
②该阴离子中氧原子的杂化方式为
③lmol该阴离子含有σ键的数目为
④该配合物中心铜离子的外围电子排布图为
(3)磁性形状记忆材料Cu-Mn-Al合金的晶胞如图a所示(Mn、Al位于Cu形成的立方体体心位置),图b是沿立方格子对角面取得的截图,Cu在沿立方格子对角面取得截图中的相对位置如图c所示。


①该合金随温度升高,电导率
②在图c中画出上图b切面上的Al和Mn的相对位置
您最近一年使用:0次
名校
7 . 下列分子所含原子中,既有sp3杂化,又有sp2杂化的是
A.乙醛[ ] ] | B.丙烯腈[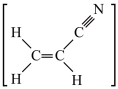 ] ] |
C.甲醛[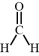 ] ] | D.丙炔[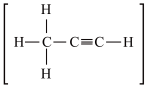 ] ] |
您最近一年使用:0次
2021-05-07更新
|
303次组卷
|
8卷引用:内蒙古呼和浩特市剑桥中学2023-2024学年高二下学期3月月考化学试题
内蒙古呼和浩特市剑桥中学2023-2024学年高二下学期3月月考化学试题江苏省邗江中学2020-2021学年高二(2019级新疆班)下学期期中化学试题(已下线)2.2.3 分子的空间结构及中心原子杂化轨道类型的判断方法-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)第二章 本章复习提升2湖南省衡阳县第四中学 2022-2023学年高二下学期开学摸底考试(平行班)化学试题四川省广元中学2021-2022学年高二下学期第一次段考化学试题江西省宜春市丰城市第九中学2023-2024学年高二下学期第一次月考化学试题甘肃省酒泉市实验中学2023-2024学年高二下学期3月月考化学试卷
解题方法
8 . 据报道复旦大学修发贤教授课题组成功制备出砷化铌纳米带,并观测到其表面态具有百倍于金属铜薄膜和千倍于石墨烯的导电性。相关研究论文已在线发表于权威科学期刊《自然》。回答下列问题:
(1)铌元素(Nb)为一种金属元素,其基态原子的核外电子排布式为[Kr]4d55s1。下列是Nb的不同微粒的核外电子排布式,其中失去最外层1个电子所需能量最小的是___ (填标号)。
a.[Kr]4d35s15p1b.[Kr]4d45s1c.Kr]4d2d.Kr]4d3
(2)砷为第VA族元素,砷可以与某些有机基团形成有机化合物,如(ClCH=CH)2AsCl,其中As原子与2个C原子、1个Cl原子形成的VSEPR模型为____ 。
(3)英国曼彻斯特大学物理学家安德烈·盖姆和康斯坦丁诺沃肖洛夫用微机械剥离法成功从石墨中分离出石墨烯,因此共同获得2010年诺贝尔物理学奖;而石墨烯具有优异的光学、电学、力学特性在材料学、微纳加工、能源、生物医学和药物传递等方面具有重要的应用前景,被认为是一种未来革命性的材料。
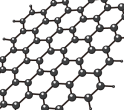
已知“石墨烯”的平面结构如图所示,一定条件下石墨烯与H2发生加成反应生成石墨烷,石墨烷中碳原子杂化类型是___ ,石墨烯导电的原因是____ 。
(4)石墨烯也可采用化学方法进行制备如采用六氯苯、六溴苯作为原料可制备石墨烯。下表给出了六氯苯、六溴苯、苯六酸俗名为蜜石酸的熔点和水溶性:
六溴苯的熔点比六氯苯高的原因是____ ,苯六酸与六溴苯、六氯苯的水溶性存在明显的差异本质原因是___ 。
(5)出于以更高效率利用太阳光等目的研制出金红石型铌氧氮化物(NbON),比以往的光学半导体更能够吸收长波长侧的光,作为光学半导体的新材料。该化合物的晶胞有如图所示的两种构型,若晶胞的边长为apm,该晶体的密度为__ g·cm-3。(NA是阿伏加 德罗常数的值,相关原子量:Nb—93)

(1)铌元素(Nb)为一种金属元素,其基态原子的核外电子排布式为[Kr]4d55s1。下列是Nb的不同微粒的核外电子排布式,其中失去最外层1个电子所需能量最小的是
a.[Kr]4d35s15p1b.[Kr]4d45s1c.Kr]4d2d.Kr]4d3
(2)砷为第VA族元素,砷可以与某些有机基团形成有机化合物,如(ClCH=CH)2AsCl,其中As原子与2个C原子、1个Cl原子形成的VSEPR模型为
(3)英国曼彻斯特大学物理学家安德烈·盖姆和康斯坦丁诺沃肖洛夫用微机械剥离法成功从石墨中分离出石墨烯,因此共同获得2010年诺贝尔物理学奖;而石墨烯具有优异的光学、电学、力学特性在材料学、微纳加工、能源、生物医学和药物传递等方面具有重要的应用前景,被认为是一种未来革命性的材料。
已知“石墨烯”的平面结构如图所示,一定条件下石墨烯与H2发生加成反应生成石墨烷,石墨烷中碳原子杂化类型是

(4)石墨烯也可采用化学方法进行制备如采用六氯苯、六溴苯作为原料可制备石墨烯。下表给出了六氯苯、六溴苯、苯六酸俗名为蜜石酸的熔点和水溶性:
| 物质 | 六氯苯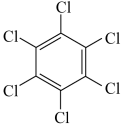 | 六溴苯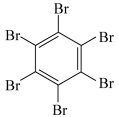 | 苯六酸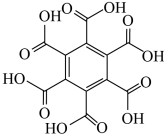 |
| 熔点/℃ | 231 | 325 | 287 |
| 水溶性 | 不溶 | 不溶 | 易溶 |
六溴苯的熔点比六氯苯高的原因是
(5)出于以更高效率利用太阳光等目的研制出金红石型铌氧氮化物(NbON),比以往的光学半导体更能够吸收长波长侧的光,作为光学半导体的新材料。该化合物的晶胞有如图所示的两种构型,若晶胞的边长为apm,该晶体的密度为

您最近一年使用:0次
解题方法
9 . 铂(Pt)可以和很多化合物形成配合物,生产生活中有重要的用途。
(1)铂和氨水可以形成配合物。可用于提取铂。氨水中各元素的第一电离能由大到小的顺序___ 。
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体,科学研究表明,反式分子和顺式分子一样具有抗癌活性。
①C1-的核外电子排布式为_______ 。
②吡啶分子是大体积平面配体,其结构简式为 ,吡啶分子中氮原子的轨道杂化方式是
,吡啶分子中氮原子的轨道杂化方式是_____ ,分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡啶中的大π键应表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡啶中的大π键应表示为_____ ;1mol吡啶中含有σ键的数目为________
③二氯二吡啶合铂分子中存在的微粒间作用力有_____ (填字母)。
a.离子键b.配位键c.金属键d.非极性键e.氢键f.极性键
④二氯二吡啶合铂分子中,Pt2+的配位数是4,但是其轨道杂化方式并不是sp3。简述理由_____________ 。
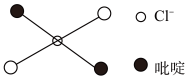
⑤反式二氯二吡啶合铂分子结构如图所示,该分子是_____ 分子(其“极性”或“非极性”)。
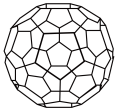
(3)富勒烯C60能够与Pt结合形成一系列络合物。富勒烯(C60)的结构如图所示,C60属于____ 晶体;C60分子中五元环与六元环的数目比为__________ 。
(已知简单多面体的顶点数V、棱数E及面数F间有如下关系:V-E+F=2)。
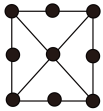
(4)金属铂立方晶胞的二维投影图如图所示。若金属铂的密度dg/cm3,则晶胞参数a=___ nm(列出计算式即可)。
(1)铂和氨水可以形成配合物。可用于提取铂。氨水中各元素的第一电离能由大到小的顺序
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体,科学研究表明,反式分子和顺式分子一样具有抗癌活性。
①C1-的核外电子排布式为
②吡啶分子是大体积平面配体,其结构简式为
 ,吡啶分子中氮原子的轨道杂化方式是
,吡啶分子中氮原子的轨道杂化方式是 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡啶中的大π键应表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡啶中的大π键应表示为③二氯二吡啶合铂分子中存在的微粒间作用力有
a.离子键b.配位键c.金属键d.非极性键e.氢键f.极性键
④二氯二吡啶合铂分子中,Pt2+的配位数是4,但是其轨道杂化方式并不是sp3。简述理由
⑤反式二氯二吡啶合铂分子结构如图所示,该分子是

(3)富勒烯C60能够与Pt结合形成一系列络合物。富勒烯(C60)的结构如图所示,C60属于

(已知简单多面体的顶点数V、棱数E及面数F间有如下关系:V-E+F=2)。
(4)金属铂立方晶胞的二维投影图如图所示。若金属铂的密度dg/cm3,则晶胞参数a=

您最近一年使用:0次
解题方法
10 . 钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:2Mn2++5S2O82-+8H2O 2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
(1)基态Mn原子的价电子排布式为___________ 。
(2)现代化学中,常利用_______________________ 上的特征谱线来鉴定元素。
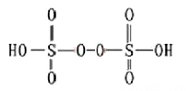
(3)已知H2S2O8的结构如图。H2S2O8硫原子的轨道杂化方式为__________ ;上述反应每生成1molMnO4-,S2O82- 断裂的共价键类型及其数目为_____________________ ;与硫酸根等电子体的分子或离子有______________________ (写两种)。
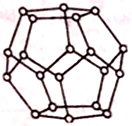
(4)一定条件下,水分子间可通过氢键将从H2O分子结合成三维骨架结构,其中的多面体孔穴中可包容气体小分子,形成笼形水合包合物晶体。如图是一种由水分子构成的正十二面体骨架(“o”表示水分子),其包含的氢键数为___________ ;实验测得冰中氢键的作用能为18.8kJ·mol-1,而冰的熔化热为5.0kJ·mol-1,其原因可能是_________________ 。
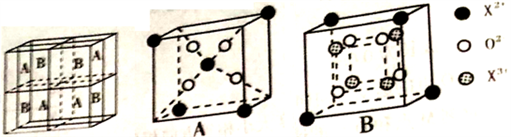
(5)与Mn同周期相邻的元素X,价电子层有2对成对电子,其离子型氧化物晶胞如图所示。它由A、B方块组成。则该氧化物中X2+、X3+、O2-的个数比为_____________ (填最简整数比);已知该晶体的密度为d g/cm3,阿伏伽德罗常数的值为NA,则晶胞参数a为_________ nm (用含d和NA的代数式表示)
 2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+(1)基态Mn原子的价电子排布式为
(2)现代化学中,常利用
(3)已知H2S2O8的结构如图。H2S2O8硫原子的轨道杂化方式为

(4)一定条件下,水分子间可通过氢键将从H2O分子结合成三维骨架结构,其中的多面体孔穴中可包容气体小分子,形成笼形水合包合物晶体。如图是一种由水分子构成的正十二面体骨架(“o”表示水分子),其包含的氢键数为

(5)与Mn同周期相邻的元素X,价电子层有2对成对电子,其离子型氧化物晶胞如图所示。它由A、B方块组成。则该氧化物中X2+、X3+、O2-的个数比为

您最近一年使用:0次



