名校
1 . 类推是化学学习和研究中常用的思维方法。下列类推正确的是
A. 为直线形分子,则 为直线形分子,则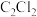 也为直线形分子 也为直线形分子 |
| B.N原子之间可以形成N=N,则P原子之间也可形成P=P |
C. 分子的空间结构为V形,则 分子的空间结构为V形,则 的VSEPR模型也是V形 的VSEPR模型也是V形 |
D.基态V的价层电子排布式为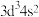 ,基态Cr的价层电子排布式为 ,基态Cr的价层电子排布式为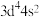 |
您最近一年使用:0次
2024-03-02更新
|
276次组卷
|
2卷引用:辽宁省朝阳市建平县实验中学2023-2024学年高二上学期期末化学试题
解题方法
2 . 分子的结构与性质息息相关,下列说法错误的是
| A.I2易溶于苯、CH4难溶于水,都可用“相似相溶”原理解释 |
B.二氢呋喃( )和降冰片烯( )和降冰片烯(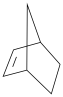 )分子中均含有手性碳原子 )分子中均含有手性碳原子 |
| C.H3O+和NH3的中心原子都是sp3杂化 |
| D.三氟乙酸的酸性大于三氯乙酸 |
您最近一年使用:0次
名校
3 . 将氟气通入氢氧化钠溶液中,可得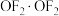 一种无色、几乎无味的剧毒气体,主要用于氧化、氟化反应、火箭工程助燃剂等。)下列说法错误的是
一种无色、几乎无味的剧毒气体,主要用于氧化、氟化反应、火箭工程助燃剂等。)下列说法错误的是
 一种无色、几乎无味的剧毒气体,主要用于氧化、氟化反应、火箭工程助燃剂等。)下列说法错误的是
一种无色、几乎无味的剧毒气体,主要用于氧化、氟化反应、火箭工程助燃剂等。)下列说法错误的是A.与 分子相比, 分子相比, 分子的极性大 分子的极性大 |
B.与 分子相比, 分子相比, 子的键角小 子的键角小 |
C. 中 中 化合价为 化合价为 价 价 |
D. 的 的 模型名称为四面体形 模型名称为四面体形 |
您最近一年使用:0次
4 . 前四周期元素及其化合物在生产、生活中应用广泛。回答下列问题:
(1)下列状态的N原子或离子在跃迁时;用光谱仪可捕捉到发射光谱的是______ 。
a. b.
b. c.
c. d.
d.
(2)基态铜原子的价电子排布式为________ 。
(3) 的几何构型为
的几何构型为_______ 。
(4)已知下图均与第三周期的主族元素有关。
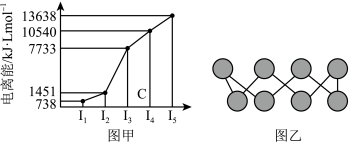
①图甲表示第一至第五电离能数据,则该元素的原子有___ 种不同运动状态的电子。
②图乙中为某单质的一种同素异形体,分子中的各原子最外层均达到8电子稳定结构,则该元素的原子的杂化轨道类型为_____ ,其易溶于 的原因是
的原因是_______ 。
(5)氨气极易溶于水,溶于水的氨分子大部分与水分子形成氢键,生成一水合氨,关于一水合氨的结构有如下两种可能,正确的是b,理由是_________ 。

(1)下列状态的N原子或离子在跃迁时;用光谱仪可捕捉到发射光谱的是
a.
 b.
b.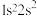 c.
c. d.
d.
(2)基态铜原子的价电子排布式为
(3)
 的几何构型为
的几何构型为(4)已知下图均与第三周期的主族元素有关。

①图甲表示第一至第五电离能数据,则该元素的原子有
②图乙中为某单质的一种同素异形体,分子中的各原子最外层均达到8电子稳定结构,则该元素的原子的杂化轨道类型为
 的原因是
的原因是(5)氨气极易溶于水,溶于水的氨分子大部分与水分子形成氢键,生成一水合氨,关于一水合氨的结构有如下两种可能,正确的是b,理由是

您最近一年使用:0次
解题方法
5 . 回答下列问题。
(1)Cu在元素周期表的位置:___________ ,元素周期表分区为:___________ 。
(2)在SO2分子中,S原子采取___________ 杂化,SO2的键角___________ (填“大于”“等于”或“小于”)120°,SO2分子的空间结构为___________ ,SO3分子中S原子采取___________ 杂化,SO3分子的空间结构为___________ 。
(3) 的空间结构是
的空间结构是___________ ,N原子采取___________ 杂化。
(4) 、
、 的空间结构分别为
的空间结构分别为___________ ,S原子的杂化轨道类型分别为___________ 、___________ 。
(1)Cu在元素周期表的位置:
(2)在SO2分子中,S原子采取
(3)
 的空间结构是
的空间结构是(4)
 、
、 的空间结构分别为
的空间结构分别为
您最近一年使用:0次
解题方法
6 . 下列化学用语或图示表达正确的是
A.Cr的简化电子排布式: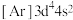 |
B.Al原子的最高能级原子轨道形状: |
C. 的价层电子对互斥模型(VSEPR模型): 的价层电子对互斥模型(VSEPR模型):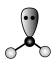 |
D.基态N原子的轨道表示式: |
您最近一年使用:0次
名校
7 . Ⅰ.硫及其化合物有许多用途,相关物质的物理常数如下表所示:
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______ ,基态S原子电子占据最高能级的电子云轮廓图为______ 形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同其他分子的是______ 。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为______ 。
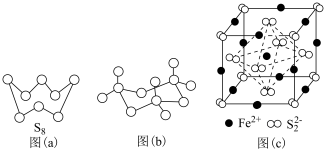
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为______ 形,其中共价键的类型有______ 种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为______
Ⅱ.
(5)气态氢化物热稳定性HF大于HCl的主要原因是______ 。
(6)CaCN2是离子化合物。各原子均满足8电子稳定结构,CaCN2的电子式是______ 。
(7)常温下,在水中的溶解度乙醇大于氯乙烷,原因是______ 。
Ⅲ.
(8)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4.常温常压下SnCl4为无色液体,SnCl4空间构型为______ 。
(9)NH3、PH3、AsH3的沸点由高到低的顺序为______ (填化学式。下同)。还原性由强到弱的顺序为______ 。键角由大到小的顺序为______ 。
| H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
| 熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
| 沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同其他分子的是
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为
Ⅱ.
(5)气态氢化物热稳定性HF大于HCl的主要原因是
(6)CaCN2是离子化合物。各原子均满足8电子稳定结构,CaCN2的电子式是
(7)常温下,在水中的溶解度乙醇大于氯乙烷,原因是
Ⅲ.
(8)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4.常温常压下SnCl4为无色液体,SnCl4空间构型为
(9)NH3、PH3、AsH3的沸点由高到低的顺序为
您最近一年使用:0次
2024-01-15更新
|
149次组卷
|
2卷引用:辽宁省朝阳市建平县实验中学2023-2024学年高二上学期12月月考化学试题
解题方法
8 . 钛是20世纪50年代发展起来的一种重要的结构金属,钛合金因具有强度高、耐蚀性好、耐热性高等特点而被广泛用于各个领域。回答下列问题:
(1)钛元素在元素周期表中的位置_______ 。
(2)二氧化钛与 (光气)、
(光气)、 (二氯亚砜)等氯化试剂反应可用于制取四氯化钛。
(二氯亚砜)等氯化试剂反应可用于制取四氯化钛。 的空间构型为
的空间构型为_______ , 中σ键和π键的数目比为
中σ键和π键的数目比为_______ 。
(3)钛的某配合物可用于催化环烯烃聚合,其结构如下图所示:
①碳原子的杂化类型有_______ 种。
②该配合物中存在的化学键有_______ (填字母)。
a.离子键 b.配位键 c.金属键 d.共价键 e.氢键
(4)氮化钛晶体的晶胞结构如图所示,该晶体结构中与N原子距离最近且相等的Ti原子有_______ 个;若该晶胞的密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞中Ti原子与N原子的最近距离为
,则晶胞中Ti原子与N原子的最近距离为_______ pm。(用含ρ、 的代数式表示)
的代数式表示)

(1)钛元素在元素周期表中的位置
(2)二氧化钛与
 (光气)、
(光气)、 (二氯亚砜)等氯化试剂反应可用于制取四氯化钛。
(二氯亚砜)等氯化试剂反应可用于制取四氯化钛。 的空间构型为
的空间构型为 中σ键和π键的数目比为
中σ键和π键的数目比为(3)钛的某配合物可用于催化环烯烃聚合,其结构如下图所示:
①碳原子的杂化类型有
②该配合物中存在的化学键有
a.离子键 b.配位键 c.金属键 d.共价键 e.氢键
(4)氮化钛晶体的晶胞结构如图所示,该晶体结构中与N原子距离最近且相等的Ti原子有
 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞中Ti原子与N原子的最近距离为
,则晶胞中Ti原子与N原子的最近距离为 的代数式表示)
的代数式表示)
您最近一年使用:0次
名校
解题方法
9 . 下列分子中心原子的杂化方式不为 的是
的是
 的是
的是A. | B. | C. | D. |
您最近一年使用:0次
2023-12-26更新
|
507次组卷
|
6卷引用:辽宁省朝阳市建平县实验中学2023-2024学年高二上学期期末化学试题
名校
10 . 部分含氯物质的分类与相应化合价的关系如图所示。下列推理错误的是
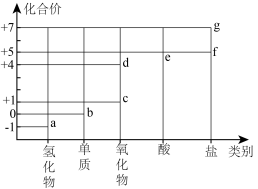

| A.a与e反应可生成b | B.d为酸性氧化物 |
| C.c溶于水可生成HClO | D.f、g中阴离子的VSEPR模型相同 |
您最近一年使用:0次
2023-12-16更新
|
183次组卷
|
4卷引用:辽宁省部分学校2023-2024学年高三上学期12月考试化学试题



