名校
1 . 钙铜合金可用作电解法制备金属钙的阴极电极材料。回答下列问题:
(1)铜在元素周期表中位于_____ (填“s”、“p”、“d”或“ds”)区。
(2)基态Ca原子的价电子排布式为_____ 。Co与Ca位于同一周期,且最外层电子数相同,但金属Co的熔点、沸点均比金属Ca的高的原因是______ 。
(3)硫酸铜稀溶液呈蓝色,则硫酸铜稀溶液中不存在的作用力有____ (填标号),其中硫酸根的空间构型为_____ 。
A.配位键 B.金属键 C.共价键 D.氢键
(1)铜在元素周期表中位于
(2)基态Ca原子的价电子排布式为
(3)硫酸铜稀溶液呈蓝色,则硫酸铜稀溶液中不存在的作用力有
A.配位键 B.金属键 C.共价键 D.氢键
您最近一年使用:0次
名校
解题方法
2 . 用价电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,也可推测键角大小,下列判断正确的是
| A.PCl3为平面三角形 | B.SO3与 为平面三角形 为平面三角形 |
| C.SO2键角大于120o | D.BF3是三角锥形分子 |
您最近一年使用:0次
2021-05-21更新
|
463次组卷
|
5卷引用:吉林省通化市梅河口市第五中学2023-2024学年高二上学期1月期末化学试题
吉林省通化市梅河口市第五中学2023-2024学年高二上学期1月期末化学试题河北省河间市第十四中学2020-2021学年高二下学期期中考试化学试题(已下线)第2.2.1讲 分子结构的测定和多样性 价层电子对互斥模型-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)第二节 分子的空间结构 第1课时 分子结构的测定 多样的分子空间结构 价层电子对互斥模型辽宁省朝阳市建平县实验中学2023-2024学年高二上学期12月月考化学试题
3 . 已知A、B、C、D、E代表五种元素。A元素的三价离子3d能级处于半充满;B元素原子的最外层电子数是内层电子总数的2倍;C的原子轨道中有2个未成对的电子,且与B可形成两种常见的气体;D的原子序数小于A,D与C可形成DC2和DC3两种分子,且DC2是极性分子,DC3是非极性分子;E是短周期元素中除了稀有气体外原子半径最大的元素。试回答下列问题:
(1)写出A元素基态原子的价层电子排布图___ 。
(2)B、C、D三种元素的电负性由大到小的顺序为___ (写元素符号)。
(3)E与C以1:1形成的物质的电子式为___ 。该物质与BC2反应的化学方程式为___ 。
(4)用电子式表示BC2形成过程___ 。
(5)E元素焰色反应的原因是___ 。
(6)用VSEPR理论判断DC3分子的空间立体结构为___ 。
(7)上述元素中第一电离能最大的元素是___ (填元素符号)。
(1)写出A元素基态原子的价层电子排布图
(2)B、C、D三种元素的电负性由大到小的顺序为
(3)E与C以1:1形成的物质的电子式为
(4)用电子式表示BC2形成过程
(5)E元素焰色反应的原因是
(6)用VSEPR理论判断DC3分子的空间立体结构为
(7)上述元素中第一电离能最大的元素是
您最近一年使用:0次
4 . 以下分子或离子的结构为正四面体形且键与键夹角为109°28′的是
①CH4 ②SiCl4 ③CH3Cl ④P4
①CH4 ②SiCl4 ③CH3Cl ④P4
| A.①②④ | B.①②③④ | C.①② | D.①③ |
您最近一年使用:0次
名校
解题方法
5 . 原子结构与元素周期表存在着内在联系。根据已学知识,请你回答下列问题:
(1)指出31号元素镓(Ga)在元素周期表中的位置:___ 。
(2)写出原子序数最小的第Ⅷ族元素原子的核外的价电子排布图:____ 。其正三价离子的未成对电子数为____
(3)写出3p轨道上有2个未成对电子的元素的符号:____ 。
(4)日常生活中广泛使用的不锈钢,在其生产过程中添加了某种元素,该元素的价电子排布式为3d54s1,该元素的名称为___ 。
(5)基态原子的4s能级中只有1个电子的元素共有___ 种
(6)元素基态原子的M层全充满,N层有且只有一个未成对电子,其基态原子的电子排布式为___ ,属于____ 区元素;[Cu(NH3)4]SO4中所含的化学键有___ ,,[Cu(NH3)4]SO4的外界离子的空间构型为____ 。
(1)指出31号元素镓(Ga)在元素周期表中的位置:
(2)写出原子序数最小的第Ⅷ族元素原子的核外的价电子排布图:
(3)写出3p轨道上有2个未成对电子的元素的符号:
(4)日常生活中广泛使用的不锈钢,在其生产过程中添加了某种元素,该元素的价电子排布式为3d54s1,该元素的名称为
(5)基态原子的4s能级中只有1个电子的元素共有
(6)元素基态原子的M层全充满,N层有且只有一个未成对电子,其基态原子的电子排布式为
您最近一年使用:0次
6 . 用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是
| A.SO2、CS2、HI都是直线形的分子 |
| B.BF3键角为120°,SnBr2键角大于120° |
| C.CH2O、BF3、SO3都是平面三角形的分子 |
| D.PCl3、NH3、H2O都是三角锥形的分子 |
您最近一年使用:0次
名校
7 . 水是动物生命活动的必需物质,请判断水分子的VSEPR模型名称和中心原子O采取的杂化方式分别是
A.四面体形、 | B.V形、 | C.平面三角形、 | D.三角锥形、 |
您最近一年使用:0次
2021-04-09更新
|
230次组卷
|
6卷引用:吉林省白城市第一中学2020-2021学年高二下学期期中考试化学试题
吉林省白城市第一中学2020-2021学年高二下学期期中考试化学试题四川省成都外国语学校2020-2021学年高二4月月考化学试题(已下线)第2.2.2讲 杂化轨道理论-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)海南省儋州川绵中学2021-2022学年高二下学期期中考试化学试题专题4 分子空间结构与物质性质 第一单元 分子的空间结构 第1课时 分子的空间结构模型4.1.1杂化轨道理论 课后
名校
解题方法
8 . N、P、As都是VA族元素,且原子序数依次增大,它们的单质和化合物在生产、生活中有广泛应用。请回答下列相关问题。
(1)基态砷原子的价电子排布式为____ 。
(2)从结构分析硝酸符合形成氢键的条件但硝酸的沸点较低,其可能的原因是____ 。
(3) 与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。
与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。 离子的VSEPR模型名称为
离子的VSEPR模型名称为___ ,K3[Co(NO2)6]是黄色沉淀,该物质中四种元素的电负性由大到小的顺序是___ 。(用元素符号表示)
(4)磷化硼(BP)可作为金属表面的保护薄膜,其晶胞如图1所示,在BP晶胞中B原子配位数是___ ,P原子占据的是B原子堆积的____ (选填“立方体”“正四面体”或“正八面体”)空隙。建立如图2所示坐标系,可得晶胞中A、C处原子的分数坐标,则M处的P原子分数坐标为____ ,若晶胞中B原子和P原子之间的最近核间距为a pm,则晶胞边长为____ cm。
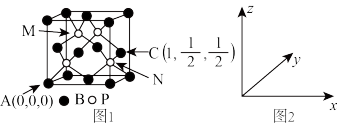
(1)基态砷原子的价电子排布式为
(2)从结构分析硝酸符合形成氢键的条件但硝酸的沸点较低,其可能的原因是
(3)
 与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。
与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。 离子的VSEPR模型名称为
离子的VSEPR模型名称为(4)磷化硼(BP)可作为金属表面的保护薄膜,其晶胞如图1所示,在BP晶胞中B原子配位数是

您最近一年使用:0次
2021-03-26更新
|
385次组卷
|
2卷引用:吉林省吉林市2021届高三下学期第三次调研测试(3月)理科综合化学试题
名校
解题方法
9 . 下列描述中正确的是
| A.在气体单质分子中,一定含有σ键,可能含有π键 |
B.ClO 的空间构型为平面三角形 的空间构型为平面三角形 |
C.BF 的键角小于NH3 的键角小于NH3 |
D.N(CH3)3和SO 的中心原子均为sp3杂化 的中心原子均为sp3杂化 |
您最近一年使用:0次
名校
解题方法
10 . 根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的是
A.NH3和NO | B.SO3和NO | C.BF3 和ClO | D.H2O和PO |
您最近一年使用:0次
2021-01-24更新
|
265次组卷
|
8卷引用:吉林省长春市第二实验中学2020-2021学年高二下学期4月月考化学试题
吉林省长春市第二实验中学2020-2021学年高二下学期4月月考化学试题吉林省延边朝鲜族自治州延边二中北校区2020-2021学年高二下学期第一次月考化学试题山西省长治市第二中学校2020-2021学年高二上学期期末考试化学试题(已下线)2.2 分子的空间结构(A级基础练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)宁夏吴忠市吴忠中学2020-2021学年高二3月月考化学试题山东省商河县第一中学2020-2021学年高二下学期开学考试化学试题河北省石家庄市元氏县第四中学2021-2022学年高二下学期6月月考化学试题(已下线)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(1-10)



