名校
1 . 下列叙述中正确的是
| A.P4、CO、CO2都是极性分子 |
| B.HCN、CCl4都是含有极性键的非极性分子 |
| C.HF、HCl、HBr、Hl的稳定性依次减弱 |
| D.CS2、H2O、C2H2都是直线型分子 |
您最近一年使用:0次
2019-04-20更新
|
391次组卷
|
2卷引用:吉林省长春汽车经济开发区第三中学2018-2019学年高二下学期4月月考化学试题
解题方法
2 . A、B、C、D、E、F、G是前四周期的七种元素,其原子序数依次增大。A的基态原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D及其同主族元素的氢化物沸点变化趋势如图(D的氢化物沸点最高);F是地壳中含量最高的金属元素;G与F同主族。请回答下列问题:
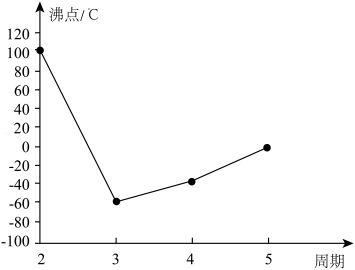
(1)写出F元素基态原子的核外电子排布式:____________ 。
(2)B、C、D三种元素电负性由大到小的顺序是____________ (用元素符号表示)。
(3)有关上述元素的下列说法,正确的是________ (填序号)。
①CA3沸点高于BA4,主要是因为前者相对分子质量较大
②配合物Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于离子晶体
③C的氢化物的中心原子采取sp2杂化
④F单质的熔点高于E单质,是因为F单质的金属键较强
⑤比G的原子序数少1的元素第一电离能高于G
(4)CA3分子的立体构型为________ ,1 mol B2A4分子中含有________ 个σ键;

(1)写出F元素基态原子的核外电子排布式:
(2)B、C、D三种元素电负性由大到小的顺序是
(3)有关上述元素的下列说法,正确的是
①CA3沸点高于BA4,主要是因为前者相对分子质量较大
②配合物Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于离子晶体
③C的氢化物的中心原子采取sp2杂化
④F单质的熔点高于E单质,是因为F单质的金属键较强
⑤比G的原子序数少1的元素第一电离能高于G
(4)CA3分子的立体构型为
您最近一年使用:0次
名校
3 . 下列分子或离子中,立体构型是平面三角形的是( )
| A.CH4 | B.NH4+ |
| C.NO3- | D.CO2 |
您最近一年使用:0次
2019-04-15更新
|
104次组卷
|
2卷引用:吉林省吉林市第五十五中学2018-2019学年高二下学期3月月考化学试题
名校
4 . 下列物质的分子中,键角最小的是
| A.CH2=CH2 | B.H2O | C.NH3 | D.CH4 |
您最近一年使用:0次
2019-04-09更新
|
181次组卷
|
2卷引用:【全国百强校】吉林省延边第二中学2018-2019学年高二下学期第一次月考化学试题
名校
解题方法
5 . 美国化学家鲍林教授具有独特的化学想象力:只要给他物质的分子式,他就能大体上想象出这种物质的分子结构模型.多核离子所带电荷可以认为是中心原子得失电子所致,根据VSEPR模型,下列离子中所有原子都在同一平面上的一组是( )
A.NO 和NH 和NH | B.H3O+和ClO |
C.NO 和CO 和CO | D.PO 和SO 和SO |
您最近一年使用:0次
2020-06-17更新
|
495次组卷
|
16卷引用:吉林省白城市镇赉县第一中学校2021-2022学年高二下学期第一次月考化学试题
吉林省白城市镇赉县第一中学校2021-2022学年高二下学期第一次月考化学试题2016届山东省青岛市胶州一中高三上学期11月模拟化学试卷山西省沁县中学2018-2019学年高二下学期第一次月考化学试题宁夏回族自治区吴忠市吴忠中学2020年高二化学人教版选修3第二章《分子结构与性质》单元测试山西省孝义市2019-2020学年高二下学期3月阶段性考试化学试题新疆博尔塔拉蒙古自治州第五师高级中学2019-2020学年高二下学期期中考试化学试题河南省驻马店市正阳县高级中学2019-2020高二下学期第一次素质检测化学试题甘肃省静宁县第一中学2019-2020学年高二下学期期中考试(第二次月考)化学试题(实验班)新疆维吾尔自治区新源县第二中学2019-2020学年高二上学期第一次阶段测试化学试题广东省广州市真光中学2021-2022学年高二下学期3月月考化学试题(已下线)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(1-10)湖南省长沙市长郡中学2022-2023学年高二上学期期末考试化学试题江西省宜春市铜鼓中学2022-2023学年高二下学期第一次段考化学试题河南省淮滨高级中学2022-2023学年高二下学期期中教学质量检测化学试题广东省珠海市第一中学2022-2023学年高三下学期2月月考化学试题河南省信阳市第十高级中学2022-2023学年高二下学期期中教学质量检测化学试卷
10-11高二下·山西晋中·期中
名校
6 . 下列分子和离子中中心原子价层电子对几何构型为四面体且分子或离子空间的构型为V形的是( )
| A.NH4+ | B.PH3 | C.H3O+ | D.OF2 |
您最近一年使用:0次
2019-09-14更新
|
475次组卷
|
24卷引用:吉林省汪清县第六中学2018-2019学年高二6月月考化学试题
吉林省汪清县第六中学2018-2019学年高二6月月考化学试题吉林省松原市前郭尔罗斯蒙古族自治县蒙古族中学2019-2020学年高二下学期网课质量检测化学试题(已下线)2010—2011学年山西省平遥中学高二下学期期中考试化学试卷(已下线)2011-2012学年甘肃省甘谷一中高二下学期第二次月考化学试卷2015-2016学年江苏省泰州中学高二下第一次质检化学试卷2015-2016学年内蒙古元平煤高中高二实验班下期中化学卷2016-2017学年宁夏育才中学孔德校区高二下学期第一次(3月)月考化学试卷广西宾阳县宾阳中学2016-2017学年高二下学期7月期末考试化学试题河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:2.2 第1课时人教版2017-2018学年高二化学选修三同步训练:2.2 分子的立体构型(第1课时)云南省曲靖市宣威市第三中学2017-2018学年高二下学期3月月考化学试题福建省长汀一中2017-2018学年高二实验班下学期第一次月考化学试题山西省祁县中学2017-2018学年高二4月月考化学试题(已下线)2019年3月7日 《每日一题》人教选修3-价层电子对互斥理论的应用云南省玉溪市元江县第一中学2018-2019学年高二下学期开学考试化学试题【全国百强校】宁夏回族自治区育才中学勤行校区2018-2019学年高二下学期3月月考化学试题宁夏回族自治区银川市长庆高级中学2018-2019学年高二下学期第二次月考化学试题【市级联考】新疆维吾尔自治区乌鲁木齐市2018-2019学年高二下学期期末考试化学试题鲁科版2019选择性必修2第2章 微粒间相互作用与物质性质 第2节 共价键与分子的空间结构 第1课时 分子空间结构的理论分析甘肃省兰州二十七中学2020-2021学年高二下学期期中考试化学试题(已下线)课时55 分子结构与性质-2022年高考化学一轮复习小题多维练(全国通用)河南省驻马店市环际大联考2021-2022学年高二下学期期中考试化学试题(已下线)第40练 分子的空间结构-2023年高考化学一轮复习小题多维练(全国通用)福建省龙岩市长汀县第一中学2021-2022学年高二下学期第一次月考化学试题
名校
7 . 下列分子的VSEPR模型和分子的立体构型相同的是
| A.NH3 | B.CO2 | C.H2O | D.SO2 |
您最近一年使用:0次
2018-12-21更新
|
204次组卷
|
2卷引用:【全国百强校】吉林省长春外国语学校2018-2019学年高二下学期第一次月考化学试题
名校
8 . ①PH3的分子构型为三角锥形,②BeCl2的分子构型为直线形,③CH4分子的构型为正四面体形,④CO2为直线形分子,⑤BF3分子构型为平面正三角形,⑥NF3分子结构为三角锥形。下面对分子极性的判断正确的是
| A.①⑥为极性分子,②③④⑤为非极性分子 |
| B.只有④为非极性分子,其余为极性分子 |
| C.只有②⑤是极性分子,其余为非极性分子 |
| D.只有①③是非极性分子,其余是极性分子 |
您最近一年使用:0次
2018-12-13更新
|
974次组卷
|
16卷引用:吉林省通化市通化县综合高级中学2019-2020学年高二下学期期中考试化学试题
吉林省通化市通化县综合高级中学2019-2020学年高二下学期期中考试化学试题贵州省息烽县一中2018-2019学年高二上学期期中考试化学试题云南省新平县一中2018-2019学年高二上学期12月考试化学试题(已下线)2019年3月18日 《每日一题》选修3-分子的极性【全国百强校】山东省济南外国语学校三箭分校2018-2019学年高二下学期期中考试化学试题云南省保山市昌宁县一中2019-2020学年高二10月月考化学试题四川省南充市白塔中学2019-2020学年高二12月月考化学试题云南省普洱市墨江县民族学校2019—2020学年高二上学期期末考试化学试题山东省临沂市罗庄区2019-2020学年高二下学期期中考试化学试题福建省福州市八县一中2019-2020学年高二年下学期适应性考试化学试题福建省南安市侨光中学2019-2020学年高二下学期第二次阶段考化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 第三节 分子结构与物质的性质高二选择性必修2(人教版2019)第二章 分子结构与性质 第三节 分子结构与物质的性质 课时1 共价键的极性黑龙江省牡丹江市海林市朝鲜族中学2020-2021学年高二下学期4月份月考化学试题(已下线)第2章 章末综合测评A-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)2.3.1 共价键的极性-随堂练习
9 . 已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为__________ ,该元素的符号是__________ ;
(2)Y元素原子的价层电子的轨道表示式为________ ,该元素的名称是__________ ;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为____________ ;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________________________________ ;
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由____ 。
(1)X元素原子基态时的电子排布式为
(2)Y元素原子的价层电子的轨道表示式为
(3)X与Z可形成化合物XZ3,该化合物的空间构型为
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由
您最近一年使用:0次
2019-01-30更新
|
1006次组卷
|
15卷引用:2014-2015学年吉林省吉林市第一中学高二下期末化学试卷
2014-2015学年吉林省吉林市第一中学高二下期末化学试卷2009年普通高等学校招生统一考试理综试题化学部分(宁夏卷)2014-2015河北省邢台市第一中学高二12月月考化学试卷河北省蠡县中学2016-2017学年高二6月月考化学试题河北省廊坊市第一中学2016-2017学年高二下学期6月月考化学试题宁夏青铜峡市高级中学2018届高三上学期期中考试化学试题【全国百强校】宁夏银川唐徕回民中学2017-2018学年高二下学期期中考试化学试题云南省大关县一中2018-2019学年高二上学期12月考试化学试题云南省元江哈尼族彝族傣族自治县一中2018-2019学年高二上学期12月考试化学试题云南省盐津县第一中学2018-2019学年高二上学期12月份考试化学试题贵州省剑河县第二高级中学2018-2019学年高二上学期12月份考试化学试题云南省玉溪市元江县第一中学2018-2019学年高二下学期开学考试化学试题2020年安徽省全省教学质量检测统一考试(练习检测一)山东省聊城市2019-2020学年高三化学一轮复习《物质结构与性质(》模拟测试安徽省合肥市肥东县综合高中2021-2022学年高二下学期期中考试化学试题
12-13高二下·吉林延边·期中
名校
解题方法
10 . 下列分子构型为正四面体的是
①P4②NH3③CCl4④CH4⑤H2S ⑥CO2
①P4②NH3③CCl4④CH4⑤H2S ⑥CO2
| A.①③④⑤ |
| B.①③④⑤⑥ |
| C.①③④ |
| D.④⑤ |
您最近一年使用:0次
2020-02-24更新
|
463次组卷
|
6卷引用:2012-2013学年吉林省汪清六中高二下学期期中考试化学试卷



