1 . 氮元素是重要的非金属元素,可形成多种铵盐、氮化物、叠氮化物及配合物等。
(1)基态氮原子价电子的轨道表达式(价电子排布图)为_______ ;第二周期元素原子中第一电离能大于氮原子的有_______ 种,NH4NO3中阴离子的空间构型为_______ 。
(2)C、N、O、S四种元素中,电负性最大的是_______ 。1mol[Co(NH3)6]Cl2中含有 键的数目为
键的数目为_______ ;已知NF3比NH3的沸点低得多,试解释原因_______ 。
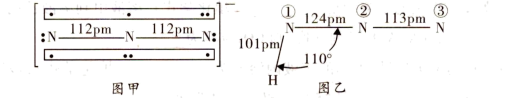
(3)叠氮化钠(NaN3)用于汽车的安全气囊, 结构如图甲。
结构如图甲。 中存在的两个大
中存在的两个大 键可用符号
键可用符号 表示,一个
表示,一个 中键合电子(形成化学键的电子)总数为
中键合电子(形成化学键的电子)总数为_______ 。叠氮酸(HN3)结构如图乙,分子中②号N原子的杂化方式为_______ 。
(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Fe3+配合物的结构如图丙所示,1mol该螯合物中通过螯合作用形成的配位键有_______ mol。
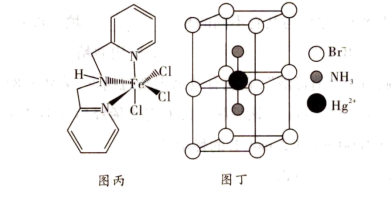
(5)某含氮的化合物晶胞结构如图丁所示,Br-作简单立方堆积,两个立方体共用的面中心存在一个Hg,NH3位于立方体的体心,相邻的Br的距离均为apm,阿伏加德罗常数的值为NA该物质的化学式为_______ ,该晶体的密度为_______ g·cm-3。
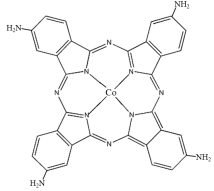
(6)Fe3+可以与SCN-、CN-等形成配合物。与SCN-互为等电子体且为非极性分子的化学式为_______ 。在一定条件下铁形成的晶体的基本结构单元如图1和图2所示,则图1和图2的结构中铁原子的配位数之比为_______ ,两种晶体中空间利用率较高的是_______ (填“图1”或“图2”)。
(1)基态氮原子价电子的轨道表达式(价电子排布图)为
(2)C、N、O、S四种元素中,电负性最大的是
 键的数目为
键的数目为(3)叠氮化钠(NaN3)用于汽车的安全气囊,
 结构如图甲。
结构如图甲。 中存在的两个大
中存在的两个大 键可用符号
键可用符号 表示,一个
表示,一个 中键合电子(形成化学键的电子)总数为
中键合电子(形成化学键的电子)总数为
(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Fe3+配合物的结构如图丙所示,1mol该螯合物中通过螯合作用形成的配位键有

(5)某含氮的化合物晶胞结构如图丁所示,Br-作简单立方堆积,两个立方体共用的面中心存在一个Hg,NH3位于立方体的体心,相邻的Br的距离均为apm,阿伏加德罗常数的值为NA该物质的化学式为
(6)Fe3+可以与SCN-、CN-等形成配合物。与SCN-互为等电子体且为非极性分子的化学式为

您最近一年使用:0次
解题方法
2 . 钴及其化合物在电机、机械、化工、航空和航天等工业部门得到广泛的应用,是一种重要的战略金属。已知:钴是具有光泽的钢灰色金属,其常见价态有+2价、+3价,化学性质与铁类似。
(1)三价钴离子的核外电子排布式为__ 。
(2)配合物[Co(NH3)4(H2O)2]C13是钴的重要化合物,中心原子的配位数为____ ,配体分子的VSEPR模型为___ 。
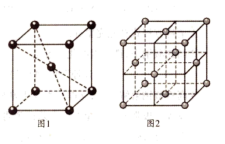
(3)化合物四氨基钴酞菁分子的结构式如图。四氨基钴酞菁中N原子的杂化轨道类型为__ 、___ 。
(4)已知Co(OH)2具有明显的两性,在浓的强碱溶液中可以形成[Co(OH)4]2-,写出Co(OH)2酸式电离的电离方程式_______ 。
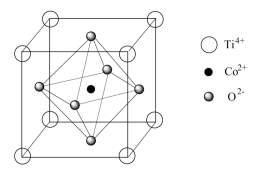
(5)一种钴的化合物可用作石油脱硫的催化剂,其晶胞结构如图所示,该钴的化合物的化学式是_______ 。已知晶胞参数为acm,NA为阿伏加德罗常数的值,则该钴的化合物的密度为_______ g/cm3。
(1)三价钴离子的核外电子排布式为
(2)配合物[Co(NH3)4(H2O)2]C13是钴的重要化合物,中心原子的配位数为
(3)化合物四氨基钴酞菁分子的结构式如图。四氨基钴酞菁中N原子的杂化轨道类型为

(4)已知Co(OH)2具有明显的两性,在浓的强碱溶液中可以形成[Co(OH)4]2-,写出Co(OH)2酸式电离的电离方程式
(5)一种钴的化合物可用作石油脱硫的催化剂,其晶胞结构如图所示,该钴的化合物的化学式是

您最近一年使用:0次
3 . 下列说法中正确的是
| A.在二氧化硅晶体中 ,最小的环上的原子个数为 6 |
| B.HCl分子里含有一个s-p σ键 |
| C.3p3 表示 3p 能级有三个轨道 |
D.SO3与  互为等电子体 ,且它们中心原子都是 sp3 杂化 互为等电子体 ,且它们中心原子都是 sp3 杂化 |
您最近一年使用:0次
名校
解题方法
4 . 下列各组微粒的空间构型相同的是( )
①NH3和H2O ② 和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和BeCl2 ⑥
和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和BeCl2 ⑥ 和
和 ⑦BF3和Al2Cl6
⑦BF3和Al2Cl6
①NH3和H2O ②
 和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和BeCl2 ⑥
和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和BeCl2 ⑥ 和
和 ⑦BF3和Al2Cl6
⑦BF3和Al2Cl6| A.全部 | B.除④⑥⑦以外 | C.③④⑤⑥ | D.②⑤⑥ |
您最近一年使用:0次
2020-07-02更新
|
1055次组卷
|
31卷引用:2015-2016学年河南省孟津一中高二上学期期末化学试卷
2015-2016学年河南省孟津一中高二上学期期末化学试卷2014-2015学年陕西西北大学附中高二下期末化学试卷辽宁师范大学附属中学2019-2020学年高二下学期期末考试化学试题湖北省武汉市五校联合体2019-2020学年高一下学期期末考试化学试题山西省朔州市怀仁县大地学校2019-2020学年高二下学期期末考试化学试题新疆新源县第二中学2019-2020学年高二下学期期末考试化学试题新疆昌吉教育共同体2020-2021学年高二下学期期末质量检测化学试题河北省石家庄市第一中学2020-2021学年高二下学期学情反馈(一)化学试题陕西省西安市周至县第四中学2022-2023学年高二下学期期末考试化学试题2014-2015福建省福州市八县高二下学期联考化学试卷2015-2016学年山西省大同一中高二下3月月考化学试卷2015-2016学年江苏省启东中学高二下第二次月考化学试卷2016-2017学年山西省大同市第一中学高二3月月考化学试卷河南省南阳市第一中学2016-2017学年高二下学期第一次月考(3月)化学试题安徽省合肥市第一中学2016-2017学年高二下学期期中考试化学试题山西省大同市第一中学2016-2017学年高二5月月考化学试题2017-2018学年人教版高中化学选修三 模块综合质量检测山西省阳泉市第二中学2018-2019学年高二下学期期中考试化学试题辽宁省凌源市第二高级中学2019-2020学年高二第四次网上测试化学试题河北省沧州市盐山县盐山中学2019-2020学年高二下学期开学考试化学试题安徽省安庆市太湖县2019-2020学年高二下学期期中质量调研考试化学试题(已下线)模块同步卷11 综合检测卷(基础卷)-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)福建省建瓯市芝华中学2020-2021学年高二下学期第一阶段考试化学试题福建省龙岩市长汀县三级达标校2020-2021学年高二下学期期中考试化学试题广西蒙山县第一中学2018-2019学年高二下学期第二次月考化学试题(已下线)考向37 分子结构与性质-备战2022年高考化学一轮复习考点微专题四川省西昌市2020-2021学年高二下学期期中检测化学试题贵州省凯里学院附属中学2021-2022学年高二下学期3月月考化学试题山西省太原市英才学校2021-2022学年高二下学期线上期中化学试题重庆市璧山来凤中学2022-2023学年高二下学期第一次月考化学试题湖北省武汉西藏中学2023-2024学年高二下学期4月月考化学试题
5 . 下列分子中,立体构型是平面三角形的是( )
| A.CH4 | B.NH3 | C.BF3 | D.CO2 |
您最近一年使用:0次
2020-02-12更新
|
2009次组卷
|
5卷引用:河南省洛阳市2019-2020学年高二上学期期末考试化学试题
名校
6 . 已知N2O与CO2互为等电子体.下列关于N2O的说法正确的是( )
| A.N2O的空间构型与CO2构型不同 |
| B.N2O的空间构型与H2O构型相似 |
| C.N2O的空间构型与NH3构型相似 |
| D.N2O的空间构型为直线形 |
您最近一年使用:0次
2018-06-25更新
|
195次组卷
|
5卷引用:河南省洛阳市2020-2021学年高二上学期期末考试化学试题



