1 . 下列有关说法错误的是
| A.基态Fe原子的最外层电子的电子云形状为球形 |
B. 中阴离子空间结构为正四面体形 中阴离子空间结构为正四面体形 |
C. 可用作汽油抗爆剂,其分子中 可用作汽油抗爆剂,其分子中 键和 键和 键的数目之比为 键的数目之比为 |
D.硅原子间难形成双键而碳原子间可以,原因是硅原子的半径大,难形成 键 键 |
您最近一年使用:0次
解题方法
2 . 白磷(P4)在Cl2中燃烧生成PCl3和PCl5。下列说法正确的是
| A.P4分子中每个磷原子价层电子对数为4 |
| B.PCl3的空间构型为平面正三角形 |
| C.PCl5分子中P原子最外层满足8电子结构 |
| D.因P电负性比Cl小,故PCl3的水解产物为PH3和HClO |
您最近一年使用:0次
解题方法
3 . 下列化学用语正确的是
A. 的VSEPR模型为 的VSEPR模型为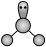 |
B.聚丙烯的结构简式为 |
C.甲苯的空间填充模型为 |
D.基态F原子的轨道表示式为 |
您最近一年使用:0次
4 . 近日,科学家开发的常压旋转滑行弧实现高效固氮取得进展,原理如图所示。

下列叙述正确的是

下列叙述正确的是
A.NH 和NH3的VSEPR模型相同 和NH3的VSEPR模型相同 | B.第一电离能:O>N |
| C.NO2是非极性分子,CO2是极性分子 | D.HNO3中的N原子采取sp3杂化 |
您最近一年使用:0次
解题方法
5 . 某种离子液体的结构如图所示,其中X、Y、Z、W、Q是原子序数依次增大的短周期主族元素,Z与Q同主族。下列说法错误的是
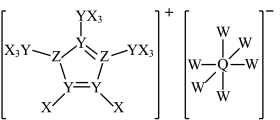

A.简单离子半径: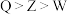 | B.简单氢化物键角: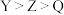 |
C.最高价氧化物对应水化物的酸性: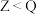 | D.阴离子立体构型为正八面体形 |
您最近一年使用:0次
解题方法
6 . 价层电子对互斥理论可以预测某些微粒的空间结构。下列说法正确的是
A. 和 和 的VSEPR模型均为四面体 的VSEPR模型均为四面体 |
B. 和 和 的空间构型均为三角锥形 的空间构型均为三角锥形 |
C. 和 和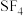 均为非极性分子 均为非极性分子 |
D. 与 与 的键角相等 的键角相等 |
您最近一年使用:0次
7 . 短周期主族元素W、X、Z、Y的原子序数依次增大,简单离子所带电荷与离子半径的关系如图所示。下列叙述错误的是


A.电负性: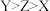 |
B.简单氢化物的还原性: |
C. 分子的 分子的 模型为三角锥形 模型为三角锥形 |
| D.Y、Z的氧化物对应的水化物可能是弱酸 |
您最近一年使用:0次
解题方法
8 . 锂-磷酸氧铜电池正极的活性物质是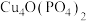 ,可通过下列反应制备:
,可通过下列反应制备: 。回答下列问题:
。回答下列问题:
(1)磷元素的基态原子核外电子排布式为_______ 。
(2) 的空间结构是
的空间结构是_______ 。
(3)第一电离能:N_______ (填“>”或“<”)O,原因为_______ 。
(4) 分子中
分子中 与
与 之间的氢键表示为
之间的氢键表示为_______ (填序号)。
①N-H…O ②H-O…H ③O-H…N
(5)1mol 中含有的σ键和π键的总数目分别为
中含有的σ键和π键的总数目分别为_______ 和_______ 。
(6)Cu和S两种元素形成某种晶体的晶胞结构如图所示,假设该晶体的晶胞边长为apm。
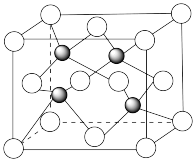
①Cu和S之间的最近距离为_______ pm。
②设 为阿伏加德罗常数的值,该晶胞的密度为
为阿伏加德罗常数的值,该晶胞的密度为_______ (用含 和a的代数式表示)
和a的代数式表示) 。
。
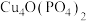 ,可通过下列反应制备:
,可通过下列反应制备: 。回答下列问题:
。回答下列问题:(1)磷元素的基态原子核外电子排布式为
(2)
 的空间结构是
的空间结构是(3)第一电离能:N
(4)
 分子中
分子中 与
与 之间的氢键表示为
之间的氢键表示为①N-H…O ②H-O…H ③O-H…N
(5)1mol
 中含有的σ键和π键的总数目分别为
中含有的σ键和π键的总数目分别为(6)Cu和S两种元素形成某种晶体的晶胞结构如图所示,假设该晶体的晶胞边长为apm。

①Cu和S之间的最近距离为
②设
 为阿伏加德罗常数的值,该晶胞的密度为
为阿伏加德罗常数的值,该晶胞的密度为 和a的代数式表示)
和a的代数式表示) 。
。
您最近一年使用:0次
名校
解题方法
9 . 我国科技工作者利用计算机技术,预测了超硬钨氮化合物( )并进行合成,这对扩充超硬材料家族以及研究硬度起源都有重要的科学意义。
)并进行合成,这对扩充超硬材料家族以及研究硬度起源都有重要的科学意义。
(1)区分 是否为晶体的最可靠的科学方法为
是否为晶体的最可靠的科学方法为_______ 。
(2)已知基态W原子的价层电子排布式为 ,则基态W原子核外最外层电子占据的能层符号是
,则基态W原子核外最外层电子占据的能层符号是_______ ;与基态 原子相比,基态W原子与基态
原子相比,基态W原子与基态 原子的未成对电子数之比为
原子的未成对电子数之比为_______ 。
(3)常见的含氮微粒有 、
、 、
、 、
、 、
、 等。
等。
① 的组成元素中,电负性最大的元素是
的组成元素中,电负性最大的元素是_______ (填元素符号,下同);第一电离能最大的元素是_______ 。
② 中心原子的杂化类型为
中心原子的杂化类型为_______ ; 的空间构型为
的空间构型为_______ 。
③已知 中存在一个大π键,可用符号
中存在一个大π键,可用符号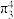 表示(3表示原子数,4表示参与形成大π键的p电子数),则一个
表示(3表示原子数,4表示参与形成大π键的p电子数),则一个 中键合电子(形成化学键的电子)的总数为
中键合电子(形成化学键的电子)的总数为_______ 。
④ 在水中的溶解性比
在水中的溶解性比 大很多,其主要原因是
大很多,其主要原因是_______ 。
(4)磷化硼(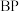 )是超硬材料家族的重要成员之一,其晶胞结构如图所示,若硼原子与磷原子最近的距离为anm,设
)是超硬材料家族的重要成员之一,其晶胞结构如图所示,若硼原子与磷原子最近的距离为anm,设 表示阿伏加德罗常数的值,则磷化硼晶体的密度为
表示阿伏加德罗常数的值,则磷化硼晶体的密度为_______  (用含a、
(用含a、 的计算式表示)。
的计算式表示)。

 )并进行合成,这对扩充超硬材料家族以及研究硬度起源都有重要的科学意义。
)并进行合成,这对扩充超硬材料家族以及研究硬度起源都有重要的科学意义。(1)区分
 是否为晶体的最可靠的科学方法为
是否为晶体的最可靠的科学方法为(2)已知基态W原子的价层电子排布式为
 ,则基态W原子核外最外层电子占据的能层符号是
,则基态W原子核外最外层电子占据的能层符号是 原子相比,基态W原子与基态
原子相比,基态W原子与基态 原子的未成对电子数之比为
原子的未成对电子数之比为(3)常见的含氮微粒有
 、
、 、
、 、
、 、
、 等。
等。①
 的组成元素中,电负性最大的元素是
的组成元素中,电负性最大的元素是②
 中心原子的杂化类型为
中心原子的杂化类型为 的空间构型为
的空间构型为③已知
 中存在一个大π键,可用符号
中存在一个大π键,可用符号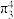 表示(3表示原子数,4表示参与形成大π键的p电子数),则一个
表示(3表示原子数,4表示参与形成大π键的p电子数),则一个 中键合电子(形成化学键的电子)的总数为
中键合电子(形成化学键的电子)的总数为④
 在水中的溶解性比
在水中的溶解性比 大很多,其主要原因是
大很多,其主要原因是(4)磷化硼(
 )是超硬材料家族的重要成员之一,其晶胞结构如图所示,若硼原子与磷原子最近的距离为anm,设
)是超硬材料家族的重要成员之一,其晶胞结构如图所示,若硼原子与磷原子最近的距离为anm,设 表示阿伏加德罗常数的值,则磷化硼晶体的密度为
表示阿伏加德罗常数的值,则磷化硼晶体的密度为 (用含a、
(用含a、 的计算式表示)。
的计算式表示)。
您最近一年使用:0次
2022-06-15更新
|
120次组卷
|
2卷引用:河南省焦作市第一中学2021-2022学年高二下学期期末考试化学试题
10 . 氮元素是重要的非金属元素,可形成多种铵盐、氮化物、叠氮化物及配合物等。
(1)基态氮原子价电子的轨道表达式(价电子排布图)为_______ ;第二周期元素原子中第一电离能大于氮原子的有_______ 种,NH4NO3中阴离子的空间构型为_______ 。
(2)C、N、O、S四种元素中,电负性最大的是_______ 。1mol[Co(NH3)6]Cl2中含有 键的数目为
键的数目为_______ ;已知NF3比NH3的沸点低得多,试解释原因_______ 。
(3)叠氮化钠(NaN3)用于汽车的安全气囊, 结构如图甲。
结构如图甲。 中存在的两个大
中存在的两个大 键可用符号
键可用符号 表示,一个
表示,一个 中键合电子(形成化学键的电子)总数为
中键合电子(形成化学键的电子)总数为_______ 。叠氮酸(HN3)结构如图乙,分子中②号N原子的杂化方式为_______ 。
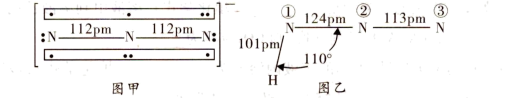
(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Fe3+配合物的结构如图丙所示,1mol该螯合物中通过螯合作用形成的配位键有_______ mol。
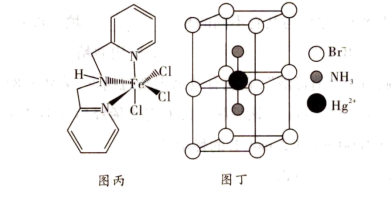
(5)某含氮的化合物晶胞结构如图丁所示,Br-作简单立方堆积,两个立方体共用的面中心存在一个Hg,NH3位于立方体的体心,相邻的Br的距离均为apm,阿伏加德罗常数的值为NA该物质的化学式为_______ ,该晶体的密度为_______ g·cm-3。
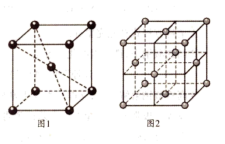
(6)Fe3+可以与SCN-、CN-等形成配合物。与SCN-互为等电子体且为非极性分子的化学式为_______ 。在一定条件下铁形成的晶体的基本结构单元如图1和图2所示,则图1和图2的结构中铁原子的配位数之比为_______ ,两种晶体中空间利用率较高的是_______ (填“图1”或“图2”)。
(1)基态氮原子价电子的轨道表达式(价电子排布图)为
(2)C、N、O、S四种元素中,电负性最大的是
 键的数目为
键的数目为(3)叠氮化钠(NaN3)用于汽车的安全气囊,
 结构如图甲。
结构如图甲。 中存在的两个大
中存在的两个大 键可用符号
键可用符号 表示,一个
表示,一个 中键合电子(形成化学键的电子)总数为
中键合电子(形成化学键的电子)总数为
(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Fe3+配合物的结构如图丙所示,1mol该螯合物中通过螯合作用形成的配位键有

(5)某含氮的化合物晶胞结构如图丁所示,Br-作简单立方堆积,两个立方体共用的面中心存在一个Hg,NH3位于立方体的体心,相邻的Br的距离均为apm,阿伏加德罗常数的值为NA该物质的化学式为
(6)Fe3+可以与SCN-、CN-等形成配合物。与SCN-互为等电子体且为非极性分子的化学式为

您最近一年使用:0次



