1 . 关于CO2说法正确的是( )
| A.CO2是直线型结构 | B.碳原子采取sp3杂化 |
| C.CO2分子中含非极性键 | D.CO2为极性分子 |
您最近一年使用:0次
2020-11-21更新
|
266次组卷
|
2卷引用:辽宁省大连市普兰店区第一中学2021届高三第一阶段考试化学试题
解题方法
2 . 金属镍及其化合物在合金材料以及催化剂等方面应用广泛。回答下列问题:
(1)基态Ni原子的核外电子排布式为____________________ ,有__________ 个未成对电子。
(2)已知镍与铜的第二电离能分别为INi=1753 kJ·mol-1,ICu=1958 kJ·mol-1,ICu>INi的原因是______________________________________________________________________ 。
(3)Ni2+常与丁二酮肟(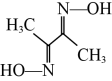 )形成图A所示的配合物,图B是硫代氧的结果:
)形成图A所示的配合物,图B是硫代氧的结果:
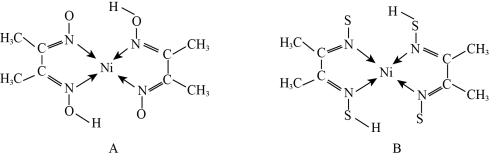
①熔点大小:A_________ (填“>”或“<”)B,其原因是____________________________ 。
②Ni2+与丁二酮肟之间形成的化学键称为__________ 。
③A中碳原子的杂化轨道类型是__________ 。
(4)硝酸镍[Ni(NO3)2]常用于有机化学合成中,阴离子的空间构型为__________ 。
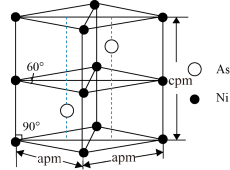
(5)某砷镍合金的晶胞结构如图所示。阿伏加 德罗常数的值为NA,该晶体的密度ρ=_________ g·cm-3(列出计算式即可)。
(1)基态Ni原子的核外电子排布式为
(2)已知镍与铜的第二电离能分别为INi=1753 kJ·mol-1,ICu=1958 kJ·mol-1,ICu>INi的原因是
(3)Ni2+常与丁二酮肟(
 )形成图A所示的配合物,图B是硫代氧的结果:
)形成图A所示的配合物,图B是硫代氧的结果:
①熔点大小:A
②Ni2+与丁二酮肟之间形成的化学键称为
③A中碳原子的杂化轨道类型是
(4)硝酸镍[Ni(NO3)2]常用于有机化学合成中,阴离子的空间构型为
(5)某砷镍合金的晶胞结构如图所示。阿伏加 德罗常数的值为NA,该晶体的密度ρ=

您最近一年使用:0次
解题方法
3 . 电能是一种无污染、可再生的二级能源。储电材料种类繁多。如图是两种储电材料,请阅读试题,观察图片,回答问题。
Ⅰ.新型碳氮材料的储电能力应用前景广阔。其基本构成单元如图所示。
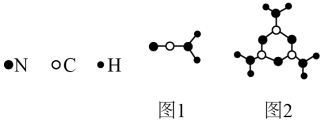
(1)图1中化学键σ键与π键之比为________ ;图2中碳原子的杂化方式为________ 。
(2)在基态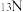 原子中,核外存在
原子中,核外存在_____ 对自旋相反的电子,核外电子占据的最高能级的电子云轮廓图为____ 形。
(3)碳的最高价含氧酸根的空间构型是__________ ;硝酸的酸性强于亚硝酸的原因是__________ 。
Ⅱ.传统锂电池的主要成分是 ,其晶胞结构如图所示;因结构中存在笼状空隙,可以与
,其晶胞结构如图所示;因结构中存在笼状空隙,可以与 和
和 发生位置替换,形成储电性能更加优良的化合物
发生位置替换,形成储电性能更加优良的化合物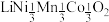 。
。
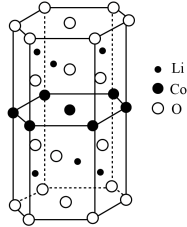
(4)基态 原子的价电子排布式为
原子的价电子排布式为_____________ ;化合物 中O元素在晶胞中的位置,除了位于正六棱柱的顶点外,其他具体位置是
中O元素在晶胞中的位置,除了位于正六棱柱的顶点外,其他具体位置是__________ 。
(5)已知化合物中各原子半径依次为: ,晶胞的棱长为m,底边边长为n,该晶体的空间利用率的计算表达式为
,晶胞的棱长为m,底边边长为n,该晶体的空间利用率的计算表达式为__________ (用含有a、b、c、d、e、m、n的式子表示)。
Ⅰ.新型碳氮材料的储电能力应用前景广阔。其基本构成单元如图所示。

(1)图1中化学键σ键与π键之比为
(2)在基态
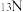 原子中,核外存在
原子中,核外存在(3)碳的最高价含氧酸根的空间构型是
Ⅱ.传统锂电池的主要成分是
 ,其晶胞结构如图所示;因结构中存在笼状空隙,可以与
,其晶胞结构如图所示;因结构中存在笼状空隙,可以与 和
和 发生位置替换,形成储电性能更加优良的化合物
发生位置替换,形成储电性能更加优良的化合物 。
。
(4)基态
 原子的价电子排布式为
原子的价电子排布式为 中O元素在晶胞中的位置,除了位于正六棱柱的顶点外,其他具体位置是
中O元素在晶胞中的位置,除了位于正六棱柱的顶点外,其他具体位置是(5)已知化合物中各原子半径依次为:
 ,晶胞的棱长为m,底边边长为n,该晶体的空间利用率的计算表达式为
,晶胞的棱长为m,底边边长为n,该晶体的空间利用率的计算表达式为
您最近一年使用:0次
名校
解题方法
4 . 近日,《自然—通讯》发表了我国复旦大学魏大程团队开发的一种共形六方氮化硼修饰技术,可直接在二氧化硅表面生长高质量六方氮化硼薄膜。
(1)下列N原子的电子排布图表示的状态中,能量最高的是___ ,能量最低的是___ (用字母表示)。
A.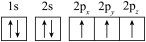 B.
B.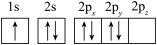
C.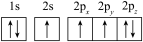 D.
D.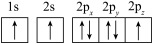
(2)第二周期主族元素中,按第一电离能大小排序,第一电离能在B和N之间的元素有___ 种。
(3)Na与N形成的NaN3可用于制造汽车的安全气囊,其中阴离子的空间构型为___ ,Na在空气中燃烧则发出黄色火焰,这种黄色焰色用光谱仪摄取的光谱为___ 光谱(填“发射”或“吸收”)。
(4)已知NH3分子的键角约为107°,而同主族磷的氢化物PH3分子的键角约为94°,试用价层电子对互斥理论解释NH3的键角比PH3的键角大的原因:___ 。
(5)BH3·NH3是一种有效、安全的固体储氢材料,可由BH3与NH3反应生成,B与N之间形成配位键,氮原子提供___ ,在BH3·NH3中B原子的杂化方式为___ 。它的性质与乙烷有所不同:在标准状况下为无色无味的白色固体,在水中溶解度也较大,其原因是___ 。
(6)立方氮化硼属于原子晶体,其晶胞结构如图1所示,可认为氮原子处于硼原子围成的某种空隙中,则氮原子处于硼原子围成的___ (填空间结构)空隙中。图2是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”标明N的相对位置___ 。

已知立方氮化硼的密度为dg·cm-3,阿伏加 德罗常数的值为NA,则晶胞中硼原子与氮原子的最近距离为___ nm。(只要求列算式)
(1)下列N原子的电子排布图表示的状态中,能量最高的是
A.
 B.
B.
C.
 D.
D.
(2)第二周期主族元素中,按第一电离能大小排序,第一电离能在B和N之间的元素有
(3)Na与N形成的NaN3可用于制造汽车的安全气囊,其中阴离子的空间构型为
(4)已知NH3分子的键角约为107°,而同主族磷的氢化物PH3分子的键角约为94°,试用价层电子对互斥理论解释NH3的键角比PH3的键角大的原因:
(5)BH3·NH3是一种有效、安全的固体储氢材料,可由BH3与NH3反应生成,B与N之间形成配位键,氮原子提供
(6)立方氮化硼属于原子晶体,其晶胞结构如图1所示,可认为氮原子处于硼原子围成的某种空隙中,则氮原子处于硼原子围成的

已知立方氮化硼的密度为dg·cm-3,阿伏加 德罗常数的值为NA,则晶胞中硼原子与氮原子的最近距离为
您最近一年使用:0次
2020-06-25更新
|
853次组卷
|
2卷引用:辽宁省大连市第二十四中学2020届高三下学期6月高考模拟(最后一模)理综化学试题
5 . (1)基态Fe原子的简化电子排布式为______________________ 。
(2)常温下,Fe(CO)5为黄色液体,易溶于非极性溶剂。写出CO的电子式______________ ;Fe(CO)5分子中σ键与π键之比为______________ 。
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中第一电离能最大的元素是_____________ ;(SCN)2分子中硫原子的杂化方式是_____________ ;
(4)硝酸铜溶于氨水形成[Cu(NH3)4](NO3)2的深蓝色溶液。
①[Cu(NH3)4](NO3)2中阴离子的立体构型是_________________ 。
②与NH3互为等电子体的一种阴离子为_____________ (填化学式);氨气在一定的压强下,测得的密度比该压强下理论密度略大,请解释原因__________ 。
(5)金属晶体可看成金属原子在三维空间中堆积而成,单质铝中铝原子采用铜型模式堆积,原子空间利用率为74%,则铝原子的配位数为________________ 。
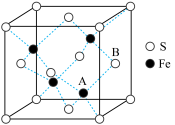
(6)铁和硫形成的某种晶胞结构如右图所示,晶胞参数a=xpm,则该物质的化学式为___________________ ;A原子距离B原子所在立方体侧面的最短距离为________________ pm(用x表示); 该晶胞的密度为____________ g·cm-3。(阿伏加 德罗常数用NA表示)
(2)常温下,Fe(CO)5为黄色液体,易溶于非极性溶剂。写出CO的电子式
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中第一电离能最大的元素是
(4)硝酸铜溶于氨水形成[Cu(NH3)4](NO3)2的深蓝色溶液。
①[Cu(NH3)4](NO3)2中阴离子的立体构型是
②与NH3互为等电子体的一种阴离子为
(5)金属晶体可看成金属原子在三维空间中堆积而成,单质铝中铝原子采用铜型模式堆积,原子空间利用率为74%,则铝原子的配位数为
(6)铁和硫形成的某种晶胞结构如右图所示,晶胞参数a=xpm,则该物质的化学式为

您最近一年使用:0次
解题方法
6 . 铝试剂:(NH4)3C19H8(OH)3(COO)3,其商品名为阿罗明拿,可用来鉴定溶液中的铝离子。请回答下列问题:
(1)碳原子价层电子的电子排布图_______ 。
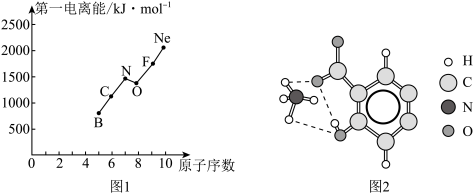
(2)第二周期部分元素的第一电离能变化趋势如图1所示,其中除氮元素外,其他元素的第一电离能自左而右依次增大的原因是____________ ;氮元素的第一电离能呈现异常的原因是____ 。
(3)经X射线衍射测得阿罗明拿的晶体结构,其局部结构如图2所示。
①从结构角度分析,阿罗明拿中的NH4+与氨分子的相同之处为_________ ,不同之处为_________ 。(填标号)
A 中心原子的杂化轨道类型
B 中心原子的价层电子对数
C 立体结构
②阿罗明拿中1个(NH4)3C19H8(OH)3(COO)3单元的C—Oσ键总数为_______ 个。分子中的大π键可用符号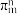 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则阿罗明拿中苯环的大π键应表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则阿罗明拿中苯环的大π键应表示为______________ 。
③图2中虚线代表氢键,其表示式为(NH4+)N-H---O(COO-)、____________ 、____________ 。
(4)阿罗明拿的晶体密度为d g·cm-3,其立方晶胞参数为a nm,晶胞中含有y个(NH4)3C19H8(OH)3(COO)3单元,该单元的相对质量为M,则y的计算表达式为______________ (NA表示阿伏加 德罗常数的值)。
(1)碳原子价层电子的电子排布图
(2)第二周期部分元素的第一电离能变化趋势如图1所示,其中除氮元素外,其他元素的第一电离能自左而右依次增大的原因是

(3)经X射线衍射测得阿罗明拿的晶体结构,其局部结构如图2所示。
①从结构角度分析,阿罗明拿中的NH4+与氨分子的相同之处为
A 中心原子的杂化轨道类型
B 中心原子的价层电子对数
C 立体结构
②阿罗明拿中1个(NH4)3C19H8(OH)3(COO)3单元的C—Oσ键总数为
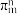 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则阿罗明拿中苯环的大π键应表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则阿罗明拿中苯环的大π键应表示为③图2中虚线代表氢键,其表示式为(NH4+)N-H---O(COO-)、
(4)阿罗明拿的晶体密度为d g·cm-3,其立方晶胞参数为a nm,晶胞中含有y个(NH4)3C19H8(OH)3(COO)3单元,该单元的相对质量为M,则y的计算表达式为
您最近一年使用:0次
名校
解题方法
7 . 氮和磷元素的单质和化合物在农药生产及工业制造业等领域用途非常广泛,请根据提示回答下列问题:
(1)科学家合成了一种阳离子为“N5n+”,其结构是对称的,5个N排成“V”形,每个N原子都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“N5n+”化学式为“N8”的离子晶体,其电子式为___ ,其中的阴离子的空间构型为___ 。
(2)2001年德国专家从硫酸铵中检出一种组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子的形式存在。N4H44+根系易吸收,但它遇到碱时会生成类似白磷的N4分子,不能被植物吸收。1个N4H44+中含有___ 个σ键。
(3)氨(NH3)和膦(PH3)是两种三角锥形气态氢化物,其键角分别为107°和93.6°,试分析PH3的键角小于NH3的原因___ 。
(4)P4S3可用于制造火柴,其分子结构如图1所示。
①P4S3分子中硫原子的杂化轨道类型为___ 。
②每个P4S3分子中含孤电子对的数目为___ 。
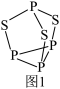
(5)某种磁性氮化铁的晶胞结构如图2所示,该化合物的化学式为___ 。若晶胞底边长为anm,高为cnm,则这种磁性氮化铁的晶体密度为__ g·cm−3(用含a、c和NA的式子表示)
(6)高温超导材料,是具有高临界转变温度(Te)能在液氮温度条件下工作的超导材料。高温超导材料镧钡铜氧化物中含有Cu3+。基态时Cu3+的电子排布式为[Ar]__ ;化合物中,稀土元素最常见的化合价是+3,但也有少数的稀土元素可以显示+4价,观察下面四种稀土元素的电离能数据,判断最有可能显示+4价的稀土元素是___ (填元素符号)。
几种稀土元素的电离能(单位:kJ·mol−1)
(1)科学家合成了一种阳离子为“N5n+”,其结构是对称的,5个N排成“V”形,每个N原子都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“N5n+”化学式为“N8”的离子晶体,其电子式为
(2)2001年德国专家从硫酸铵中检出一种组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子的形式存在。N4H44+根系易吸收,但它遇到碱时会生成类似白磷的N4分子,不能被植物吸收。1个N4H44+中含有
(3)氨(NH3)和膦(PH3)是两种三角锥形气态氢化物,其键角分别为107°和93.6°,试分析PH3的键角小于NH3的原因
(4)P4S3可用于制造火柴,其分子结构如图1所示。

①P4S3分子中硫原子的杂化轨道类型为
②每个P4S3分子中含孤电子对的数目为
(5)某种磁性氮化铁的晶胞结构如图2所示,该化合物的化学式为

(6)高温超导材料,是具有高临界转变温度(Te)能在液氮温度条件下工作的超导材料。高温超导材料镧钡铜氧化物中含有Cu3+。基态时Cu3+的电子排布式为[Ar]
几种稀土元素的电离能(单位:kJ·mol−1)
| 元素 | I1 | I2 | I3 | I4 |
| Sc(钪) | 633 | 1235 | 2389 | 7019 |
| Y(铱) | 616 | 1181 | 1980 | 5963 |
| La(镧) | 538 | 1067 | 1850 | 4819 |
| Ce(铈) | 527 | 1047 | 1949 | 3547 |
您最近一年使用:0次
2019-11-22更新
|
374次组卷
|
2卷引用:辽宁省六校协作体2020届高三上学期期中考试化学试题
名校
8 . 能说明BF3分子的四个原子在同一平面的理由是
| A.三个B—F键的键能相同 | B.三个B—F键的键长相同 |
| C.任意两个B—F键之间的夹角为120° | D.三个B—F键为极性共价键 |
您最近一年使用:0次
2018-02-12更新
|
236次组卷
|
2卷引用:辽宁省渤海大学附属高级中学2022届高三考前测试化学试题
9 . 钾、氟及锌的相关化合物用途非常广泛。回答下列问题:
(1)基态锌原子的价电子排布式为___________ ;K、F、Zn的电负性从大到小的顺序为___________ 。
(2)Zn与Ca位于同一周期且最外层电子数相等,钙的熔点与沸点均比锌高,其原因是_______________ 。
(3)OF2分子的几何构型为___________ ,中心原子的杂化类型为___________ 。
(4)KOH 与O3反应可得到KO3(臭氧化钾),KO3 中除σ键外,还存在___________ ;与O3-互为等电子体的分子为___________ (任 写一种 )。
(5)K、F、Zn组成的一种晶体结构如图所示,其晶胞参数为a=0.4058 nm。
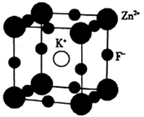
①晶胞中Zn2+的配位数为___________ 个。
②晶胞中紧邻的两个F-间的距离为_______________________ (列出算式即可)nm。
③该晶体的密度为___________ (列出算式即可,用NA表示阿伏伽德罗常数的数值)g·cm-3。
(1)基态锌原子的价电子排布式为
(2)Zn与Ca位于同一周期且最外层电子数相等,钙的熔点与沸点均比锌高,其原因是
(3)OF2分子的几何构型为
(4)KOH 与O3反应可得到KO3(臭氧化钾),KO3 中除σ键外,还存在
(5)K、F、Zn组成的一种晶体结构如图所示,其晶胞参数为a=0.4058 nm。

①晶胞中Zn2+的配位数为
②晶胞中紧邻的两个F-间的距离为
③该晶体的密度为
您最近一年使用:0次
2018-01-07更新
|
409次组卷
|
6卷引用:【市级联考】辽宁省朝阳市2019届高三上学期模拟联考理科综合化学试题
解题方法
10 . 已知:周期表中前四周期的六种元素A、B、C、D、E、F核电荷数依次增大,其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F2+离子核外各层电子均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为____ 。(用元素符号表示)
(2)B的氯化物的熔点比D的氯化物的熔点高,理由是____________________ 。
(3)E的最高价氧化物分子的空间构型是__________ ,是____ 分子(填“极性”“非极性”)。
(4)F原子的核外电子排布式是________________ 。
(5)E、F形成某种化合物有如图所示两种晶体结构(深色球表示F原子),其化学式为_________ 。(a)中E原子的配位数为____ 。若在(b)的结构中取出一个平行六面体作为晶胞,则平均一个晶胞中含有____ 个F原子。结构(a)与(b)中晶胞的原子空间利用率相比,(a)____ (b)(填“>”“<”或“=”)。
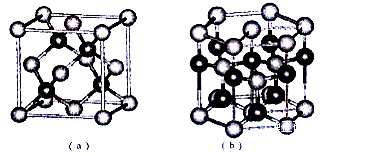
(1)A、B、C、D的第一电离能由小到大的顺序为
(2)B的氯化物的熔点比D的氯化物的熔点高,理由是
(3)E的最高价氧化物分子的空间构型是
(4)F原子的核外电子排布式是
(5)E、F形成某种化合物有如图所示两种晶体结构(深色球表示F原子),其化学式为

您最近一年使用:0次
2017-10-07更新
|
227次组卷
|
3卷引用:辽宁省师范大学附属中学2018届高三上学期期中考试化学试题



