名校
解题方法
1 . 下列说法正确的是
A.最外层都只有 个电子的元素原子性质一定相似 个电子的元素原子性质一定相似 |
| B.同一周期元素中,第一电离能随原子序数增加而增大 |
C. 晶体中存在 晶体中存在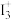 离子, 离子,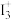 离子的几何构型为 离子的几何构型为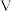 形 形 |
D. 是一种含有极性键和非极性键的非极性分子 是一种含有极性键和非极性键的非极性分子 |
您最近一年使用:0次
2022-03-22更新
|
159次组卷
|
3卷引用:天津市十二区县重点学校2020届高三毕业班联考(一)化学试题
名校
解题方法
2 . 镍能形成多种配合物如正四面体形的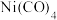 、正方形的
、正方形的 和正八面体形的
和正八面体形的 等。下列说法不正确的是
等。下列说法不正确的是
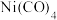 、正方形的
、正方形的 和正八面体形的
和正八面体形的 等。下列说法不正确的是
等。下列说法不正确的是A. 分子内σ键和π键个数之比为1:2 分子内σ键和π键个数之比为1:2 |
B. 的空间结构为三角锥形 的空间结构为三角锥形 |
C. 在形成配合物时,其配位数只能为4 在形成配合物时,其配位数只能为4 |
D.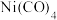 中,镍元素是 中,镍元素是 杂化 杂化 |
您最近一年使用:0次
2021-09-29更新
|
571次组卷
|
4卷引用:2020年天津卷化学高考真题变式题1-12
(已下线)2020年天津卷化学高考真题变式题1-122021年山东高考化学试题变式题1-10河南省辉县市一中2020-2021学年高二(培优班)下学期第二次阶段性考试化学试题(已下线)第3.4讲 配合物与超分子-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)
解题方法
3 . 2019年的化学诺贝尔奖颁给了为锂电池研究作出贡献的三位科学家,其研究的是两种常见锂电池:一种是采用镍钴锰酸锂Li(NiCoMn)O2或镍钴铝酸锂为正极的“三元材料锂电池”;另一种是采用磷酸铁锂(LiFePO4)为正极的电池。请回答下列问题:
(1)Mn位于元素周期表的_______ 区(填“s”或“p”或“d”或“ds”或“f”),基态钴原子的未成对电子数为_______ ,1mol [CoCl (NH3)5] Cl2 中含σ键数目为_______ NA。
(2)PH3是_______ 分子(填“极性”或“非极性”),其在水中的溶解性比NH3小,原因是_______ 。
(3)硫酸镍溶于氨水形成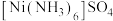 蓝色溶液。
蓝色溶液。
①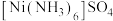 中阴离子的立体构型是
中阴离子的立体构型是_______ 。
②向硫酸铜溶液逐滴加入氨水,会先生成难溶物而后溶解也能形成深蓝色溶液,写出难溶物溶于氨水的离子方程式:_______ 。
③单质铜及镍都是由_______ 键形成的晶体;元素铜与镍的第二电离能分别为: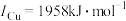 ,
, ,
,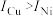 的原因是
的原因是_______ 。
(4)硫化锂Li2S(摩尔质量Mg∙mol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ag·cm-3,则距离最近的两个S2-的距离是_______ nm。(用含a、M、NA的计算式表示)
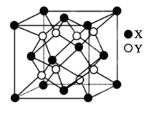
(1)Mn位于元素周期表的
(2)PH3是
(3)硫酸镍溶于氨水形成
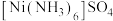 蓝色溶液。
蓝色溶液。①
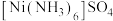 中阴离子的立体构型是
中阴离子的立体构型是②向硫酸铜溶液逐滴加入氨水,会先生成难溶物而后溶解也能形成深蓝色溶液,写出难溶物溶于氨水的离子方程式:
③单质铜及镍都是由
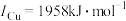 ,
, ,
,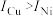 的原因是
的原因是(4)硫化锂Li2S(摩尔质量Mg∙mol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ag·cm-3,则距离最近的两个S2-的距离是

您最近一年使用:0次
名校
解题方法
4 . 从结构角度分析,下列说法错误的是
A.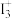 的立体构型为V形,中心原子的杂化方式为sp3 的立体构型为V形,中心原子的杂化方式为sp3 |
| B.ZnCO3中,阴离子立体构型为平面三角形,C原子的杂化方式为sp2 |
| C.因HF分子间存在氢键,所以HX中其沸点最高 |
| D.二氧化硅中硅,氧原子都是为sp3杂化,是极性分子 |
您最近一年使用:0次
2020-10-29更新
|
298次组卷
|
3卷引用:天津市南开中学2023届高三5月月考化学试题
5 . 利用太阳能光解水,制备的H2用于还原CO2合成有机物,可实现资源的再利用。回答下列问题:
Ⅰ.半导体光催化剂浸入水或电解质溶液中,光照时可在其表面得到产物
(1)下图为该催化剂在水中发生光催化反应的原理示意图。光解水能量转化形式为___________ 。
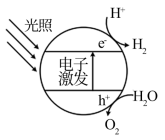
(2)若将该催化剂置于Na2SO3溶液中,产物之一为 ,另一产物为
,另一产物为__________ 。若将该催化剂置于AgNO3溶液中,产物之一为O2,写出生成另一产物的离子反应式__________ 。
Ⅱ.用H2还原CO2可以在一定条下合成CH3OH(不考虑副反应):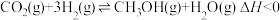
(3)某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol‧L-1和3 a mol‧L-1,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的值为___________ 。
(4)恒压下,CO2和H2的起始物质的量比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O。
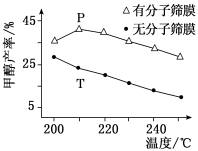
①甲醇平衡产率随温度升高而降低的原因为____________ 。
②P点甲醇产率高于T点的原因为___________ 。
③根据上图,在此条件下采用该分子筛膜时的最佳反应温度为___________ °C。
Ⅲ.调节溶液pH可实现工业废气CO2的捕获和释放
(5) 的空间构型为
的空间构型为__________ 。已知25℃碳酸电离常数为Ka1、Ka2,当溶液pH=12时, =1:
=1:_______ :__________ 。
Ⅰ.半导体光催化剂浸入水或电解质溶液中,光照时可在其表面得到产物
(1)下图为该催化剂在水中发生光催化反应的原理示意图。光解水能量转化形式为

(2)若将该催化剂置于Na2SO3溶液中,产物之一为
 ,另一产物为
,另一产物为Ⅱ.用H2还原CO2可以在一定条下合成CH3OH(不考虑副反应):
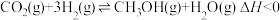
(3)某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol‧L-1和3 a mol‧L-1,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的值为
(4)恒压下,CO2和H2的起始物质的量比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O。

①甲醇平衡产率随温度升高而降低的原因为
②P点甲醇产率高于T点的原因为
③根据上图,在此条件下采用该分子筛膜时的最佳反应温度为
Ⅲ.调节溶液pH可实现工业废气CO2的捕获和释放
(5)
 的空间构型为
的空间构型为 =1:
=1:
您最近一年使用:0次
2020-07-11更新
|
5257次组卷
|
7卷引用:2020年天津卷化学高考试题
2020年天津卷化学高考试题(已下线)2020年天津卷化学高考真题变式题13-16(已下线)专题14 化学反应原理综合-2020年高考真题和模拟题化学分项汇编山东省济南市山东省实验中学西校2021届高三上学期10月份月考化学试题(已下线)难点6 化学反应原理的综合应用-2021年高考化学【热点·重点·难点】专练(新高考)(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)专题17 原理综合题
解题方法
6 . 我国科研人员在钠离子电池研究中又取得新突破。钠离子电池与锂离子电池工作原理相同、制造工艺相似,而且具有资源丰富、成本低廉、安全性能好等特点。一种钠离子电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解质溶液为的碳酸丙烯酯溶液。
回答下列问题:
(1)基态Na原子的电子排布式为__ ,最高能层电子云轮廓图形状为___ 。
(2)Te与S同主族,与 同周期,Te属于元素周期表中
同周期,Te属于元素周期表中__ 区元素,其基态原子的价电子排布图(即轨道表示式)为___ 。
(3)碳酸丙烯酯的结构简式为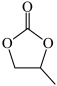 ,则其中π键和σ键的数目之比为
,则其中π键和σ键的数目之比为___ ,碳原子的杂化轨道类型为____ 。
(4)C元素的最高价氧化物的电子式为___ ,CO32-的VSEPR模型名称是___ ,ClO4-的立体构型是__ 。
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是__ ,该配离子包含的作用力为___ (填选项字母)。
A.极性键 B.金属键 C.氢键 D.配位键
(6)由原料制备负极材料的反应过程中,是否有电子转移___ (填“是”或者“否”)。
回答下列问题:
(1)基态Na原子的电子排布式为
(2)Te与S同主族,与
 同周期,Te属于元素周期表中
同周期,Te属于元素周期表中(3)碳酸丙烯酯的结构简式为
 ,则其中π键和σ键的数目之比为
,则其中π键和σ键的数目之比为(4)C元素的最高价氧化物的电子式为
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是
A.极性键 B.金属键 C.氢键 D.配位键
(6)由原料制备负极材料的反应过程中,是否有电子转移
您最近一年使用:0次
2020-05-19更新
|
148次组卷
|
2卷引用:天津市红桥区2020届高三下学期居家学习线上检测第一次模拟化学试题
名校
7 . 下列说法正确的是
| A.离子晶体中不含阴阳离子,只有溶液中才有阴阳离子 |
| B.BF3分子的立体构型:三角锥形 |
| C.非金属氧化物都是酸性氧化物 |
| D.电解质溶液导电的过程就是电解质溶液被电解的过程 |
您最近一年使用:0次
名校
解题方法
8 . 下列表述正确的是
A.Na2O2的电子式: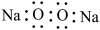 |
| B.N2的共价键类型:σ键和π键 |
C.中子数为30的Fe原子符号: Fe Fe |
| D.SO3分子的立体构型:三角锥形 |
您最近一年使用:0次
2020-03-09更新
|
1393次组卷
|
9卷引用:2020年天津市学业水平等级考适应性测试化学试题



