解题方法
1 . 碱式碳酸铜[2CuCO3·Cu(OH)2]可用于制造烟火等。在较低温度下,将Cu(NO3)2饱和溶液倒入一定浓度的Na2CO3溶液中,即有碱式碳酸铜生成。
(1)Cu2+基态核外电子排布式为___________ 。
(2)Cu2+在溶液中实际上是以水合离子[Cu(H2O)4]2+的形式存在的。1 mol[Cu(H2O)4]2+中含有σ键的数目为___________ 。
(3)CO 中C原子轨道杂化类型为
中C原子轨道杂化类型为___________ ;与CO2互为等电子体的一种阴离子为___________ (填化学式)。
(4)NO 的空间构型为
的空间构型为___________ (用文字描述)。
(5)Cu的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是___________ 。
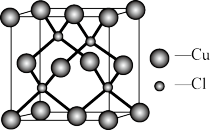
(1)Cu2+基态核外电子排布式为
(2)Cu2+在溶液中实际上是以水合离子[Cu(H2O)4]2+的形式存在的。1 mol[Cu(H2O)4]2+中含有σ键的数目为
(3)CO
 中C原子轨道杂化类型为
中C原子轨道杂化类型为(4)NO
 的空间构型为
的空间构型为(5)Cu的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是

您最近一年使用:0次
名校
解题方法
2 . 早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___________方法区分晶体、准晶体和非晶体。
(2)基态Fe原子有___________ 个未成对电子,基态Fe的电子排布式为___________ ,可用硫氰化钾检验Fe3+,形成的配合物的颜色为___________ 。
(3)甲醇催化氧化可得甲醛,甲醛与新制Cu(OH)2碱性溶液反应生成Cu2O沉淀。
① 甲醇的沸点比甲醛的高,其主要原因是___________ ;甲醛分子中碳原子的杂化类型为___________ 。
② 甲醛分子的空间构型是___________ ;1 mol甲醛分子中σ键的数目为___________ 。
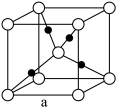
③Cu2O晶胞中结构如图所示。该晶体的密度为d g/cm3,设阿伏加德罗常数的值为NA,则该晶胞的体积为___________ cm3。
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___________方法区分晶体、准晶体和非晶体。
| A.观察自范性 | B.观察各向异性 | C.测定固定熔点 | D.进行X-射线衍射实验 |
(3)甲醇催化氧化可得甲醛,甲醛与新制Cu(OH)2碱性溶液反应生成Cu2O沉淀。
① 甲醇的沸点比甲醛的高,其主要原因是
② 甲醛分子的空间构型是
③Cu2O晶胞中结构如图所示。该晶体的密度为d g/cm3,设阿伏加德罗常数的值为NA,则该晶胞的体积为

您最近一年使用:0次
名校
解题方法
3 . NaH和NaAlH4都是重要的还原剂,一定条件下金属钠和H2反应生成NaH。NaH与水反应可生成H2,NaH与AlCl3反应可得到NaAlH4。下列说法错误的是
| A.NaAlH4中阴离子空间构型为正四面体 |
| B.NaH与AlCl3得到NaAlH4的反应属于氧化还原反应 |
| C.NaH在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3) |
| D.金属钠和H2反应生成NaH的反应体系需要控制无氧、无水和无酸等条件 |
您最近一年使用:0次
2020-12-06更新
|
876次组卷
|
5卷引用:山东省青岛市黄岛区2021届高三上学期期中考试化学试题
山东省青岛市黄岛区2021届高三上学期期中考试化学试题(已下线)练习14 分子的空间结构-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)河北省石家庄市第一中学2020-2021学年高二下学期学情反馈(一)化学试题
解题方法
4 . A、B、C、D、E、F为前四周期原子序数依次增大的六种元素,已知A元素的某种核素没有中子,B元素基态原子中有3个不同能级且各能级中的电子数相等,D元素的最外层电子数是其电子层数的3倍,E元素的焰色反应呈黄色,F元素是第四周期未成对电子数最多的元素。试回答下列问题:
(1)F原子的价层电子排布式为__________ ,D元素和E元素形成E2D2化学键类型_____ 。
(2)基态原子第一电离能C____ D(“>”或“<”),电负性C____ D(“>”或“<”) 。
(3)CD 中心原子杂化方式
中心原子杂化方式_____ ,CA3立体构型_____ 。
(4)E元素的焰色反应呈黄色,金属元素能产生焰色反应的微观原因为________ 。
(5)已知B元素的某种单质结构如图所示,且晶胞边长为a pm,B原子的摩尔质量为M g/mol,NA为阿伏加德罗常数,则两个最近的B原子之间的距离为__________ pm,该晶体的密度为__________ g/cm3。

(1)F原子的价层电子排布式为
(2)基态原子第一电离能C
(3)CD
 中心原子杂化方式
中心原子杂化方式(4)E元素的焰色反应呈黄色,金属元素能产生焰色反应的微观原因为
(5)已知B元素的某种单质结构如图所示,且晶胞边长为a pm,B原子的摩尔质量为M g/mol,NA为阿伏加德罗常数,则两个最近的B原子之间的距离为

您最近一年使用:0次
解题方法
5 . 中国在激光武器研发领域走在了世界的前列,而氟代硼酸钾(KBe2BO3F2)就是制备激光器的核心材料。回答下列问题:
(1)基态氟原子核外电子占据最高能级的电子云形状为___ 形。
(2)氟代硼酸钾中非金属原子的电负性由大到小顺序是___ 。
(3)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是___ ,中心原子的杂化形式为___ ;NaBH4中存在___ (填标号)。
a.离子键 b.氢键 C.σ键 d.π键
(4)[H2F][SbF6](氟锑酸)是一种超强酸,写出与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是___ 、___ (各举一例)。
(5)萤石[CaF2]是一种常用的助溶剂,其晶胞结构如图所示:
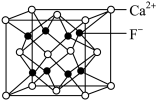
①在晶胞中Ca2+的配位数为___ 。
②若晶胞参数为anm,则CaF2晶胞的密度为___ g•cm-3(设NA为阿伏加德罗常数的值)。
(1)基态氟原子核外电子占据最高能级的电子云形状为
(2)氟代硼酸钾中非金属原子的电负性由大到小顺序是
(3)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是
a.离子键 b.氢键 C.σ键 d.π键
(4)[H2F][SbF6](氟锑酸)是一种超强酸,写出与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是
(5)萤石[CaF2]是一种常用的助溶剂,其晶胞结构如图所示:

①在晶胞中Ca2+的配位数为
②若晶胞参数为anm,则CaF2晶胞的密度为
您最近一年使用:0次
名校
解题方法
6 . 铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe2+的简化电子排布式为______________________ 。
(2)FeCl3的熔点为306 ℃,沸点为315 ℃, FeCl3的晶体类型是_________ 。FeSO4常作净水剂和补铁剂,SO 的立体构型是
的立体构型是___________________ 。
(3)实验室用KSCN溶液、苯酚(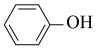 )检验Fe3+。N、O、S三种元素的第一电离能由大到小的顺序为
)检验Fe3+。N、O、S三种元素的第一电离能由大到小的顺序为____________________ (用元素符号表示),苯酚中碳原子的杂化轨道类型为__________________________ 。
(4)羰基铁[Fe (CO)5]可用作催化剂、汽油抗爆剂等。1 mol Fe (CO)5分子中含_______ mol σ键,与CO互为等电子体的离子是_______________ (填化学式,写一种)。
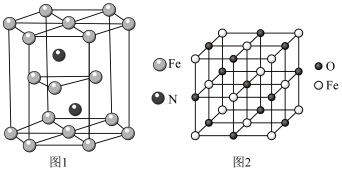
(5)氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为________ 。
(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3, NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____________ ;Fe2+与O2-最短核间距为_________ pm。
(1)基态Fe2+的简化电子排布式为
(2)FeCl3的熔点为306 ℃,沸点为315 ℃, FeCl3的晶体类型是
 的立体构型是
的立体构型是(3)实验室用KSCN溶液、苯酚(
 )检验Fe3+。N、O、S三种元素的第一电离能由大到小的顺序为
)检验Fe3+。N、O、S三种元素的第一电离能由大到小的顺序为(4)羰基铁[Fe (CO)5]可用作催化剂、汽油抗爆剂等。1 mol Fe (CO)5分子中含
(5)氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为
(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3, NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为

您最近一年使用:0次
解题方法
7 . 钛的化合物在化工、医药、材料等领域具有广泛应用。回答下列问题:
(1)基态 Ti 原子的未成对电子数是______ ,基态 Ti 原子 4s 轨道上的一个电子激发到 4p轨道上形成激发态,写出该激发态价层电子排布式____ 。
(2)钛卤化物的熔点和沸点如表所示,TiCl4、TiBr4、TiI4熔沸点依次升高的原因是_____ ;TiF4熔点反常的原因是_____ 。
(3)Ti 可形成配合物[Ti(urea)6](ClO4)3,urea 表示尿素,其结构如图所示:
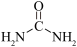
①配合物中 Ti 化合价为_____ 。
②尿素中 C 原子的杂化轨道类型为_____ 。
③ 的立体构型为
的立体构型为_____ 。
(4)如图为具有较高催化活性材料金红石的晶胞结构,其化学式为______ ;已知该晶体 的密度为ρg·cm-3,Ti、O 原子半径分别为 a pm 和 b pm,阿伏加 德罗常数的值为 NA,则金红石晶体的空间利用率为______ (列出计算式)。
(1)基态 Ti 原子的未成对电子数是
(2)钛卤化物的熔点和沸点如表所示,TiCl4、TiBr4、TiI4熔沸点依次升高的原因是
TiF4 | TiCl4 | TiBr4 | TiI4 | |
熔点/℃ | 377 | -24 | 38 | 150 |
沸点/℃ | — | 136 | 230 | 377 |
(3)Ti 可形成配合物[Ti(urea)6](ClO4)3,urea 表示尿素,其结构如图所示:

①配合物中 Ti 化合价为
②尿素中 C 原子的杂化轨道类型为
③
 的立体构型为
的立体构型为(4)如图为具有较高催化活性材料金红石的晶胞结构,其化学式为

您最近一年使用:0次
名校
解题方法
8 . 已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3p轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D的第一电离能由小到大的顺序为___________ 。
(2)C的氢化物分子是_____ (填“极性”或“非极性”)分子。
(3)化合物BD3的分子空间构型是______ 。
(4)E的一种常见配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断E(CO)5的晶体类型为__________ ;E(CO)5中的配体CO与N2、CN-等互为等电子体,写出CO分子的结构式_______ 。
(5)金属E单质的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。体心立方晶胞和面心立方晶胞中实际含有的E原子个数之比为___________ 。

(1)A、B、C、D的第一电离能由小到大的顺序为
(2)C的氢化物分子是
(3)化合物BD3的分子空间构型是
(4)E的一种常见配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断E(CO)5的晶体类型为
(5)金属E单质的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。体心立方晶胞和面心立方晶胞中实际含有的E原子个数之比为

您最近一年使用:0次
2020-09-04更新
|
261次组卷
|
2卷引用:山东省济宁市微山县第二中学2021届高三上学期开学收心考试化学试题
名校
解题方法
9 . 氮化硼(BN)晶体有多种结构。回答下列问题:
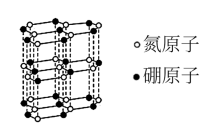
(1)六方氮化硼的结构与石墨相似(如图所示),具有层状结构,可作高温润滑剂。该晶体中存在的作用力类型有___________ ,六方氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为___________ 。
(2)六方氮化硼在高温高压下,可以转化为立方氮化硼(如图所示),立方氮化硼密度为 ,该c原子的坐标参数为
,该c原子的坐标参数为 ,e为(
,e为( ,
, ,0),f为(
,0),f为( ,0,
,0, )。
)。
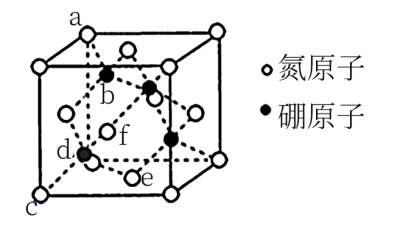
①由题干所给的坐标参数知,d原子的坐标参数为________ 。
②B原子填充在N原子的四面体空隙,且占据此类空隙的比例为________ 。
③a位置N原子与b位置B原子的距离为_______ cm。
(1)六方氮化硼的结构与石墨相似(如图所示),具有层状结构,可作高温润滑剂。该晶体中存在的作用力类型有

(2)六方氮化硼在高温高压下,可以转化为立方氮化硼(如图所示),立方氮化硼密度为
 ,该c原子的坐标参数为
,该c原子的坐标参数为 ,e为(
,e为( ,
, ,0),f为(
,0),f为( ,0,
,0, )。
)。
①由题干所给的坐标参数知,d原子的坐标参数为
②B原子填充在N原子的四面体空隙,且占据此类空隙的比例为
③a位置N原子与b位置B原子的距离为
您最近一年使用:0次
名校
解题方法
10 . 一定条件下,Fe、HCN与K2CO3可发生反应Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O。
请回答下列问题:
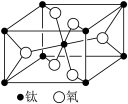
(1)金属铁的晶胞如下图所示,其配位数为________ 。

(2)HCN分子的结构式为________ ,写出一种与CN-互为等电子体的阴离子:________ 。
(3)NH3的键角大于H2O,原因是____________ 。
(4)K4Fe(CN)6的中心离子的价层电子排布图为__________ 。
(5)C、N、O、H的第一电离能由小到大的顺序为___________ 。
(6)冰的晶体结构模型如图所示,其晶胞结构(如图所示)与金刚石的晶胞结构相似,水分子间以氢键相连,则一个晶胞中含有_____ 个氢键,用NA表示阿伏加 德罗常数的值,若氢键的键长为dnm,则晶体密度ρ=________ (用含有d、NA的代数式表示)g·cm-3。

请回答下列问题:
(1)金属铁的晶胞如下图所示,其配位数为

(2)HCN分子的结构式为
(3)NH3的键角大于H2O,原因是
(4)K4Fe(CN)6的中心离子的价层电子排布图为
(5)C、N、O、H的第一电离能由小到大的顺序为
(6)冰的晶体结构模型如图所示,其晶胞结构(如图所示)与金刚石的晶胞结构相似,水分子间以氢键相连,则一个晶胞中含有

您最近一年使用:0次



