名校
1 . 硅与储及其化合物在医药、生产、生活中有着重要的作用。回答下列问题:
(1)某铁的配合物结构如图所示,可由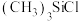 与
与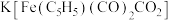 混合加热制得。
混合加热制得。_______ 区。C、O、H三种元素的电负性从大到小的顺序为_______ 。
②配位体CO分子中碳元素提供孤电子对的原因:_______ 。铁的配合物中碳元素的杂化方式共有_______ 种。
③在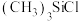 、
、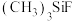 、
、 中,
中,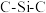 键角最大的是
键角最大的是_______ 。
(2)硅和卤素单质反应可以得到SiX4,SiX4的熔沸点如下表(已知:绝对零度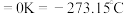 ):
):
0℃时,SiF4、SiCl4、SiBr4、SiI4呈液态的是_______ (填化学式),沸点依次升高的原因是_______ ,气态SiX4分子的空间结构是_______ 。
(3)一种含锗的化合物应用于太阳能电池,其晶胞为长方体,结构如图(a):_______ (填“b”“c”或“d”)图也能表示此化合物的晶胞。
②已知晶胞(a)密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为_______ (用含x、y、z和ρ的式子表示)。
(1)某铁的配合物结构如图所示,可由
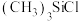 与
与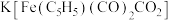 混合加热制得。
混合加热制得。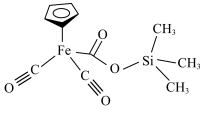
②配位体CO分子中碳元素提供孤电子对的原因:
③在
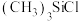 、
、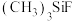 、
、 中,
中, 键角最大的是
键角最大的是(2)硅和卤素单质反应可以得到SiX4,SiX4的熔沸点如下表(已知:绝对零度
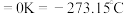 ):
):| SiF4 | SiCl4 | SiBr4 | SiI4 | |
| 熔点/K | 183.0 | 203.2 | 278.6 | 393.7 |
| 沸点/K | 187.2 | 330.8 | 427.2 | 560.7 |
(3)一种含锗的化合物应用于太阳能电池,其晶胞为长方体,结构如图(a):
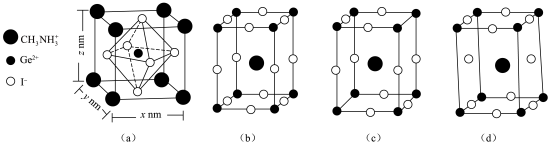
②已知晶胞(a)密度为
 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为
您最近一年使用:0次
2024-05-31更新
|
59次组卷
|
2卷引用:山西省运城市三晋卓越联盟2023-2024学年高二下学期期中考试化学试题
2 . 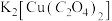 可用于功能材料的制备。下列说法正确的是
可用于功能材料的制备。下列说法正确的是
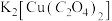 可用于功能材料的制备。下列说法正确的是
可用于功能材料的制备。下列说法正确的是| A.碳原子与氮原子形成的(CN)2属于极性分子 |
| B.钾晶体中1个K+只与1个价层电子存在强烈的相互作用 |
| C.第二周期中,第一电离能大于氧元素的有三种 |
| D.基态铜原子的4s电子能量较高,总是在比3s电子离核更远的地方运动 |
您最近一年使用:0次
2024-05-22更新
|
33次组卷
|
2卷引用:山西省运城市三晋卓越联盟2023-2024学年高二下学期期中考试化学试题
名校
3 . 苯、甲苯,乙苯、二甲苯等均是重要的芳香族化合物。回答下列问题:
(1)苯的实验式为___________ 。
(2)1mol苯与3molH2发生加成反应,碳的杂化类型由___________ ,转化为___________ 。
(3)甲苯的一氯代物有___________ 种,由甲苯制备2,4,6-三硝基甲苯(TNT)的化学方程式为___________ 。
(4)向对二甲苯中加入足量酸性高锰酸钾溶液,生成的有机物中的官能团名称___________ 。
(5)如图是某同学设计的制取少量溴苯(熔点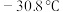 ,沸点
,沸点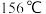 )的装置。实验时,打开K,向圆底烧瓶中滴加苯和溴的混合液,发现a中有微沸现象,b中的液体逐渐变为浅红色,c中有少量气泡产生,反应结束后,对a中的液体进行后续处理即可获得溴苯。
)的装置。实验时,打开K,向圆底烧瓶中滴加苯和溴的混合液,发现a中有微沸现象,b中的液体逐渐变为浅红色,c中有少量气泡产生,反应结束后,对a中的液体进行后续处理即可获得溴苯。___________ 。
②该实验___________ (填“放热”或“吸热”)。
③c中看到的现象证明___________ 。
④得到粗溴苯后,用如下操作进行精制:
①水洗 ②蒸馏 ③用干燥剂干燥 ④10%NaOH溶液洗
正确的操作顺序是___________ (填序号)。
A.①②③④② B.②④②③① C.④①③①② D.①④①③②
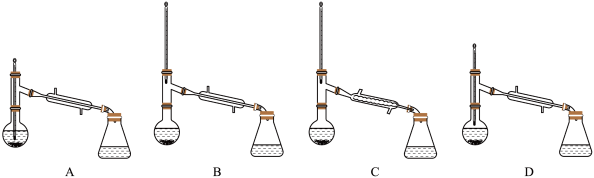
⑤进行蒸馏操作中,仪器选择及安装(夹持及加热装置已省略)均正确的是___________ (填字母)。
(1)苯的实验式为
(2)1mol苯与3molH2发生加成反应,碳的杂化类型由
(3)甲苯的一氯代物有
(4)向对二甲苯中加入足量酸性高锰酸钾溶液,生成的有机物中的官能团名称
(5)如图是某同学设计的制取少量溴苯(熔点
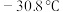 ,沸点
,沸点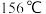 )的装置。实验时,打开K,向圆底烧瓶中滴加苯和溴的混合液,发现a中有微沸现象,b中的液体逐渐变为浅红色,c中有少量气泡产生,反应结束后,对a中的液体进行后续处理即可获得溴苯。
)的装置。实验时,打开K,向圆底烧瓶中滴加苯和溴的混合液,发现a中有微沸现象,b中的液体逐渐变为浅红色,c中有少量气泡产生,反应结束后,对a中的液体进行后续处理即可获得溴苯。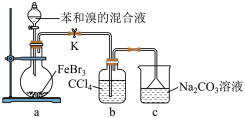
②该实验
③c中看到的现象证明
④得到粗溴苯后,用如下操作进行精制:
①水洗 ②蒸馏 ③用干燥剂干燥 ④10%NaOH溶液洗
正确的操作顺序是
A.①②③④② B.②④②③① C.④①③①② D.①④①③②
⑤进行蒸馏操作中,仪器选择及安装(夹持及加热装置已省略)均正确的是
您最近一年使用:0次
2024-05-21更新
|
209次组卷
|
2卷引用:山西省运城市三晋卓越联盟2023-2024学年高二下学期期中考试化学试题
名校
解题方法
4 . 下列离子的VSEPR模型与离子的空间立体构型一致的是
A. | B. | C. | D. |
您最近一年使用:0次
2023-12-21更新
|
587次组卷
|
42卷引用:山西省太原市2020-2021学年高二下学期期中质量监测理科化学试题
山西省太原市2020-2021学年高二下学期期中质量监测理科化学试题黑龙江省大庆市第四中学2018-2019学年高二下学期期中考试化学试题广西壮族自治区崇左市天等县高级中学2019-2020学年高二下学期期中考试理科综合化学试题浙江省湖州市三贤联盟2021-2022学年高二下学期期中联考化学试题四川省乐山市峨眉第二中学2022-2023学年高二上学期期中考试化学试题广东省肇庆市封开县广信中学等几校2022-2023学年高二下学期期中联考化学试题天津市第四十七中学2022-2023学年高二下学期期中考试化学试题浙江省台州市三门启超中学2023-2024学年高二上学期期中考试化学试题 宁夏育才中学勤行校区2016-2017学年高二下学期第一次(3月)月考化学试题【全国百强校】天津市静海区第一中学2018-2019学年高二下学期5月月考化学试题宁夏海原县第一中学2019-2020学年高二下学期期末考试化学试题(已下线)第二单元 化学键与分子间作用力(基础过关)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)福建省莆田第十五中学2019-2020学年高二下学期期末考试化学试题人教2019选择性必修2第二章第二节 分子的空间结构课后习题天津市红桥区2020-2021学年高三上学期期末考试化学试题黑龙江省绥化市第九中学2021-2022学年高二4月月考化学试题重庆市九龙坡区2021~2022学年高二下学期期末统考化学试题安徽省滁州市九校2021-2022学年高二下学期3月月考化学试题云南省玉溪市江川区第一中学2021-2022学年高二下学期3月月考化学试题第二节 分子的空间结构 第1课时 分子结构的测定 多样的分子空间结构 价层电子对互斥模型云南省富宁县第一中学校2021-2022学年高二下学期开学考试化学题宁夏贺兰县景博中学2021-2022学年高二下学期第一次月考化学试题黑龙江省绥化市第二中学2022-2023年高三上学期第一次月考化学试题(已下线)【知识图鉴】单元讲练测选择性必修2第二章02练基础重庆市第一中学2022-2023学年高二上学期期末考试化学试题湖南省长沙市湖南师范大学附属中学2022-2023学年高二上学期期末考试化学试题北京市顺义区第一中学2022-2023学年高二下学期3月月考化学试题广东省韶关市新丰县第一中学2022-2023学年高二3月月考化学试题四川省自贡市2022-2023学年高二下学期期末考试化学试题浙江省绍兴市柯桥区2022-2023学年高一下学期期末教学质量检测化学(实验班)试题 湖南师范大学附属中学2022-2023学年高二上学期期末考试化学试题(已下线)第4讲 空间构型北京师范大学第二附属中学2023-2024学年高二上学期12月月考化学试题 江西省宜春市宜丰中学2023-2024学年高二上学期12月月考化学试题(已下线)第04讲 分子的空间结构-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)辽宁省葫芦岛市普通高中2023-2024学年高二上学期学业质量监测考试化学试题江西省宜春市上高中学2023-2024学年高二上学期第二次月考化学试卷 (已下线)热点04 分子的空间结构(已下线)广东省深圳中学2023-2024学年高二上学期期末考试化学试题(已下线)广东省深圳市深圳中学2023-2024学年高二上学期期末考试化学试题四川省达州市高级中学校2023-2024学年高二下学期3月月考化学试题广东省潮州市饶平县第二中学2023-2024学年高二下学期第一次月考化学试题
名校
解题方法
5 . 我国科学家发明了高选择性的二氧化碳加氢合成甲醇( )的催化剂,其组成为
)的催化剂,其组成为 固溶体。四方体
固溶体。四方体 晶胞如图所示,回答下列问题:
晶胞如图所示,回答下列问题:
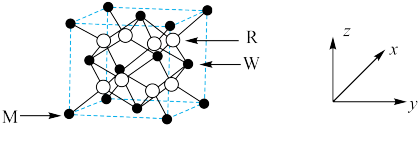
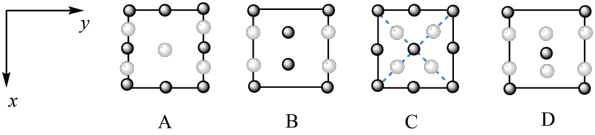
(1)图示晶胞中R代表___________ (填“O”或“ ”)原子,判断的理由为
”)原子,判断的理由为___________ 。
(2)关于 分子:
分子:
①该分子中氧原子采取的杂化类型为___________ 。
②该分子中的碳原子的价层电子对数为___________ 。
③有机物大多难溶于水,而甲醇可以与水互溶,其原因为___________ 。
(3)原子坐标参数表示晶胞内部各原子的相对位置,在如上图所示的晶胞中:
①若M原子的坐标参数为 ,W原子的坐标参数为
,W原子的坐标参数为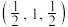 ,则R原子的坐标参数为
,则R原子的坐标参数为___________ 。
② 晶胞在z轴方向的投影图为
晶胞在z轴方向的投影图为___________ (填标号)。
(4)查阅资料可知: 的熔点为2700℃,沸点为4300℃且熔融状态下可导电。
的熔点为2700℃,沸点为4300℃且熔融状态下可导电。
① 属于
属于___________ (填“分子”、“原子”或“离子”)晶体。
②假设 的密度为
的密度为
 ,摩尔质量为M
,摩尔质量为M ,
, 表示阿伏加德罗常数的值,则晶胞中
表示阿伏加德罗常数的值,则晶胞中 原子和O原子的最短距离为
原子和O原子的最短距离为___________  (列式表示即可)。
(列式表示即可)。
 )的催化剂,其组成为
)的催化剂,其组成为 固溶体。四方体
固溶体。四方体 晶胞如图所示,回答下列问题:
晶胞如图所示,回答下列问题:
(1)图示晶胞中R代表
 ”)原子,判断的理由为
”)原子,判断的理由为(2)关于
 分子:
分子:①该分子中氧原子采取的杂化类型为
②该分子中的碳原子的价层电子对数为
③有机物大多难溶于水,而甲醇可以与水互溶,其原因为
(3)原子坐标参数表示晶胞内部各原子的相对位置,在如上图所示的晶胞中:
①若M原子的坐标参数为
 ,W原子的坐标参数为
,W原子的坐标参数为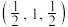 ,则R原子的坐标参数为
,则R原子的坐标参数为②
 晶胞在z轴方向的投影图为
晶胞在z轴方向的投影图为
(4)查阅资料可知:
 的熔点为2700℃,沸点为4300℃且熔融状态下可导电。
的熔点为2700℃,沸点为4300℃且熔融状态下可导电。①
 属于
属于②假设
 的密度为
的密度为
 ,摩尔质量为M
,摩尔质量为M ,
, 表示阿伏加德罗常数的值,则晶胞中
表示阿伏加德罗常数的值,则晶胞中 原子和O原子的最短距离为
原子和O原子的最短距离为 (列式表示即可)。
(列式表示即可)。
您最近一年使用:0次
名校
解题方法
6 . 磷是人体中含量较高的元素之一,磷的化合物在药物生产和农药制造等方面用途非常广泛,下列说法正确的是


| A.红磷与白磷(结构如图所示)互为同位素 |
B.基态磷原子的价层电子排布式为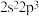 |
C.白磷分子中磷原子的杂化方式为 |
| D.白磷分子含有的化学键类型为范德华力 |
您最近一年使用:0次
解题方法
7 . 钛被称为继铁、铝之后的“第三金属”,钛及其化合物在化工、医药、材料等领域有着广泛的应用,一种制备金属钛的工艺流程如图所示:

回答下列问题:
(1)写出基态钛原子的电子排布式;___________ ,与钛同周期的过渡元素中,基态原子的成对电子数与钛相同的有___________ 种。
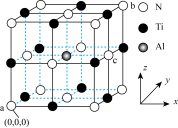
(2)金属钛(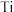 )与氮形成的某种化合物常被用作高温结构材料和超导材料。研究表明,用
)与氮形成的某种化合物常被用作高温结构材料和超导材料。研究表明,用 代替其中部分的
代替其中部分的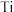 可提升耐磨性5倍以上,掺杂
可提升耐磨性5倍以上,掺杂 后的晶胞结构如图所示。已知该晶体属立方晶系,其中原子坐标参数a为
后的晶胞结构如图所示。已知该晶体属立方晶系,其中原子坐标参数a为 、b为
、b为 ,则c的原子坐标参数为
,则c的原子坐标参数为___________ 。
(3)纳米 是一种应用广泛的催化剂,其催化作用的一个实例如图所示:
是一种应用广泛的催化剂,其催化作用的一个实例如图所示:
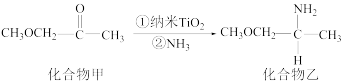
化合物甲中碳原子的杂化方式有___________ ;化合物乙的沸点明显高于化合物甲,主要原因是___________ 。
(4)已知 在通常情况下是无色液体,熔点为
在通常情况下是无色液体,熔点为 ℃,沸点为136℃,结构与
℃,沸点为136℃,结构与 相似,但
相似,但 稳定性比
稳定性比 差,试从化学键角度分析原因
差,试从化学键角度分析原因___________ 。

回答下列问题:
(1)写出基态钛原子的电子排布式;
(2)金属钛(
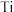 )与氮形成的某种化合物常被用作高温结构材料和超导材料。研究表明,用
)与氮形成的某种化合物常被用作高温结构材料和超导材料。研究表明,用 代替其中部分的
代替其中部分的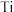 可提升耐磨性5倍以上,掺杂
可提升耐磨性5倍以上,掺杂 后的晶胞结构如图所示。已知该晶体属立方晶系,其中原子坐标参数a为
后的晶胞结构如图所示。已知该晶体属立方晶系,其中原子坐标参数a为 、b为
、b为 ,则c的原子坐标参数为
,则c的原子坐标参数为
(3)纳米
 是一种应用广泛的催化剂,其催化作用的一个实例如图所示:
是一种应用广泛的催化剂,其催化作用的一个实例如图所示: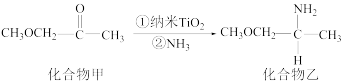
化合物甲中碳原子的杂化方式有
(4)已知
 在通常情况下是无色液体,熔点为
在通常情况下是无色液体,熔点为 ℃,沸点为136℃,结构与
℃,沸点为136℃,结构与 相似,但
相似,但 稳定性比
稳定性比 差,试从化学键角度分析原因
差,试从化学键角度分析原因
您最近一年使用:0次
8 . 氯仿( )常因保存不慎而被氧化,产生剧毒物光气(
)常因保存不慎而被氧化,产生剧毒物光气( ):
):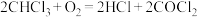 。下列说法正确的是
。下列说法正确的是

 )常因保存不慎而被氧化,产生剧毒物光气(
)常因保存不慎而被氧化,产生剧毒物光气( ):
):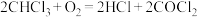 。下列说法正确的是
。下列说法正确的是
A. 和 和 的中心原子均为sp³杂化 的中心原子均为sp³杂化 |
B. 的空间结构为正四面体形 的空间结构为正四面体形 |
C. 、 、 是常用的非极性有机溶剂光气的结构式 是常用的非极性有机溶剂光气的结构式 |
| D.使用前可用硝酸银稀溶液检验氯仿是否变质 |
您最近一年使用:0次
解题方法
9 . 一种新型电池的电解质是由短周期主族元素组成的化合物,结构如图所示。其中元素W、X、Y、Z位于元素周期表的同一周期,Y的最外层电子数是X次外层电子数的3倍。下列叙述错误的是
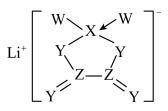

A.第一电离能: |
B.最高价氧化物对应水化物的酸性: |
C.W、X、Y、Z对应的单质中,最易与 形成气态氢化物的是W的单质 形成气态氢化物的是W的单质 |
D.化合物 中心原子的杂化类型为 中心原子的杂化类型为 |
您最近一年使用:0次
解题方法
10 . 铁、钴均为第四周期第Ⅷ族元素,它们的单质及其化合物均具有广泛用途。
(1)基态Co2+中未成对电子数为_____ ;Fe和Co的第三电离能:I3(Fe)______ I3(Co)(填“>”“<”或“=”)。
(2)化学上可用EDTA测定Fe2+和Co2+的含量。EDTA的结构简式如图所示:
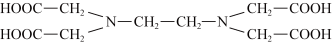
①EDTA中电负性最大的元素是______ (填元素符号),其中C原子的杂化轨道类型为______ 。
②EDTA分子中存在的化学键有_____ (填选项字母)。
a.离子键 b.共价键 c.氢键 d.σ键 e.π键 f.配位键
(3)将1molCoCl3·4NH3溶于水中,加入足量AgNO3溶液生成1molAgCl沉淀。则CoCl3·4NH3中配离子的化学式为_____ 。已知孤电子对与成键电子对的排斥作用大于成键电子对的排斥作用,则NH3分子与Co3+形成配合物后,H-N-H键角______ (填“变大”“变小”或“不变”)。
(4)一种铁氮化合物具有高磁导率,其结构如图所示。已知晶体的密度为ρg•cm-3,阿伏加德罗常数的值为NA。
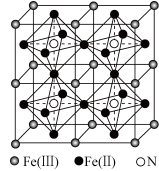
①该铁氮化合物的化学式为______ 。
②一个晶胞内Fe(Ⅱ)构成的一个正八面体的体积为______ cm3。
(1)基态Co2+中未成对电子数为
(2)化学上可用EDTA测定Fe2+和Co2+的含量。EDTA的结构简式如图所示:
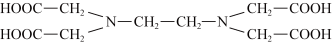
①EDTA中电负性最大的元素是
②EDTA分子中存在的化学键有
a.离子键 b.共价键 c.氢键 d.σ键 e.π键 f.配位键
(3)将1molCoCl3·4NH3溶于水中,加入足量AgNO3溶液生成1molAgCl沉淀。则CoCl3·4NH3中配离子的化学式为
(4)一种铁氮化合物具有高磁导率,其结构如图所示。已知晶体的密度为ρg•cm-3,阿伏加德罗常数的值为NA。

①该铁氮化合物的化学式为
②一个晶胞内Fe(Ⅱ)构成的一个正八面体的体积为
您最近一年使用:0次



