解题方法
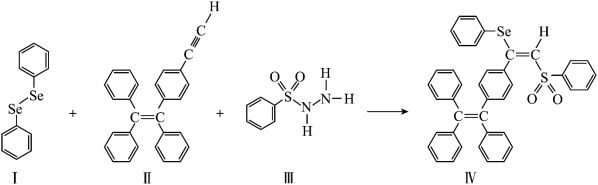
1 . AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子Ⅳ的合成路线如下:
(1)基态硫原子中,核外电子占据最高能层的符号是______ ,硫元素在周期表中位于_____ 区。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态硒原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态硒原子,其价电子自旋磁量子数的代数和为_______ 。
(3)物质Ⅰ为______ (填“极性”或“非极性”)分子。物质Ⅰ、Ⅱ、Ⅲ在水中溶解度较大的是_____ (填序号),原因是___________ 。
(4)每个物质Ⅲ分子中采取 杂化的原子有
杂化的原子有___ 个。
(1)基态硫原子中,核外电子占据最高能层的符号是
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态硒原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态硒原子,其价电子自旋磁量子数的代数和为(3)物质Ⅰ为
(4)每个物质Ⅲ分子中采取
 杂化的原子有
杂化的原子有
您最近一年使用:0次
解题方法
2 . 三氯化硼的熔点为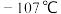 ,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述错误的是
,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述错误的是
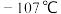 ,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述错误的是
,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述错误的是| A.三氯化硼分子间不含氢键 | B.三氯化硼中心原子采用 杂化 杂化 |
| C.三氯化硼分子呈正三角形,属非极性分子 | D.其分子空间结构类似三氯化氮 |
您最近一年使用:0次
3 . 已知 与少量
与少量 的反应为
的反应为 。下列说法正确的是
。下列说法正确的是
 与少量
与少量 的反应为
的反应为 。下列说法正确的是
。下列说法正确的是A. 分子中含 分子中含 键 键 | B. 分子中含 分子中含  键 键 |
C. 分子中含孤电子对 分子中含孤电子对 | D.热稳定性: |
您最近一年使用:0次
4 . 砷化镍可用于制作发光器件、半导体激光器、太阳能电池和高速集成电路。
(1)第一电离能:As___________ (填“>”或“<”)Se.
(2)As2O3是两性氧化物,As2O3溶于盐酸生成AsCl3,AsCl3用LiAlH4还原生成AsH3。___________ (填“>”“=”或“<”)109°28′。
(3)有机砷 是治疗昏睡病的药物,它存在的化学键种类有
是治疗昏睡病的药物,它存在的化学键种类有___________ (填字母)。
a.离子键 b.σ键
c.π键 d.碳碳双键
(4)氮与砷同族,氮元素是植物生长所需的元素,常见氮肥有铵盐(NH )、尿素(
)、尿素(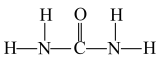 )等,NH
)等,NH 中H—N—H的键角
中H—N—H的键角___________ (填“>”“<”“=”)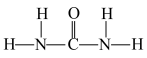 中N—C—N的键角;1 mol尿素分子含有σ键的数目为
中N—C—N的键角;1 mol尿素分子含有σ键的数目为___________ 。
(1)第一电离能:As
(2)As2O3是两性氧化物,As2O3溶于盐酸生成AsCl3,AsCl3用LiAlH4还原生成AsH3。
①AlH 的中心原子的杂化方式为
的中心原子的杂化方式为
(3)有机砷
 是治疗昏睡病的药物,它存在的化学键种类有
是治疗昏睡病的药物,它存在的化学键种类有a.离子键 b.σ键
c.π键 d.碳碳双键
(4)氮与砷同族,氮元素是植物生长所需的元素,常见氮肥有铵盐(NH
 )、尿素(
)、尿素(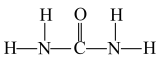 )等,NH
)等,NH 中H—N—H的键角
中H—N—H的键角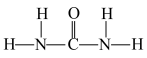 中N—C—N的键角;1 mol尿素分子含有σ键的数目为
中N—C—N的键角;1 mol尿素分子含有σ键的数目为
您最近一年使用:0次
名校
解题方法
5 . 下列说法正确的是
A.基态Cu的核外电子排布式为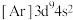 |
B. 中B的杂化方式为 中B的杂化方式为 杂化 杂化 |
C. 分子为非极性分子 分子为非极性分子 |
| D.C、N、O三种元素第一电离能从大到小的顺序是O>N>C |
您最近一年使用:0次
名校
解题方法
6 . 共价化合物 中所有原子均满足8电子稳定结构,一定条件下可发生反应:
中所有原子均满足8电子稳定结构,一定条件下可发生反应:
 ,下列说法
,下列说法不正确 的是
 中所有原子均满足8电子稳定结构,一定条件下可发生反应:
中所有原子均满足8电子稳定结构,一定条件下可发生反应:
 ,下列说法
,下列说法A. 的结构式为 的结构式为 |
B. 为非极性分子 为非极性分子 |
C. 中Al是 中Al是 杂化 杂化 |
D.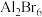 比 比 更难与 更难与 发生反应 发生反应 |
您最近一年使用:0次
名校
解题方法
7 . 观察下列模型并结合信息,判断有关说法错误的是
| 晶体硼结构单元(有12个B原子) |  |  分子 分子 | HCN | |
| 结构模型示意图 |
|
|
|
|
A.晶体硼的结构单元中含有30个 键,含20个正三角形 键,含20个正三角形 |
B. 结构中键角1、2、3由大到小的顺序:3>1>2 结构中键角1、2、3由大到小的顺序:3>1>2 |
C.固态硫 中S原子为 中S原子为 杂化 杂化 |
D. 的结构式为 的结构式为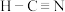 |
您最近一年使用:0次
2024-03-30更新
|
1152次组卷
|
2卷引用:山西省大同市第一中学校2023-2024学年高二下学期3月月考化学试题
名校
8 . 某芳香烃A是一种重要的有机化工原料。以它为初始原料经过如下转化可以合成扁桃酸、医药中间体G等多种物质。

已知:①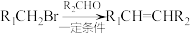
② 为间位定位基团
为间位定位基团
(1)扁桃酸分子中碳原子的杂化类型___________ 。
(2)C→D的化学方程式是___________ 。
(3) 的化学名称是
的化学名称是___________ 。
(4)写出由单体G通过加聚反应所得产物的结构简式___________ 。
(5)G有多种同分异构体,同时满足下列条件的同分异构体有___________ 种(不考虑立体异构)。
①属于芳香族化合物,且分子中含有的环只有苯环
②能发生银镜反应和水解反应
(6)已知 ,某兴趣小组用A为原料合成阿司匹林的前体水杨酸
,某兴趣小组用A为原料合成阿司匹林的前体水杨酸 ,请设计合成路线:
,请设计合成路线:___________ 。

已知:①
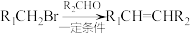
②
 为间位定位基团
为间位定位基团(1)扁桃酸分子中碳原子的杂化类型
(2)C→D的化学方程式是
(3)
 的化学名称是
的化学名称是(4)写出由单体G通过加聚反应所得产物的结构简式
(5)G有多种同分异构体,同时满足下列条件的同分异构体有
①属于芳香族化合物,且分子中含有的环只有苯环
②能发生银镜反应和水解反应
(6)已知
 ,某兴趣小组用A为原料合成阿司匹林的前体水杨酸
,某兴趣小组用A为原料合成阿司匹林的前体水杨酸 ,请设计合成路线:
,请设计合成路线:
您最近一年使用:0次
名校
解题方法
9 . 金属镍广泛应用于制造记忆合金、储氢合金以及用作加氢反应的催化剂,是重要的战略物资,但资源匮乏。从某废镍渣(含 、NiO、FeO、
、NiO、FeO、 )中回收金属镍并转化为
)中回收金属镍并转化为 的流程如图所示:
的流程如图所示:
(1)“滤液A”中主要溶质的化学式为________ 。
(2)“焙烧”后金属元素以硫酸盐的形式存在,写出NiO与 反应的化学方程式:
反应的化学方程式:_______ 。
(3)使用95℃热水“溶解”后过滤,所得“滤渣”的主要成分的化学式是______ 。
(4)①“萃取”时发生反应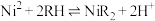 (RH为萃取剂),一定条件下,萃取平衡时,
(RH为萃取剂),一定条件下,萃取平衡时, ,则
,则 的苯取率为
的苯取率为_______ 。
②反萃取获得 ,溶液的实验操作是
,溶液的实验操作是______ 。
(5) 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料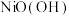 ,该反应的离子方程式为
,该反应的离子方程式为_________ 。
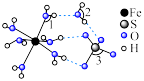
(6)镍能形成多种不同的化合物。图a是镍的一种配合物结构,图b是镍的一种氧化物的结构,下列说法不正确的是_________(填字母)。
 、NiO、FeO、
、NiO、FeO、 )中回收金属镍并转化为
)中回收金属镍并转化为 的流程如图所示:
的流程如图所示:
(1)“滤液A”中主要溶质的化学式为
(2)“焙烧”后金属元素以硫酸盐的形式存在,写出NiO与
 反应的化学方程式:
反应的化学方程式:(3)使用95℃热水“溶解”后过滤,所得“滤渣”的主要成分的化学式是
(4)①“萃取”时发生反应
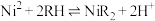 (RH为萃取剂),一定条件下,萃取平衡时,
(RH为萃取剂),一定条件下,萃取平衡时, ,则
,则 的苯取率为
的苯取率为②反萃取获得
 ,溶液的实验操作是
,溶液的实验操作是(5)
 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料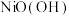 ,该反应的离子方程式为
,该反应的离子方程式为(6)镍能形成多种不同的化合物。图a是镍的一种配合物结构,图b是镍的一种氧化物的结构,下列说法不正确的是_________(填字母)。
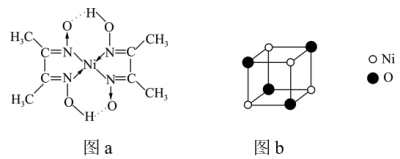
A.图a中,电负性 |
| B.图a分子中存在的化学键有共价键、配位键、氢键 |
| C.图b是氧化镍(NiO)的一个晶胞 |
D.氧化镍中 、 、 的配位数都是6 的配位数都是6 |
您最近一年使用:0次
2024-01-05更新
|
256次组卷
|
5卷引用:山西省运城市新绛县第二中学2023-2024学年高三上学期1月月考理综试题
名校
10 . 某室温离子液体的结构如图所示(Me、Bu分别表示甲基、丁基),其组成元素中X、Y、Z均为短周期元素且原子序数依次增大,X的第一电离能大于同周期的相邻元素,Y、Z元素原子的p轨道各有1个未成对电子,其中环状结构中存在大π键。下列说法错误的是
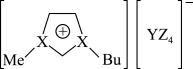
A.离子半径大小: |
B.该离子液体中,X和Y分别为 、 、 杂化 杂化 |
| C.X、Z的简单氢化物能反应生成离子化合物 |
| D.该离子液体中,存在的化学键有共价键、离子键、配位键 |
您最近一年使用:0次
2024-01-05更新
|
102次组卷
|
3卷引用:山西省运城市新绛县第二中学2023-2024学年高三上学期1月月考理综试题