23-24高三下·陕西西安·阶段练习
解题方法
1 . CdS、ZnS等硫化物与TiO2、SnO2、ZnO等进行复合,可以得到性能很好的复合半导体光催化剂。回答下列问题:
(1)Sn与C同主族,基态Sn原子的价层电子排布式为_______ ,基态Ti原子核外电子有_______ 种空间运动状态, 核外未成对电子数为
核外未成对电子数为_______ ,ZnS、ZnO中各元素的电负性由大到小的顺序为_______ 。
(2)许多具有—C═N—结构的分子及其硼配合物是较好的荧光材料,在光学探针、有机发光二极管等领域受到广泛关注,某两种含这种结构的分子如图1、图2所示。_______ ;图2中N原子会和B原子形成配位键,成键时_______ (填元素符号)原子提供空轨道。
(3)N、O、F三种元素的第一电离能由大到小的顺序为_______ (填元素符号),解释其原因:_______ 。
(4)钾冰晶石型晶体是一类新型的无机闪烁体,在核安全以及国土安全检查方面有重要的应用。如图是一种钾冰晶石型闪烁体的晶胞结构,属于立方晶系,其中A位是 、B位是
、B位是 、R位是正三价的Y(钇),X位是
、R位是正三价的Y(钇),X位是 。
。_______ 。
②若晶胞参数为anm,该晶体的密度为_______ g (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)Sn与C同主族,基态Sn原子的价层电子排布式为
 核外未成对电子数为
核外未成对电子数为(2)许多具有—C═N—结构的分子及其硼配合物是较好的荧光材料,在光学探针、有机发光二极管等领域受到广泛关注,某两种含这种结构的分子如图1、图2所示。

(3)N、O、F三种元素的第一电离能由大到小的顺序为
(4)钾冰晶石型晶体是一类新型的无机闪烁体,在核安全以及国土安全检查方面有重要的应用。如图是一种钾冰晶石型闪烁体的晶胞结构,属于立方晶系,其中A位是
 、B位是
、B位是 、R位是正三价的Y(钇),X位是
、R位是正三价的Y(钇),X位是 。
。
②若晶胞参数为anm,该晶体的密度为
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
名校
解题方法
2 . 物质的组成与结构决定了物质的性质与变化。回答下列问题:
(1)基态铁原子简化的电子排布式为[Ar]___________ 。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是___________ 。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为___________ ,提供孤电子对的成键原子是___________ 。
③氨的沸点高于膦(PH3)的原因是___________ ;PH3分子中P原子的杂化轨道类型为___________ 。
(3)铜与(SCN)2反应生成Cu(SCN)2,1mol(SCN)2中含有π键的数目为___________ 。
(4)碘与锰形成的某种化合物晶胞结构及参数如图所示,该化合物的化学式是___________ ,其晶体密度的计算表达式为___________ g·cm-3(阿伏加德罗常数的值用NA表示)。

(1)基态铁原子简化的电子排布式为[Ar]
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为
③氨的沸点高于膦(PH3)的原因是
(3)铜与(SCN)2反应生成Cu(SCN)2,1mol(SCN)2中含有π键的数目为
(4)碘与锰形成的某种化合物晶胞结构及参数如图所示,该化合物的化学式是

您最近一年使用:0次
名校
解题方法
3 . 2019年,我国第二艘国产航母即将下水。建造航母需要大量的新型材料。航母的龙骨要耐冲击,甲板要耐高温,外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,其中主要金属为铬、镍、铁等。基态铬的价电子排布图为:_______ ;基态铁的未成对电子数是:_______ ;我们常用SCN-检验Fe3+,请写出SCN-的电子式:_______ 。
(2)海水中含有大量盐,对金属有很强的腐蚀性,其中大多数盐是卤盐。根据下列卤化钠的信息回答问题
NaF的熔点比NaI的熔点高的原因是:_______ 。
(3)钛的“热传导系数低”,耐高温耐腐蚀,所以配备垂直起降战斗机的甲板是需要钛合金铆钉的。
①在钛合金中添加硅可以提高其耐热性能。硅在自然界中主要以二氧化硅和硅酸盐的形式存在,在硅酸盐中 的空间构型为
的空间构型为_______ ,在二氧化硅中硅原子的杂化方式为_______ 。
②在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1∶5,则该配离子的化学式为:_______ 。
(1)镍铬钢抗腐蚀性能强,其中主要金属为铬、镍、铁等。基态铬的价电子排布图为:
(2)海水中含有大量盐,对金属有很强的腐蚀性,其中大多数盐是卤盐。根据下列卤化钠的信息回答问题
| 化学式 | NaF | NaCl | NaBr | NaI |
| 熔点/℃ | 995 | 801 | 775 | 651 |
NaF的熔点比NaI的熔点高的原因是:
(3)钛的“热传导系数低”,耐高温耐腐蚀,所以配备垂直起降战斗机的甲板是需要钛合金铆钉的。
①在钛合金中添加硅可以提高其耐热性能。硅在自然界中主要以二氧化硅和硅酸盐的形式存在,在硅酸盐中
 的空间构型为
的空间构型为②在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1∶5,则该配离子的化学式为:
您最近一年使用:0次
9-10高二下·辽宁锦州·期末
名校
解题方法
4 . 如图所示,在乙烯分子中有5个σ键和一个π键,它们分别是
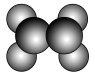
| A.sp2杂化轨道形成σ键,未杂化的2p轨道形成π键 |
| B.sp2杂化轨道形成π键,未杂化的2p轨道形成σ键 |
| C.C—H之间是sp2形成σ键,C—C之间是未参加杂化的2p轨道形成π键 |
| D.C—C之间是sp2形成σ键,C—H之间是未参加杂化的2p轨道形成π键 |
您最近一年使用:0次
2021-12-25更新
|
1585次组卷
|
66卷引用:2015届西藏拉萨中学高三第一次月考化学试卷
(已下线)2015届西藏拉萨中学高三第一次月考化学试卷2015届西藏拉萨中学高三第一次月考化学试卷22015-2016学年西藏日喀则一中高二10月月考化学试卷2014-2015学年辽宁实验分校高二下6月阶段测试化学试卷2015-2016学年吉林省吉林五十五中高二下3月月考化学试卷2015-2016学年陕西西藏民族学院附中高二4月月考化学卷2015-2016学年广东汕头金山中学高二下第十二周练化学卷2015-2016学年山西省右玉一中高二5月月考化学试卷2015-2016学年河南省三门峡市灵宝一中高二下第一次月考化学试卷2015-2016学年山西省朔州市右玉一中高二下5月月考化学试卷河北省蠡县中学2016-2017学年高二6月月考化学试题河南省焦作市博爱一中2016-2017学年高二下学期第一次月考化学试题河北省石家庄市鹿泉一中2017-2018学年高二3月月考化学试题山东省单县五中2017-2018学年高二下学期第一次月考化学试题【全国百强校】宁夏吴忠中学2017-2018学年高二6月月考化学试题河南省林州市第一中学2019-2020学年高二3月线上调研考试化学试题宁夏育才中学2019-2020学年高二下学期开学检测化学试题河北省邯郸市大名县第一中学2019-2020学年高二下学期第四次半月考化学试题(清北班)内蒙古赤峰第二实验中学2021届高三模拟考试(一)化学试题宁夏青铜峡市高级中学2020-2021学年高二下学期第一次月考化学试题河南省开封市五县2020-2021学年高二下学期月考化学试题云南省楚雄彝族自治州民族中学2021-2022学年高二下学期3月月考化学试题四川省宜宾市南溪区第二中学校2021-2022学年高二上学期12月月考化学试题(已下线)09—10年锦州市高二下学期期末考试化学卷(已下线)09~10年银川一中高二下学期期末考试化学卷(已下线)2010-2011学年山东省兖州市高二下学期期中考试化学试卷(已下线)2011-2012学年陕西省师大附中高二下学期期中考试化学试卷(已下线)2012--2013学年新疆乌鲁木齐市一中高二下学期期中考试化学试卷(平行班)(已下线)2012-2013学年宁夏银川一中高二下学期期末考试化学试卷(已下线)2014年高二鲁科版选修3化学规范训练2.2.1典型分子空间构型练习卷(已下线)2013届新疆乌鲁木齐市一中高二第二学期期中考试化学试卷2014-2015江苏省南通中学高二上学期期末化学(理)试卷2014-2015学年吉林省吉林市第一中学高二下期末化学试卷内蒙古包头市第三十三中学2016-2017学年高二下学期期末考试化学试题河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:2.2 第2课时人教版2017-2018学年高二化学选修三同步训练:2.2 分子的立体构型(第2课时)新疆兵团八师一四三团一中2018-2019学年高二下学期期中考试化学试题(已下线)2019年11月26日《每日一题》2020年高考化学一轮复习—— 共价键的分类与判断2020届高三化学二轮物质结构题型专攻——分子结构与性质【选择基础专练】山东省泰安市新泰市第二中学2019-2020学年高二下期中考试化学试题山西省太原市实验中学校2019-2020学年高二下学期期中考试化学试题天津市和平区2020届高三一模化学试题甘肃省庆阳市镇原中学2019-2020学年高二下学期期末考试化学试题四川省自贡市田家炳中学2020-2021学年高二上学期开学考试化学试题安徽省蚌埠第三中学2019-2020学年高二下学期期末考试化学试题新疆哈密市第八中学2019-2020学年高二下学期期中考试化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 第二节 分子的空间结构高二选择性必修3(人教版2019)第一章 有机化合物的结构特点与研究方法 第一节 有机化合物的结构特点 课时2 有机化合物中的共价键(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 第2节 共价键与分子的空间结构(人教版2019)选择性必修2 第二章 分子结构与性质 第二节 分子的空间结构 课时2 杂化轨道理论鲁科版2019选择性必修2第2章 微粒间相互作用与物质性质 第2节 共价键与分子的空间结构 第1课时 分子空间结构的理论分析高二选择性必修2(人教版2019)第二章 分子结构与性质 第二节 分子的空间结构 课时2 杂化轨道理论(已下线)2.2.1 分子空间结构的理论分析-2020-2021学年高二化学课时同步练(鲁科2019选择性必修2)河南省汤阴县五一中学2019-2020学年高二下学期期中考试化学试题(已下线)2.2.2 杂化轨道理论简介-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)(已下线)2.2.2 杂化轨道理论(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)2.2.2 杂化轨道理论-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)课中-1.1.2 有机化合物中的共价键和有机化合物的同分异构现象-人教2019选择性必修3陕西省宝鸡市长岭中学2021-2022学年高二下学期期中考试化学试题北京交通大学附属中学2020-2021学年高二下学期期末考试化学试题(已下线)第39练 共价键-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第40练 分子的空间结构-2023年高考化学一轮复习小题多维练(全国通用)安徽省滁州市定远县育才学校2021-2022学年高二分层班下学期期中考试化学试题山东省菏泽市单县二中2021-2022学年高二下学期开学考试 化学试题2.2.2 杂化轨道理论-随堂练习(已下线)猜想02 分子结构与性质【考题猜想】)(9大题型)-2023-2024学年高二化学下学期期末考点大串讲(人教版2019)
解题方法
5 . 钢化玻璃因其优良的性能广泛应用于日常生活,但由于制作玻璃时里面含有极少量硫化镍,使得钢化玻璃在极限条件下的使用受到限制。
(1)基态硫原子价层电子的轨道表达式(电子排布图)为___ ,基态镍原子中核外电子占据最高能层的符号为__ 。
(2)Ni(CO)4常用于制备纯镍,溶于乙醇、CCl4、苯等有机溶剂,为___ 晶体,Ni(CO)4空间构型与甲烷相同,中心原子的杂化轨道类型为___ ,写出与配体互为等电子体的分子___ 。
(3)与硫同族的硒元素有两种常见的二元含氧酸分别为___ 、___ (填化学式)。
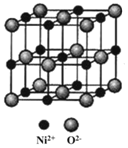
(4)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的正八面体空隙中,已知晶胞参数为apm,阿伏加德罗常数为NA,NiO晶体的密度为____ g/cm3(列出计算式 。
。
(1)基态硫原子价层电子的轨道表达式(电子排布图)为
(2)Ni(CO)4常用于制备纯镍,溶于乙醇、CCl4、苯等有机溶剂,为
(3)与硫同族的硒元素有两种常见的二元含氧酸分别为
(4)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的正八面体空隙中,已知晶胞参数为apm,阿伏加德罗常数为NA,NiO晶体的密度为
 。
。
您最近一年使用:0次
名校
解题方法
6 . 第三代太阳能电池是铜铟镓硒CIGS等化合物薄太阳能电池以及薄膜Si系太阳能电池。请回答下列问题:
(1)晶体Si中硅原子的杂化方式是_______ ,基态Ga原子的价电子排布式是_______ 。
(2)H2O沸点_______ (填“高于”或“低于”)H2Se的沸点,其原因是_______ 。
(3)向硫酸铜溶液中逐滴滴加浓氨水,先出现蓝色絮状沉淀,后沉淀逐渐溶解得到[Cu(NH3)4]SO4的深蓝色透明溶液。
①在[Cu(NH3)4]2+中,Cu2+与NH3之间形成的化学键称为_______ ,提供孤电子对的成键原子是_______ 。
②锌与铜位于同一周期。硫化锌的结构如图甲所示,硫离子周围等距离且最近的锌离子个数是_______ ;某含铜化合物的晶胞如图乙所示,晶胞上下底面为正方形,侧面与底面垂直,则该化合物的化学式是_______ ,设NA为阿伏加德罗常数的值,则该晶胞的密度是_______ g/cm3(用含a、b、NA的代数式表示)。

(1)晶体Si中硅原子的杂化方式是
(2)H2O沸点
(3)向硫酸铜溶液中逐滴滴加浓氨水,先出现蓝色絮状沉淀,后沉淀逐渐溶解得到[Cu(NH3)4]SO4的深蓝色透明溶液。
①在[Cu(NH3)4]2+中,Cu2+与NH3之间形成的化学键称为
②锌与铜位于同一周期。硫化锌的结构如图甲所示,硫离子周围等距离且最近的锌离子个数是

您最近一年使用:0次
2021-01-19更新
|
123次组卷
|
2卷引用:西藏拉萨中学2021届高三上学期第五次月考化学试题
名校
解题方法
7 . 硼砂是含结晶水的四硼酸钠。以硼砂为原料,可以得到BF3、BN和硼酸等重要化合物,请根据图中信息回答有关问题:


(1)硼砂中阴离子Xm-(含B、O、H三种元素)的球棍模型如图1所示,则在Xm-中,2号硼原子的杂化类型为_______ ;m=_______ (填数字)。
(2)BF3和过量NaF作用可生成NaBF4,BF 的价层电子对数为
的价层电子对数为_______ ;BF 的立体构型为
的立体构型为_______ 。
(3)硼酸[B(OH)3]结构如图2所示,分子中一个B原子与3个羟基相连,硼酸为一元弱酸,与过量NaOH反应生成[B(OH)4]-,请用化学键有关知识分析[B(OH)4]-的形成原因:_______ 。
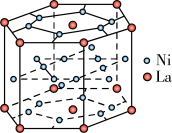
(4)镧系合金是稀土系储氢合金的典型代表,由荷兰菲利浦实验室首先研制出来。它的最大优点是容易活化。其晶胞结构如图所示,则它的化学式为_______ ,镍的价电子排布式_______ 。
(5)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为( ,
, ,0)。
,0)。

②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为_______ g·cm-3(列出计算式即可)。


(1)硼砂中阴离子Xm-(含B、O、H三种元素)的球棍模型如图1所示,则在Xm-中,2号硼原子的杂化类型为
(2)BF3和过量NaF作用可生成NaBF4,BF
 的价层电子对数为
的价层电子对数为 的立体构型为
的立体构型为(3)硼酸[B(OH)3]结构如图2所示,分子中一个B原子与3个羟基相连,硼酸为一元弱酸,与过量NaOH反应生成[B(OH)4]-,请用化学键有关知识分析[B(OH)4]-的形成原因:
(4)镧系合金是稀土系储氢合金的典型代表,由荷兰菲利浦实验室首先研制出来。它的最大优点是容易活化。其晶胞结构如图所示,则它的化学式为

(5)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C为(
);C为( ,
, ,0)。
,0)。
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为
您最近一年使用:0次
8 . 我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,近年来,人们对这些颜料的成分进行了研究,发现其成分主要为BaCuSi4O10、BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均有Cu2+,基态时该阳离子的价电子排布式为_______ 。
(2)已知Cu的第二电离能大于Zn的第二电离能,请说明原因_______ 。
(3)铜常用作有机反应的催化剂。例如,2CH3CH2OH+O2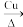 2CH3CHO+2H2O。
2CH3CHO+2H2O。
①乙醇的沸点高于乙醛,其主要原因是_______ ;乙醛分子中π键与σ键的个数比为_______ 。
②乙醛分子中碳原子的杂化轨道类型分别是_______ 、_______ 。
③乙醛分子中各元素电负性由大到小的顺序是_______ 。
(4)铜的晶胞如图所示。铜银合金是优质的金属材料,其晶胞与铜晶胞类似,银位于顶点,铜位于面心。
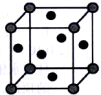
①该铜银合金的化学式是_______ 。
②该铜银晶胞参数为a cm,晶体密度为ρ g·cm-3。则阿伏加德罗常数(NA)为_______ mol-1(列出计算式即可)。
(1)“中国蓝”、“中国紫”中均有Cu2+,基态时该阳离子的价电子排布式为
(2)已知Cu的第二电离能大于Zn的第二电离能,请说明原因
(3)铜常用作有机反应的催化剂。例如,2CH3CH2OH+O2
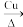 2CH3CHO+2H2O。
2CH3CHO+2H2O。①乙醇的沸点高于乙醛,其主要原因是
②乙醛分子中碳原子的杂化轨道类型分别是
③乙醛分子中各元素电负性由大到小的顺序是
(4)铜的晶胞如图所示。铜银合金是优质的金属材料,其晶胞与铜晶胞类似,银位于顶点,铜位于面心。

①该铜银合金的化学式是
②该铜银晶胞参数为a cm,晶体密度为ρ g·cm-3。则阿伏加德罗常数(NA)为
您最近一年使用:0次
名校
解题方法
9 . A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型: C、D为同周期元素,C核外电子总数是最外层层电子数的3倍;D元素最外层有—个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是_____ (填元素符号),其中C原子的核外电子排布式为_____ 。
(2)单质A有两种同素异形体,其中沸点高的是______ (填分子式);A和B的氢化物所属的晶体类型分别为_______ 和_______ 。
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为______ ,中心原子的杂化轨道类型为_____ 。
(4)单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_____ 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为_________________ ;晶胞中A原子的配位数为_______________ 。

(1)四种元素中电负性最大的是
(2)单质A有两种同素异形体,其中沸点高的是
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为
(4)单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为

您最近一年使用:0次
名校
解题方法
10 . 铂钴合金在磁控、仪表等领域有重要用途。回答下列问题:
(1)基态Co原子价层电子的轨道表达式为___________ ;Co与Ca处于同一周期,且核外最外层电子构型相同,但金属Co的熔点比金属Ca的高,原因为________________ 。
(2)Pt与Cl、吡啶( )能形成如图所示两种分子。
)能形成如图所示两种分子。
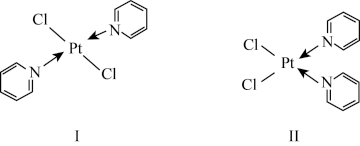
①吡啶中所含同周期元素的第一电离能由小到大的顺序为________________ 。
②1mol化合物Ⅰ中含有 键的数目为
键的数目为__________________ 。
③相同条件下,两种化合物中在水中溶解度更大的为__ (填“Ⅰ”或“Ⅱ”),原因为____ 。
(3)某Pt-Co合金的晶体堆积模型为面心立方堆积,其中Co原子处于顶角位置、Pt原子处于面心位置,则该合金的化学式为_______ 。
(4)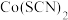 可用于检验可卡因。其中阴离子的立体构型为
可用于检验可卡因。其中阴离子的立体构型为 __ ,碳原子的杂化形式为____ 。
(5)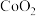 是一种磁性材料,其晶胞结构如图甲所示,俯视图如图乙所示。
是一种磁性材料,其晶胞结构如图甲所示,俯视图如图乙所示。
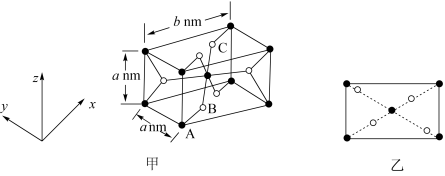
①原子坐标参数:A为(0,0,0);B为(0.31,0.31,0)。则C原子的坐标参数为__ 。
②若阿伏加 德罗常数的值为 ,则晶体密度为
,则晶体密度为___  (列出计算表达式)。
(列出计算表达式)。
(1)基态Co原子价层电子的轨道表达式为
(2)Pt与Cl、吡啶(
 )能形成如图所示两种分子。
)能形成如图所示两种分子。
①吡啶中所含同周期元素的第一电离能由小到大的顺序为
②1mol化合物Ⅰ中含有
 键的数目为
键的数目为③相同条件下,两种化合物中在水中溶解度更大的为
(3)某Pt-Co合金的晶体堆积模型为面心立方堆积,其中Co原子处于顶角位置、Pt原子处于面心位置,则该合金的化学式为
(4)
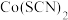 可用于检验可卡因。其中阴离子的立体构型为
可用于检验可卡因。其中阴离子的立体构型为 (5)
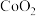 是一种磁性材料,其晶胞结构如图甲所示,俯视图如图乙所示。
是一种磁性材料,其晶胞结构如图甲所示,俯视图如图乙所示。
①原子坐标参数:A为(0,0,0);B为(0.31,0.31,0)。则C原子的坐标参数为
②若阿伏加 德罗常数的值为
 ,则晶体密度为
,则晶体密度为 (列出计算表达式)。
(列出计算表达式)。
您最近一年使用:0次



